利拉鲁肽对博来霉素诱导大鼠肺纤维化的作用及其机制研究
朱家丽,徐 健,韩宏浩,何梦钰,孔 辉,解卫平
南京医科大学第一附属医院呼吸与危重症学科,江苏 南京 210029
肺纤维化是各种慢性间质性肺病的最终阶段,其特征是肺实质破坏,成纤维细胞/肌成纤维细胞增殖与活化增多,细胞外基质沉积,最终导致肺换气功能障碍,呼吸衰竭[1-2]。肺纤维化患者病情进展快,病死率高,而目前肺纤维化的治疗手段有限且疗效欠佳,其中特发性肺纤维化患者的中位生存期仅2~4年[3]。对肺纤维化机制的进一步研究及研发安全有效的抗纤维化药物迫在眉睫。近年来研究发现,上皮间质转化(epithelial⁃mesenchymal transition,EMT)是肺纤维化发生发展的重要机制之一,是肌成纤维细胞的重要来源[4]。当上皮细胞受外界损伤因素刺激时,EMT过程被启动,上皮细胞逐渐失去极性,转化成纺锤形的间质细胞,参与肺组织重塑,细胞外基质堆积,促进肺纤维化发生发展[5]。因此,能够抑制EMT过程的药物可能成为潜在的抗肺纤维化药物。
胰高血糖素样肽⁃1(glucagon like peptide⁃1,GLP⁃1)是一种肠道L 细胞分泌的肽类激素,与其特异性受体(GLP⁃1 receptor,GLP⁃1R)结合后,可以促进胰岛素分泌,具有降血糖作用[6]。近年来发现,GLP⁃1R不仅分布于胰腺组织,在中枢神经系统、心脏、肾脏、肺等组织均有表达,生物学作用广泛[7]。利拉鲁肽(liraglutide,Li)是目前临床上常用的一种GLP⁃1类似物,用于2 型糖尿病的治疗[6]。目前已证实Li具有抗炎[8],减轻心脏[9-10]、肾脏[11]等器官纤维化的作用[11],提示其可能对纤维化过程中的重要环节⁃EMT 具有调节作用。然而,在呼吸系统中,Li 对纤维化的作用及与EMT的相关性尚未明确。因此,本研究的目的是探讨Li 对博来霉素(bleomycin,BLM)诱导大鼠肺纤维化的作用及其机制,为肺纤维化的治疗提供新的策略。
1 材料和方法
1.1 材料
Li(Novo Nordisk公司,丹麦),BLM(浙江海正药业股份有限公司),羟脯氨酸测定试剂盒(南京建成生物工程研究所),RT⁃qPCR 试剂盒(TaKaRa 公司,日本),Ⅰ型胶原蛋白α1(collagen type Ⅰalpha 1,COL1α1)、Ⅱ型胶原蛋白α1(collagen type Ⅱalpha 1,COL2α1)、Ⅲ型胶原蛋白α1(collagen type Ⅲal⁃pha 1,COL3α1)、肿瘤坏死因子(tumor necrosis fac⁃tor,TNF)⁃α、白介素(interleukin,IL)⁃6、IL⁃1β、转化生长因子β1(transforming growth factor β1,TGF⁃β1)PCR引物(上海捷瑞生物工程有限公司),大鼠TNF⁃α、IL⁃6、IL⁃1β ELISA 检测试剂盒(武汉华美生物工程有限公司),上皮细胞钙连蛋白(E⁃cadherin)、TGF⁃β1 抗体(CST公司,美国),紧密连接蛋白1(zona occluden 1,ZO⁃1)、闭合蛋白(Occludin)、β⁃actin抗体(Proteintech公司,美国),α⁃平滑肌激动蛋白(α⁃smooth muscle ac⁃tin,α⁃SMA)抗体(Abcam公司,英国)。
1.2 方法
1.2.1 动物模型的建立及给药方案
SPF 级成年健康雄性SD 大鼠40 只,体重(220±20)g,由南京医科大学动物中心提供。大鼠随机分为4 组:对照组(Con)、BLM 组、BLM+Li 组、Li 组,每组10 只。1%戊巴比妥钠腹腔麻醉后,BLM 组与BLM+Li 组大鼠予以一次性气管内注入4 U/kg BLM诱导肺纤维化,Con 组和Li 组予以等体积生理盐水。Li组和BLM+Li 组每日予以皮下注射利拉鲁肽(0.2 mg/kg),Con 组和BLM 组分别给予等体积生理盐水皮下注射。每日监测大鼠生存状态及体重变化并记录。给药28 d 后,处死大鼠,右肺中叶固定于4%多聚甲醛中,其余肺叶冻存于-80 ℃冰箱。
1.2.2 肺组织形态学分析
肺组织在4%多聚甲醛中固定24 h 后,石蜡包埋,制成4 μm厚的切片并进行HE、Masson三色及甲苯胺蓝染色,光学显微镜观察肺组织病理变化及肥大细胞浸润,每张切片随机选择10个不同视野拍照。根据肺组织切片肺泡周围间质增生及肺泡结构破坏程度,使用Ashcroft评分评估纤维化程度[12]。用Image⁃Pro Plus 6.0软件统计Masson染色图片中蓝色区域面积与总面积的比值(%),评估胶原沉积的程度。
1.2.3 肺组织羟脯胺酸含量测定
羟脯胺酸水平间接反映组织的胶原含量。称取肺组织100 mg,剪碎匀浆,根据试剂盒操作步骤采用碱水解法进行实验。
1.2.4 ELISA法检测肺组织匀浆TNF⁃α、IL⁃6、IL⁃1β水平
称取100 mg 肺组织,加入1 mL PBS 匀浆后于-20 ℃冰箱过夜,2 次冻融后,4 ℃离心机离心,3 000g,5 min,取上清。按照ELISA 试剂盒操作说明进行分析。肺组织中TNF⁃α、IL⁃6、IL⁃1β含量最终以pg/mL计算。
1.2.5 免疫荧光染色法检测肺组织E⁃cadherin 和α⁃SMA的表达
石蜡切片经二甲苯脱蜡、梯度酒精脱水后,放入柠檬酸缓冲液中进行高温修复,蒸馏水冲洗,3%过氧化氢封闭10 min,PBS 冲洗,1%BSA 湿盒内封闭1 h 后滴加含兔α⁃SMA 抗体(1∶200)、鼠E⁃cad⁃herin抗体(1∶200)的一抗,4℃摇床孵育过夜,PBS冲洗,滴加稀释的二抗(1∶1 000),室温避光孵育1 h,滴加稀释的DAPI 染色液,避光孵育10 min 后用荧光猝灭剂封片,使用激光共聚焦显微镜拍照。
1.2.6 RT⁃qPCR
TRIzol法提取大鼠肺组织总RNA,以β⁃actin为内参,按试剂盒说明进行RT⁃qPCR。引物序列见表1。
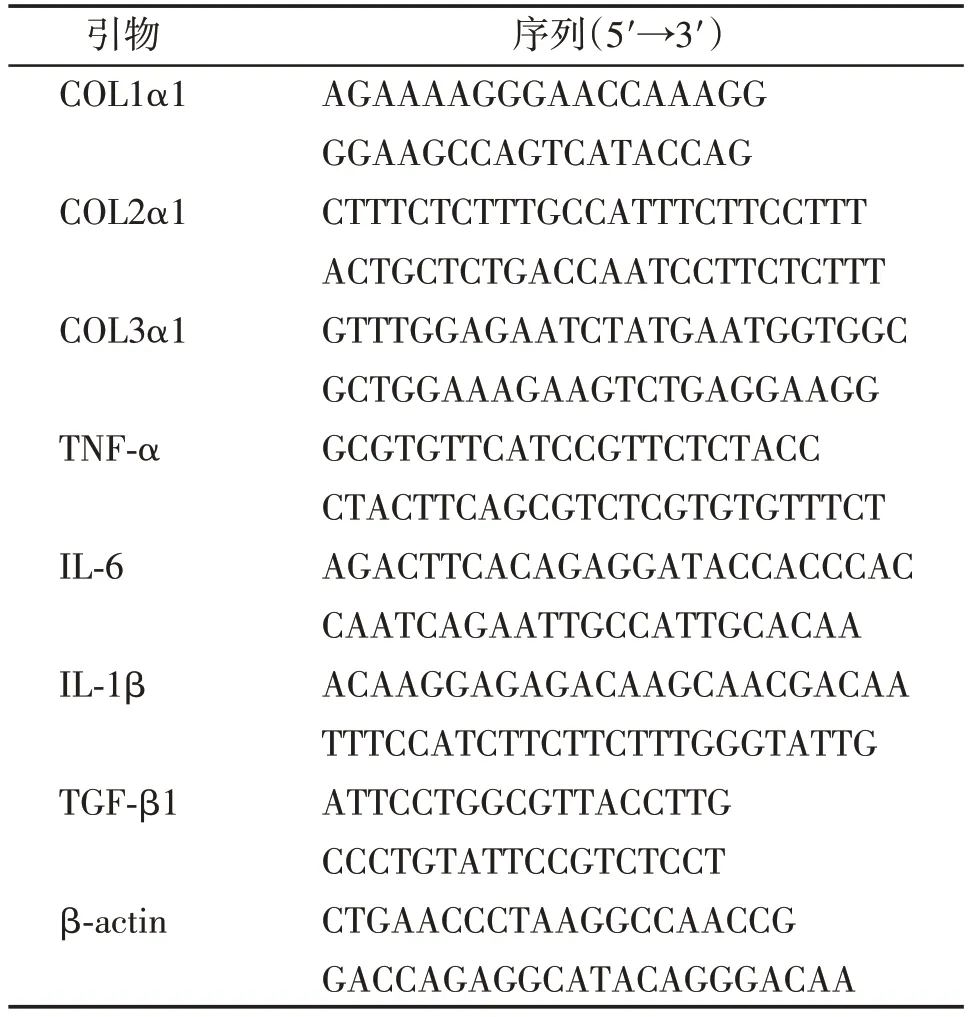
表1 目标基因的引物序列Table 1 Primer sequences of targeted genes
1.2.7 Western blot
称取大鼠肺组织,加入含蛋白酶抑制剂的RIPA裂解液,剪碎并匀浆,提取总蛋白,BCA法测蛋白含量,加入适量的5×SDS⁃PAGE蛋白上样缓冲液。蛋白每孔上样量为15 μL,10%SDS聚丙烯酰胺凝胶电泳,300 mA恒流湿转,将蛋白转移至PVDF 膜上,5%脱脂奶粉溶液室温封闭1h,再分别加入E⁃cadherin、ZO⁃1、Occludin、α⁃SMA、TGF⁃β1 抗体(1∶1 000),β⁃ac⁃tin 抗体(1∶5 000),4 ℃摇床孵育过夜,TBST洗涤后加入二抗(1∶5 000),室温孵育1 h,TBST 洗涤后均匀滴入化学发光液,上机显影,以β⁃actin为内参,使用Image J分析结果。
1.3 统计学方法
采用SPSS 20.0进行统计学分析,计量数据用均数±标准误()表示,统计分析采用单因素方差分析,组间均数比较采用LSD 法。P≤0.05 为差异有统计学意义。
2 结果
2.1 Li对BLM诱导的大鼠肺组织形态学的作用
Con和Li组肺组织结构正常,肺泡壁薄,间隔正常,无明显炎症细胞浸润;BLM 组肺泡结构破坏严重,部分肺泡出现断裂、融合,形成肺大泡,肺泡间隔明显增厚,间质炎症细胞浸润明显;BLM+Li 组肺泡破坏,间隔增厚,炎症细胞浸润程度均较BLM 组为轻。Ashcroft 评分结果显示,Con 组和Li 组Ashcroft 评分均较低,BLM 组评分明显增加(P<0.05),Li 干预后,Ashcroft 评分较BLM 组显著下降(P<0.05,图1)。
2.2 Li对BLM诱导的大鼠肺组织胶原沉积的作用
Masson 三色染色结果显示Con 和Li 组肺泡结构正常,被蓝染区域极少。BLM组肺泡结构严重破坏,肺泡融合,被蓝染区域面积显著增加,Li 干预后,上述病变减轻(图2)。统计结果显示,BLM组胶原沉积面积较Con 组显著增加(P<0.05,图2),BLM+Li 组胶原沉积较BLM 组减轻(P<0.05)。羟脯胺酸是胶原的主要成分之一,其水平间接反映组织中胶原含量。Con和Li组羟脯胺酸含量无明显差异,BLM 组羟脯胺酸含量明显增加(P<0.05,图3A),Li 治疗后其含量显著下降(P<0.05)。RT⁃qP⁃CR 结果显示BLM 组肺组织COL1α1、COL2α1、COL3α1 mRNA 水平较Con组明显升高(P<0.05,图3B~D),BLM+Li 组mRNA 水平较BLM 组显著下降(P<0.05)。
2.3 Li 对BLM 诱导的大鼠肺组织肥大细胞浸润及TNF⁃α、IL⁃6、IL⁃1β的作用
甲苯胺蓝染色显示,Con 及Li 组肺组织肥大细胞数量极少,BLM 组可见大量肥大细胞浸润(P<0.05,图4),予以利拉鲁肽治疗后肥大细胞浸润明显减少(P<0.05)。通过RT⁃qPCR检测肺组织TNF⁃α、IL⁃6、IL⁃1β的mRNA水平,ELISA法检测肺组织匀浆中TNF⁃α、IL⁃6、IL⁃1β的含量。结果显示,Con与Li组TNF⁃α、IL⁃6、IL⁃1β的表达均无明显差异。与Con组相比,BLM组肺组织TNF⁃α、IL⁃6、IL⁃1β的mRNA及蛋白表达均明显升高(P<0.05,图5),BLM+Li组TNF⁃α、IL⁃6、IL⁃1β的表达较BLM组明显减轻(P<0.05)。
2.4 Li 对BLM 诱导的大鼠肺组织TGF⁃β1 含量的影响
RT⁃qPCR 及Western blot 结果显示,Con 与Li 组TGF⁃β1表达均较低。BLM组TGF⁃β1 mRNA及蛋白表达较Con组均明显升高(P<0.05,图6),Li干预后TGF⁃β1下调(P<0.05)。
2.5 Li 对BLM诱导的大鼠肺组织EMT的影响
Western blot半定量结果显示,BLM组肺组织E⁃cadherin、ZO⁃1、Occludin 表达显著下调(P<0.05,图6A,C),α⁃SMA 明显上调(P<0.05)。与BLM 组相比,BLM+Li组E⁃cadherin、ZO⁃1、Occludin均上调,α⁃SMA 下调(P<0.05)。免疫荧光染色结果显示,Con与Li 组肺组织E⁃cadherin(红色)表达丰富,主要位于肺泡上皮细胞胞膜上,α⁃SMA(绿色)表达量少,仅在血管周围细胞胞质中可见;BLM 组肺组织E⁃cad⁃herin 表达明显下调,肺泡周围α⁃SMA 表达增多;与BLM 组相比,BLM+Li 组E⁃cadherin 表达增加,α⁃SMA表达减少(图7)。Li可抑制BLM诱导的肺组织EMT。
3 讨论
近年来发现,Li除了良好的降血糖作用外,还具有抑制心肌、肾脏纤维化的作用。Li可以减轻糖尿病小鼠心脏的胶原沉积,Ⅰ、Ⅲ型胶原蛋白表达[9]。有研究发现,在肥胖、高血压、年龄分别诱导的小鼠心脏纤维化模型中,Li治疗后小鼠心肌肥厚、胶原沉积程度减轻,MCP⁃1、波形蛋白(Vimentin)、α⁃SMA表达下调,其可能是通过抑制NF⁃κB 活化、减少超氧化物产生发挥抗炎抗纤维化作用[10]。Li 减轻了肾纤维化小鼠肾组织的胶原沉积及纤连蛋白、Ⅰ型胶原蛋白的表达[11]。上述研究结果表明Li 可以减轻组织胶原沉积程度,改善组织纤维化,提示其可能通过调节纤维化进程中的某些重要环节,发挥抗纤维化作用。本研究使用BLM 诱导的大鼠肺纤维化模型,探讨Li 的抗肺纤维化作用。结果显示,Li 可减轻BLM诱导的大鼠肺组织结构破坏,显著抑制肺组织胶原沉积,降低羟脯胺酸含量及Ⅰ、Ⅱ、Ⅲ型胶原mRNA水平,提示Li可减轻BLM诱导的肺纤维化。
BLM 诱导动物肺纤维化模型的主要特征为肺组织慢性炎症和纤维化[13]。持续的慢性炎症反应是肺纤维化发生发展的主要机制之一。当组织损伤时,循环或组织中的炎症细胞(T淋巴细胞、B淋巴细胞、巨噬细胞、中性粒细胞等)可产生大量趋化因子、细胞因子(如TNF⁃α、IL⁃1β)、生长因子(如TGF⁃β1)等,这些炎症因子可以损伤上皮细胞及内皮细胞;促进上皮及内皮间质转化;招募骨髓前体成纤维细胞;促进成纤维细胞增殖及分化,最终导致肌成纤维细胞增多,肺组织纤维化[14-15]。已有研究发现,在肺纤维化动物模型及患者肺组织均可见大量肥大细胞浸润,并与纤维化程度相关。活化的肥大细胞可释放组胺、糜蛋白酶、碱性成纤维细胞生长因子、TGF⁃β1,具有调节炎症反应及促进成纤维细胞增殖等作用[16-17]。TNF⁃α是关键的促炎因子,已被证实在肺纤维化中表达是升高的。BLM 可诱导小鼠肺组织TNF⁃α表达升高,而对于TNF⁃α受体敲除的小鼠,BLM无法诱导其肺纤维化;IL⁃6在多种慢性疾病中发挥重要的作用,可由TGF⁃β1 等因子诱导多种炎症细胞产生,促进成纤维细胞增殖,促进肺纤维化进展;IL⁃1β是新近极受关注的重要促炎因子,已被证实参与组织损伤修复,其在肺纤维化中的作用也逐渐被认识。IL⁃1β可促进成纤维细胞分化,增加细胞外基质沉积[15,18]。以上3 种炎症因子均有报道其也可通过增强TGF⁃β1 诱导的EMT 过程,在肺纤维化发展中发挥重要作用[19]。Li已被证实具有良好的抗炎效果,可减轻LPS 诱导的小鼠肺炎症浸润,抑制IL⁃1β等炎症因子的表达[8]。本研究结果显示,Li可显著抑制BLM诱导的肺组织肥大细胞等炎症细胞浸润及TNF⁃α、IL⁃6、IL⁃1β炎症因子的表达,提示Li可减轻BLM诱导的肺组织慢性炎症反应,可能是其减轻肺纤维化的重要原因之一。
TGF⁃β1 是重要的促纤维化因子,可由炎症细胞、上皮细胞等多种细胞产生,通过调节炎症、组织损伤和修复及细胞外基质代谢等,在肺纤维化的发生发展中起关键作用[20]。近年来,EMT被认为是纤维化发生发展中的重要机制之一,其中,TGF⁃β1 是诱导EMT 的关键因子[21]。缺氧、炎症、内质网应激等可显著上调TGF⁃β1水平,激活其下游信号通路:TGF⁃β1 与I 型、II 型TGF 受体结合后,I 型TGF 受体磷酸化,激活下游分子,包括Smad 2/3、MAPK等,进一步活化Snail,Twist等EMT转录因子,调控EMT相关分子的表达[22],最终导致上皮细胞表型分子E⁃cadherin、Occludin、ZO⁃1等表达下调,间质细胞标志分子Vimentin、α⁃SMA等表达上调,上皮细胞失去极性,转化成纺锤形的间质细胞,参与肺组织重塑[3,23]。已有研究证实,在BLM诱导的大鼠肺组织中TGF⁃β1表达升高[24],诱导EMT参与肺纤维化发生发展[25],且TGF⁃β1可体外诱导大鼠肺泡上皮细胞发生EMT[26]。既往研究发现,Li 抑制了肾纤维化小鼠肾组织EMT,其机制可能是通过激活GLP⁃1R,抑制TGF⁃β 1/Smad3 和TGF⁃β1/ERK1/2 通路的活化,从而抑制EMT[11]。Li 可以改善血管紧张素Ⅱ诱导的大鼠心脏纤维化,并抑制TGF⁃β1/Smad 2/3信号通路[27]。以上研究提示TGF⁃β1 可能是Li 改善心脏、肾脏纤维化过程的重要调节分子之一。在本研究中,BLM 组TGF⁃β1 表达较Con 组明显增加,Li 干预后TGF⁃β1表达明显下调,可能部分通过抑制炎症反应发挥作用。同时,我们检测了EMT 相关指标,BLM 组肺组织上皮标志分子E⁃cadherin、ZO⁃1、Occludin 表达明显下调,间质标志分子α⁃SMA 表达明显增加,Li 可抑制BLM 诱导的E⁃cadherin、ZO⁃1、Occludin 下调及α⁃SMA上调。结果表明Li可抑制肺组织EMT,可能与下调TGF⁃β1的表达有关。
GLP⁃1R是一种G蛋白偶联受体,当GLP⁃1与其结合后,G蛋白被激活,活化腺苷酸环化酶,使得胞内cAMP浓度升高,依赖cAMP的蛋白激酶A(protein ki⁃nase A,PKA)被激活,产生广泛的生物学效应[6]。已有研究发现,GLP⁃1 可能部分通过激活cAMP⁃PKA信号通路,下调高糖诱导的人肾小球系膜细胞TGF⁃β1 的表达[28]。cAMP⁃PKA 信号通路亦参与缺氧诱导的A549 细胞EMT 过程[29]。因此,推测Li 可能通过与GLP⁃1R结合,激活cAMP⁃PKA通路,抑制TGF⁃β1 诱导的EMT。在今后研究中,将进一步探讨Li如何调控肺组织EMT及其对TGF⁃β1下游通路的影响。
肺纤维化患者预后差,传统药物(强的松、乙酰半胱氨酸等)的治疗已被证实的无效的。近年来研究显示吡非尼酮或尼达尼布可改善肺纤维化,延缓患者肺功能的恶化,然而其有效性及安全性均未完全明确[3]。吡非尼酮已在国内上市,但价格昂贵,尼达尼布目前尚未在国内上市。而本研究发现Li 可明显减轻BLM诱导的肺纤维化,其机制可能与减轻肺组织炎症反应,下调TGF⁃β1 水平,抑制肺组织EMT 有关,且Li 作为临床广泛使用的治疗2 型糖尿病的降糖药物,其安全性已被广泛证实,价格便宜,使用便利,有望成为未来治疗肺纤维化的候选药物之一。

