乔松素对对乙酰氨基酚诱发的肝损伤小鼠模型的保护作用
杜毅超, 张 浩, 仲富瑞, 程宦立, 赖 莉, 钱保林, 谭 鹏, 夏先明, 付文广
西南医科大学附属医院 a. 四川省院士(专家)工作站; b. 肝胆外科, 四川 泸州 646000
药物性肝损伤是指由各种药物、草药或其他外源性药物引起的肝脏指标检查异常或肝功能障碍[1]。对乙酰氨基酚(acetaminophen,APAP)是一种常用的解热镇痛类非处方药,过量APAP诱导的肝毒性仍然是急性肝衰竭最常见的病因[2]。氧化应激及线粒体功能障碍是APAP致肝损伤的重要机制[3]。赶黄草(Penthorum Chinense Pursh)为虎耳草科(Saxifragaceae)扯根菜属苗族地区药食两用植物[4]。赶黄草水煎剂已传承千年并被制成肝苏颗粒用于治疗慢性活动性肝炎、急慢性乙型肝炎等肝脏疾病[5],其主要活性成分乔松素(pinocembrin,PIN)对肝纤维化[6]、感染性休克、癌症、心血管病等疾病有治疗作用,此外,PIN已被中国食品药品监督管理局批准用于脑缺血中风患者的临床治疗,并已进入临床Ⅱ期试验研究[7]。但未见其运用于急性肝病的研究,特别是药物性肝损伤的研究。本实验通过建立APAP小鼠药物性肝损伤模型,探究给予不同剂量PIN处理后各项生化指标变化,探讨PIN对APAP诱导的小鼠肝损伤的保护作用。
1 材料与方法
1.1 实验动物 6~8周龄雄性SPF级C57BL/6J小鼠50只,体质量(20±2)g,购自成都达硕实验动物有限公司,许可证号SCXK(川)2015-030。本研究方案经由西南医科大学实验动物伦理委员会审批(批号:201906-50),符合实验室动物管理与使用准则。
1.2 主要试剂 PIN(纯度≥98%)由大连医科大学从赶黄草提取并提供;ALT、AST、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购自南京建成生物工程研究所;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;其他试剂均为国产分析纯。
1.3 主要仪器 高速冷冻离心机、全光谱分光光度计均购自美国Thermo Fisher Scientific公司;恒温水浴锅购自美国Polyscience公司;正置显微镜购自日本奥林巴斯公司;超纯水机购自美国Millipore公司。
1.4 方法
1.4.1 动物分组及处理 将50只C57BL/6J小鼠适应性饲养1周后随机分成5组:空白组、PIN(50 mg/kg)组、APAP(300 mg/kg)模型组、PIN(30 mg/kg)+APAP(300 mg/kg)实验组、PIN(50 mg/kg)+APAP(300 mg/kg)实验组,每组10只。各组采取灌胃给药,空白对照组和模型组给予等量的生理盐水,PIN组及PIN+APAP组每日给药1次,连续给药7 d。末次给药2 h后,模型组和PIN+APAP组腹腔注射APAP 300 mg/kg 1次,空白组和PIN组腹腔注射等量生理盐水。APAP处理24 h后收集血清及肝脏用于后续实验。
1.4.2 血清生化指标检测 各组小鼠摘眼球取血于1000 g 4 ℃离心7 min分离血清,置于-80 ℃保存待用。以相应试剂盒检测ALT和AST。
1.4.3 肝组织中MDA、SOD和谷胱甘肽(glutathione, GSH)检测 取小鼠肝组织置于生理盐水中匀浆后,于4000 r/min 4 ℃离心15 min收集上清液,用BCA蛋白浓度测定试剂盒定量蛋白浓度,严格按照试剂盒说明书进行操作,检测各组肝组织中MDA、SOD和GSH水平。
1.4.4 组织学分析 用4%的多聚甲醛固定小鼠左侧部分肝叶,经过石蜡包埋、切片、HE染色,在显微镜下观察肝脏组织损伤情况。
2 结果
2.1 PIN对APAP致肝损伤小鼠模型血清中ALT、AST水平的影响 与空白组比校,APAP(300 mg/kg)模型组的ALT、AST水平均显著升高(P值均<0.01),模型构建成功;PIN(30 mg/kg)+APAP(300 mg/kg)及PIN(50 mg/kg)+APAP(300 mg/kg)组的ALT、AST与APAP(300 mg/kg)模型组相比均显著降低(P值均<0.01)(表1)。
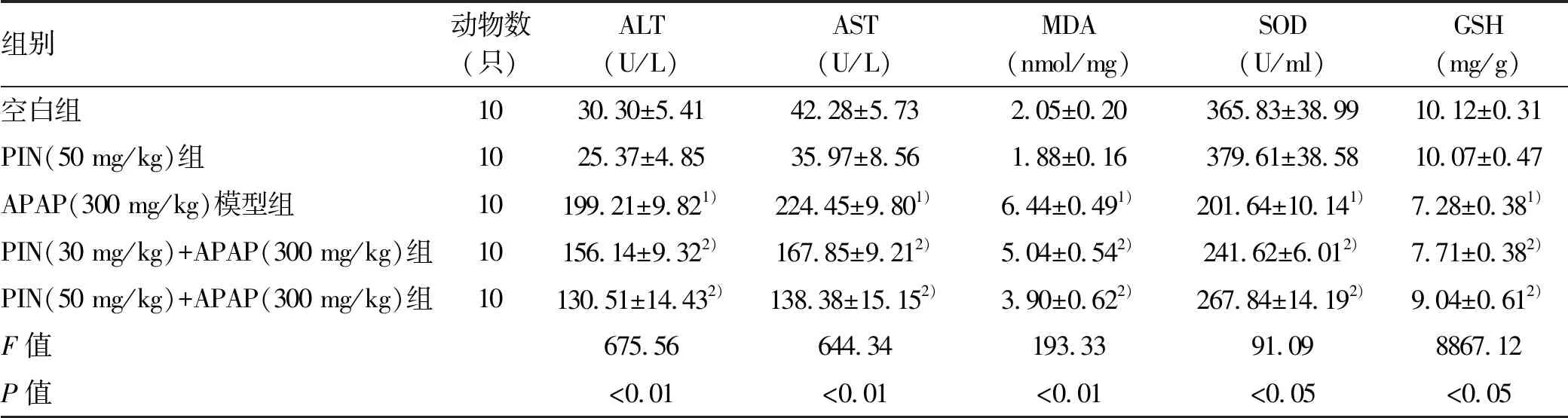
表1 5组间各指标的比较
注:与空白组比较,1)P<0.01;与APAP(300 mg/kg)模型组比较,2)P<0.05。
2.2 PIN对APAP致肝损伤小鼠模型肝组织中MDA、SOD和GSH的影响 与空白组比校,APAP(300 mg/kg)模型组小鼠肝脏中MDA的水平显著升高(P<0.01),且SOD活性及GSH水平显著降低(P值均<0.01);与APAP(300 mg/kg)模型组比较,PIN(30 mg/kg)+APAP(300 mg/kg)及PIN(50 mg/kg)+APAP(300 mg/kg)组的小鼠肝脏中MDA的水平显著降低(P值均<0.05),且SOD活性及GSH水平显著升高(P值均<0.05)(表1)。
2.3 PIN对APAP致肝损伤小鼠模型肝组织病理的影响 空白组及PIN(50 mg/kg)组小鼠肝小叶结构完整清晰,肝索排列整齐规则,肝细胞核居中界限明晰,肝细胞未见坏死及无炎性细胞浸润;APAP(300 mg/kg)模型组可见肝组织严重损伤,细胞间界限不清,肝细胞灶性或大面积坏死排列紊乱,肝细胞大面积坏死,细胞核被挤向一边,表明药物性肝损伤模型成功;与APAP(300 mg/kg)模型组比较,PIN(30 mg/kg)+APAP(300 mg/kg)及PIN(50 mg/kg)+APAP(300 mg/kg)组的小鼠肝脏病变明显缓解,肝组织炎症浸润轻微,细胞轮廓仍清晰可见,未见到大面积坏死灶(图1)。表明PIN对缓解药物性肝损伤有一定的保护作用。
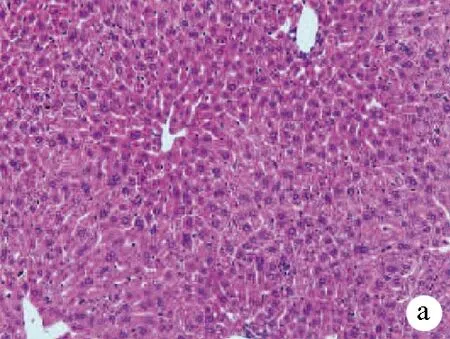

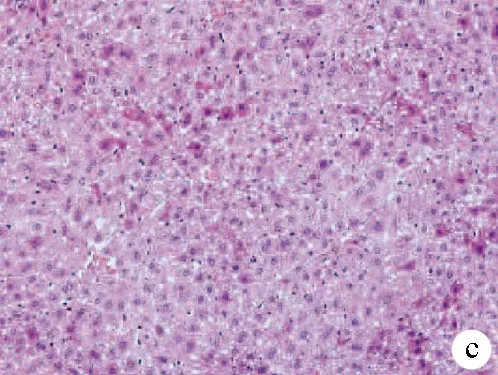


注:a,空白组;b,PIN(50 mg/kg)组;c,APAP(300 mg/kg)模型组;d,PIN(30 mg/kg)+APAP(300 mg/kg);e,PIN(50 mg/kg)+APAP(300 mg/kg)。
图1肝组织病理结果(HE染色,×200)
3 讨论
APAP过量是许多发达国家药物性肝衰竭的主要原因[8]。当过量的APAP破坏肝细胞防御机制时,过多的活性氧介导的氧化应激和炎症反应被认为是APAP诱导的药物性肝损伤发生的主要驱动因素[9]。因此,调控肝内氧化应激可能为APAP致药物性肝损伤的有效治疗开辟新的途径。
评价肝功能情况最常用的指标是ALT、AST,当肝细胞受到损害后细胞膜的通透性增大,胞内的ALT、AST穿过细胞膜进入血液,血液中的ALT、AST水平显著升高[10]。本研究小鼠经APAP造模后,血清中的ALT、AST水平显著升高,表明药物性肝损伤模型建立成功,而通过各剂量的PIN预处理可使APAP诱发的高水平AST、ALT的显著降低,初步表明PIN经口服可缓解小鼠模型的药物性肝损伤。
此外,大约10%的APAP被细胞色素P450酶氧化为其化学活性代谢物,可引起实验动物和人的肝损伤[11]。重要的代谢物被称为苯醌亚胺(N-acetyl-p-benzoquinone imine, NAPQI),NAPQI有毒,可与谷胱甘肽(glutathione, GSH)结合失去毒性[12]。当APAP过量时,可使NAPQI的积累,导致GSH的利用率增加,GSH被消耗殆尽,未与GSH结合的多余NAPQI可能与细胞蛋白(包括线粒体蛋白)发生反应,导致肝功能衰竭[13]。Saad等[14]研究发现,PIN预处理可通过增加GSH水平减弱大鼠全脑缺血再灌注损。Promsan等[15]研究表明,PIN可通过降低MDA水平减轻庆大霉素诱导的大鼠肾毒性。范玲等[16]用赶黄草70%乙醇提取物处理小鼠内毒素肝损伤模型,发现其可能通过减少TNFα产生并调控ROS/NLRP3/IL-1β通路起保护作用。血红素加氧酶是机体抗氧化应激损伤的重要分子之一,Punvittayagul等[17]利用PIN处理大鼠可显著提高血红素加氧酶的活性。在本研究中,小鼠腹腔注射大剂量的APAP后,肝组织中MDA显著增加,SOD及GSH水平显著降低,表明大剂量的APAP可使小鼠的肝脏抗氧化防御能力失去,发生严重的氧化应激损伤。而通过口服不同剂量的PIN再用APAP处理,相比仅用APAP处理,小鼠肝组织中MDA显著降低,SOD及GSH的水平明显回升,表明PIN可明显提高肝组织的抗氧化能力,抑制过量APAP对小鼠肝组织的氧化损伤。
综上所述,从赶黄草中提取的PIN单体可明显缓解APAP诱发的药物性肝损伤,提示PIN可能是一种具有明显保肝护肝作用的候选药物,作用机制可能与其抑制氧化应激有关。这对明确中药的疗效及作用机理奠定了一定基础。

