蛋白酶体β亚基4型对人肝癌SMMC7721细胞增殖存活的影响
陆 谦, 程 欣, 夏振国, 陈 钟
1 南通大学附属医院 肝胆外科, 江苏 南通 226001; 2 南通市通州区人民医院 普外科, 江苏 南通 226300
肝细胞癌(以下简称肝癌)是最常见的肝脏恶性肿瘤。据最新癌症统计数据显示,我国男女患者的肝癌发病率均位居全球首位[1-2]。研究[3]证实肝癌的发生是一个多基因参与、多步骤改变的复杂过程,而目前对肝癌发生发展的精确分子机制仍不完全清楚。蛋白酶体是一种多亚基复合物,可选择性地降解80%~90%的细胞内蛋白,并参与几乎所有的细胞过程[4]。蛋白酶体β亚基4型(PSMB4)被鉴定为第一个具有致癌特性的蛋白酶体亚基,可以促进体内癌细胞的存活和肿瘤生长[5]。目前,PSMB4对人类肝癌细胞的功能影响尚不清楚。本研究拟通过短发夹RNA技术(shRNA)探讨PSMB4对肝癌SMMC7721细胞增殖存活的影响及其可能的机制。
1 材料与方法
1.1 材料 SMMC7721细胞株购自上海吉凯生物科技有限公司;RPMI-1640培养基、胎牛血清、青链霉素混合液购自美国Gibco公司;Lipofectamine 2000脂质体转染试剂盒购自美国Invitrogen公司;0.25%的胰蛋白酶购自美国Thermo公司;兔抗人PSMB4单克隆抗体、GAPDH单克隆抗体、HRP标记山羊抗兔IgG抗体、细胞裂解液购自美国Abcam公司;蛋白marker,转印滤纸、PVDF膜、磷酸盐缓冲液、SDS-PAGE蛋白上样缓冲液、BCA蛋白定量试剂盒,Western Blot试剂盒、超敏ECL化学发光试剂盒,MTT试剂盒、细胞凋亡检测试剂盒均购自江苏碧云天公司。本研究方案经由南通大学附属医院伦理委员会审批(批号:2018-L006)。
1.2 方法
1.2.1 细胞培养及传代 细胞培养于含有10%胎牛血清以及1%双抗(青链霉素混合液)的RPMI-1640细胞培养基中,培养环境为37 ℃,5% CO2的细胞培养箱。待细胞生长至80%~90%时,吸净培养液,磷酸盐缓冲液清洗,0.25%胰酶消化,加培养液吹打均匀成细胞悬液,按1∶2的比例传代培养。
1.2.2 PSMB4干扰序列及细胞转染 3个干扰PSMB4特异性shRNA载体及一个空shRNA载体由上海吉凯生物科技有限公司合成,其3个序列分别为shRNA1-GTTGAAATAGAGGGACCAT、shRNA2-CGAGTCAACAACAGTACCA、shRNA3-GGTGATTGATGAGGAGCTT。细胞培养至80%~90%时,加入用培养基稀释的shRNA载体及转染试剂Lipofectamine 2000,轻轻吹打混匀,培养48 h后收集细胞用于后续实验。
1.2.3 平板克隆实验 将转染后的细胞悬液接种在6孔培养板上,每孔1000个细胞,设置3个复孔,培养至绝大多数单个克隆中细胞数大于50时,每孔加入1 ml 4%多聚甲醛,固定30 min,加入洁净、无杂质GIEMSA染液500 μl,静置15 min,数码相机拍照,统计克隆计数。
1.2.4 MTT测定 在96孔板中加入转染后的细胞悬液,每孔2000个细胞,设置3个复孔,铺板5张,放入细胞培养箱中培养。分别在第2、3、4、5天,培养终止前4 h加入20 μl 5 mg/ml的MTT溶液,4 h后吸净培养液,不吸掉孔板底部的甲瓒颗粒,加100 μl DMSO溶解甲瓒颗粒,振荡5 min,酶标仪490 nm检测光密度(OD)值。
1.2.5 流式细胞仪凋亡检测 运用流式细胞仪Annexin-V PI复然法评估细胞凋亡情况。将转染后的细胞悬液稀释至细胞密度为106个/ml,取100 μl至FACS管中并分别加入5 μl Annexin V-PE和5 μl 7-AAD混匀,避光室温孵育10 min,加入400 μl缓冲液,继续孵育5 min,使用流式细胞仪分析检测。
1.2.6 Western Blot分析 将转染后的细胞使用胰酶消化,收集上清液,测定蛋白质浓度,并调节至相同浓度。然后,利用10%聚丙烯酰胺凝胶电泳分离细胞总蛋白,转移至PVDF膜。使用5%脱脂奶粉封闭,加入相应一抗,孵育过夜后加入相应的二抗,再次孵育4 h。最后,加入ECL发光液,显示与抗体相结合的蛋白条带。使用Image Lab 3.0软件测定每个条带的相对强度。
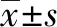
2 结果
2.1 PSMB4基因的干扰效率 Western Blot检测3个shRNA序列的干扰效率,如图1所示,shCtrl组(对照组)、shRNA1组、shRNA2组及shRNA3组中PSMB4的相对表达量分别为0.911 3±0.007 7,0.568 9±0.013 0,0.437 8±0.013 2,0.220 2±0.006 7。与空载对照组相比,3个干扰序列展现的干扰效果差异均有统计学意义(shRNA1:t=22.67,P<0.000 1;shRNA2:t=30.88,P<0.000 1;shRNA3:t=67.82,P<0.000 1)。其中shRNA3序列对PSMB4的干扰效率最高,干扰效率约为80%,因此选择shRNA3序列作为实验组,用于后续细胞功能实验。
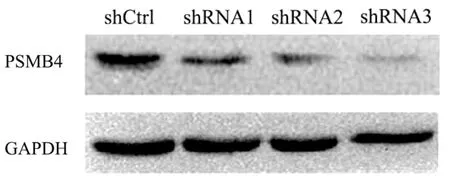
图1 SMMC7721细胞系中干扰PSMB4效率验证
2.2 干扰PSMB4表达对SMMC7721细胞增殖及克隆形成的影响 干扰PSMB4表达后,MTT检测结果显示,实验组第4、5天细胞OD490值低于对照组,差异均有统计学意义(P值均<0.05)(表1)。克隆形成实验显示实验组中SMMC7721细胞集落数目明显少于对照组(图2)。
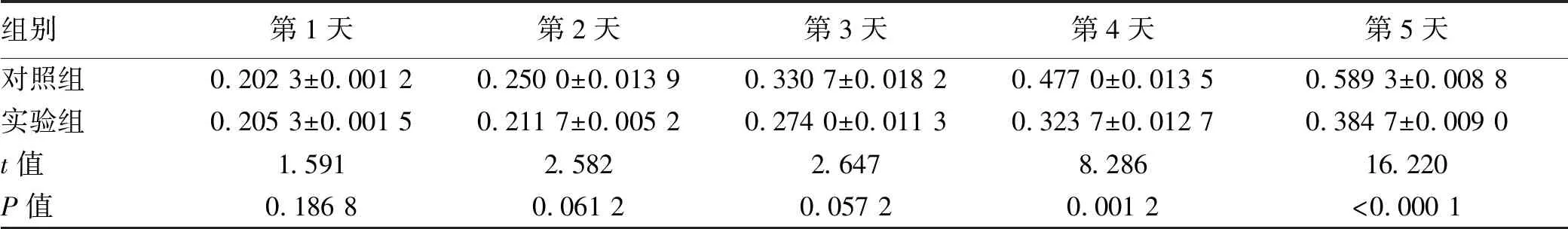
表1 MTT检测两组细胞的OD490值
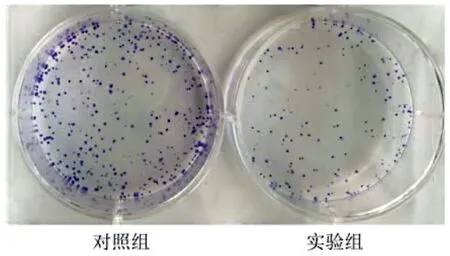
图2PSMB4干扰后对SMMC7721细胞克隆形成能力的影响
2.3 干扰PSMB4表达对SMMC7721细胞凋亡率的影响 干扰PSMB4表达后,流式细胞凋亡检测结果显示,实验组细胞的早期凋亡率、晚期凋亡率及总凋亡率均明显高于对照组(P值均<0.05)(图3,表2)。
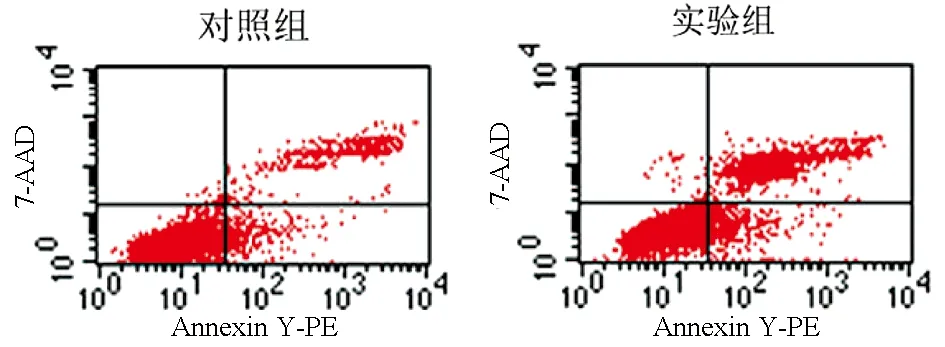
图3 PSMB4干扰后对SMMC7721细胞凋亡的影响
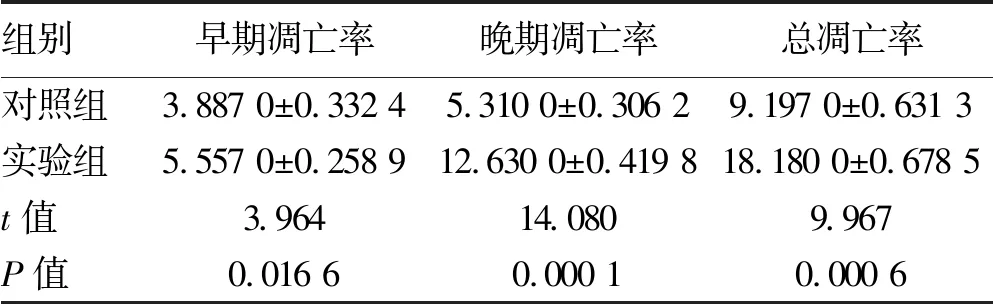
表2 流式细胞仪检测两组细胞的凋亡率(%)
2.4 干扰PSMB4表达对核因子-κB(NF-κB)信号通路的影响 干扰PSMB4表达后,Western Blot检测NF-κB信号通路中相关蛋白的表达。结果如图4所示,对照组和实验组中NF-κB亚基p65蛋白(pNF-κB)的相对表达量分别为0.801 5±0.012 0、0.284 1±0.011 0,而NF-κB抑制蛋白α(IκBα)的相对表达量分别为0.481 6±0.011 2、0.658 3±0.014 2。与空载对照组相比,实验组肝癌SMMC7721细胞中pNF-κB蛋白表达显著降低(t=31.830,P<0.0001),IκBα蛋白表达显著增加(t=9.774,P=0.000 6)。
3 讨论
近年来,研究[6-7]表明蛋白质稳态失衡会导致神经退行性疾病、心功能不全和癌症等多种疾病的发生。蛋白酶体是维持蛋白质稳态的一种重要的多亚基复合物,最近有多项研究[8]表明,其在多种恶性肿瘤发生发展过程中起着关键的调节作用。例如,在乳腺癌细胞中,干扰蛋白酶体亚基PSMB5的表达可以抑制细胞的生长并能激活防御性M1巨噬细胞[9];而在肝癌细胞中,干扰蛋白酶体亚基PSMB2表达可以抑制细胞的增殖和侵袭[10]。目前已有多种蛋白酶体抑制剂,如硼替佐米等作为化疗药物被用于临床恶性肿瘤的治疗。因此,抑制蛋白酶体活性在治疗癌症中具有可观的应用前景[11-12]。
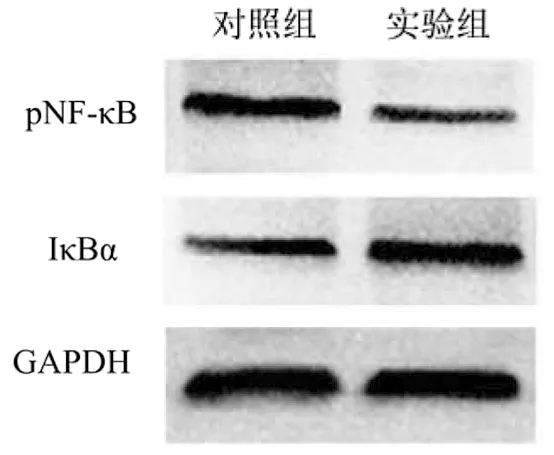
图4干扰PSMB4表达对NF-κB信号通路相关蛋白表达的影响
PSMB4即26S蛋白酶体β亚基4型,此基因位于1q21,mRNA为925 bp,含有7个外显子, 编码29 kD大小的蛋白,主要分布于细胞核和细胞浆中[13]。最近的研究[5,14]表明,PSMB4可以促进包括神经胶质瘤、乳腺癌等多种恶性肿瘤细胞的异常增殖。在本研究中,笔者通过shRNA干扰技术成功构建了PSMB4表达降低的SMMC7721细胞,并通过MTT、克隆形成实验和流式细胞仪凋亡检测发现,与对照组细胞相比,干扰PSMB4表达可以抑制肝癌SMMC7721细胞的增殖存活。此外,据报道[15]蛋白酶体可以降解IκBα,从而激活NF-κB通路介导肿瘤细胞的生长与存活。在之前的研究中,有学者[16]发现PSMB4可以通过NF-κB-miR-21通路调控多发性骨髓瘤的发生发展。而在卵巢癌细胞中,抑制PSMB4表达可以下调NF-κB通路的活性,并增加NF-κB介导的蛋白质表达,如cyclin D1和cyclin E[17]。本实验结果显示,干扰PSMB4在肝癌细胞中同样可以影响NF-κB通路相关蛋白的表达变化。这些结果表明,PSMB4可能通过激活NF-κB通路导致肿瘤细胞的生长增殖,促进恶性肿瘤的发展。
综上所述,本研究发现了干扰PSMB4可以抑制肝癌SMMC7721细胞的增殖与存活,其机制可能是抑制了NF-κB通路活性。然而,具体的作用机制尚未完全阐明,有待于进一步的深入研究。

