Netrin-1对糖尿病视网膜病变大鼠的保护作用△
刘安琪 左中夫 吴传玲 刘学政
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病微血管并发症之一,是成人视力减退和失明的主要原因[1]。几乎所有的1型糖尿病患者以及约60%的2型糖尿病患者,在糖尿病确诊后15~20 a 均会出现不同程度的视网膜病变,而且患病率随着病程延长而升高[2]。DR是一种多因素疾病,其发病机制尚不完全清楚,主要病理改变包括视网膜血管通透性升高、神经节细胞凋亡、神经功能障碍、氧化应激失衡等[3]。近年来研究发现,持续性慢性炎症是DR发生发展的关键因素,表现为炎症因子不断分泌和小胶质细胞异常活化,降低炎症可缓解DR进程[4-5]。因此,深入探讨炎症调节的上游机制,寻找关键的作用靶点,能为DR治疗提供新的方向。
神经突起导向因子Netrin-1是Netrin家族中第一个被鉴定的成员,是一种层粘连蛋白样蛋白,在神经系统发育期间参与调节轴突迁移、海马形成、神经传导束发育等过程[6-7]。除了在神经系统中高表达外,Netrin-1也广泛表达于其他组织器官,包括肺、胰腺、乳腺、肠上皮等。Zhang等[8]利用链脲佐菌素诱导糖尿病大鼠模型发现,造模后3个月视网膜中Netrin-1 mRNA和蛋白质表达水平显著升高;周贤慧等[9-10]进一步证实,给予外源性Netrin-1对DR具有保护作用,这主要与外源性Netrin-1降低视网膜血管通透性有关。但是Miloudi等[11]则认为,Netrin-1经基质金属蛋白酶9降解后的产物可通过UNC5B受体增加血管通透性,加重视网膜水肿。因此,Netrin-1对DR的保护作用有待进一步确定,而且Netrin-1对小胶质细胞活化、炎症因子分泌的影响均不清楚。本研究通过内源性基因沉默后给予外源性Netrin-1蛋白深入探讨Netrin-1对DR大鼠的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物与模型构建SD大鼠购自于上海斯莱克实验动物有限责任公司,均为雄性,体质量为(220±30)g。DR大鼠模型的构建:造模前大鼠禁食12 h,可自由饮水,按照60 mg·kg-1的剂量腹腔注射10 g·L-1的链脲佐菌素溶液,注射后3 d测量尾静脉血糖浓度,当血糖>16.7 mmol·L-1时为造模成功,腹腔注射生理盐水作为对照[12]。si-NC和si-Netrin-1大鼠的构建:造模成功后,采用100 g·L-1的水合氯醛麻醉大鼠,托吡卡胺滴眼液散瞳,使用29G针头沿角巩膜缘进针,注射10 μL的慢病毒溶液(si-NC和si-Netrin-1)[13]。si-Netrin-1及其阴性对照si-NC由上海吉凯基因化学技术有限公司合成,构建载体为pGLV3-GFP慢病毒质粒,si-Netrin-1序列为:5’-GGAAGTTCACGGTGAACAT-3’,si-NC序列为:5’-GATGAGGCTAGAACTACTG-3’[14]。
1.1.2 试剂及仪器链脲佐菌素(美国Sigma公司),Netrin-1(美国R&D Systems公司),实时荧光定量PCR试剂盒(日本Takara公司),抗Iba1抗体(英国Abcam公司),山羊血清封闭液(北京中杉金桥生物技术有限公司)。
1.1.3 实验分组共进行两组动物实验,分别为:(1)为了研究Netrin-1基因沉默对糖尿病视网膜损伤的影响,使用si-NC和si-Netrin-1大鼠进行实验,将大鼠分为4组:A组(si-NC大鼠)、B组(si-Netrin-1大鼠)、C组(si-NC大鼠+DR造模)、D组(si-Netrin-1大鼠+DR造模)。(2)为了研究外源性Netrin-1对糖尿病视网膜损伤的影响,使用WT大鼠进行实验,分为3组:对照组、DR组、Netrin-1组,Netrin-1组在DR造模成功后1个月时玻璃体内注射Netrin-1溶液(500 mg·L-1,5 μL)[9]。上述实验动物每组均6只,并且均在造模成功后3个月时取视网膜组织进行检测。本研究遵循《实验动物管理条例》(2017修订版)的规定。
1.2 方法
1.2.1 HE染色检测视网膜组织各层的厚度常规制作视网膜组织冰冻切片,PBS洗涤后使用苏木精染色,盐酸酒精分化,再使用酚红染色和二甲苯透明,中性树脂封片。光学显微镜下观察和拍照,使用Image J软件测量视网膜组织各层厚度,包括内丛状层(inner plexiform layer,IPL)、内核层(inner nuclear layer,INL)、外丛状层(outer plexiform layer,OPL)、外核层(outer nuclear layer,ONL)。
1.2.2 免疫荧光染色检测视网膜组织中Iba1表达情况常规制作视网膜组织冰冻切片,PBS漂洗3次,每次5 min,用固定液固定10 min,然后使用体积分数0.1%的Triton X-100浸泡20 min,滴加山羊血清封闭液封闭30 min,滴加抗Iba1抗体(1100),于4 ℃过夜孵育。PBS漂洗3次,滴加FITC标记的山羊抗兔二抗室温孵育2 h,PBS漂洗3次,滴加含DAPI的封片剂,封片后置于荧光显微镜下观察和拍照。
1.2.3 实时荧光定量PCR检测炎症因子表达情况采用Trizol法提取视网膜组织中的mRNA,逆转录为cDNA,采用实时荧光定量PCR检测目的基因的表达,以GAPDH为内参基因。引物序列合成于苏州金唯智生物科技有限公司,具体序列为:白细胞介素-1β(interleukin-1β,IL-1β)上游引物:5’-GAAATGCCACCTTTTGACAGTG-3’,下游引物:5’-TGGATGCTCTCATCAGGACAG-3’;白细胞介素-6(IL-6)上游引物:5’-CTGCAAGAGACTTCCATCCAG-3’,下游引物:5’-AGTGGTATAGACAGGTCTGTTGG-3’;白细胞介素-12(IL-12)上游引物:5’-CAATCACGCTACCTCCTCTTTT-3’,下游引物:5’-CAGCAGTGCAGGAATAATGTTTC-3’;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)上游引物:5’-CAGGCGGTGCCTATGTCTC-3’,下游引物:5’-CGATCACCCCGAA-GTTCAGTAG-3’。使用2-△△Ct法对结果进行分析,将对照组或si-NC组目的基因的相对表达量作为1。
1.3 统计学分析使用SPSS 20.0软件进行统计处理,所有计量数据以均数±标准差表示,计量数据两组间的比较使用t检验,多组间比较采用单因素方差分析,组间两两比较用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 Netrin-1基因沉默对视网膜组织中IPL、INL、OPL、ONL厚度的影响HE染色结果显示,C组和D组视网膜组织中IPL、INL、OPL、ONL厚度均薄于A组和B组,差异均有统计学意义(均为P<0.05);而且,D组INL、ONL厚度薄于C组,差异有统计学意义(均为P<0.05),见表1和图1。
2.2 Netrin-1基因沉默对视网膜组织中Iba1表达的影响免疫荧光染色结果显示,C组和D组视网膜组织中Iba1表达呈现的荧光强度明显高于A组和B组,而且D组高于C组。见图2。
表1 各组大鼠视网膜各层组织厚度的比较

组别IPL厚度/μmINL厚度/μmOPL厚度/μmONL厚度/μmA组32.38±1.65 29.71±1.15 9.77±0.67 42.57±1.35 B组32.14±2.5829.25±1.669.25±0.7941.75±2.03C组24.73±1.10ab22.57±0.63ab6.36±0.51ab39.38±1.65abD组23.85±1.29ab21.14±1.03abc6.03±0.82ab36.62±1.21abcF值41.74085.65044.59016.940P值<0.001<0.001<0.001<0.001
注:与A组相比,aP<0.05;与B组相比,bP<0.05;与C组相比,cP<0.05
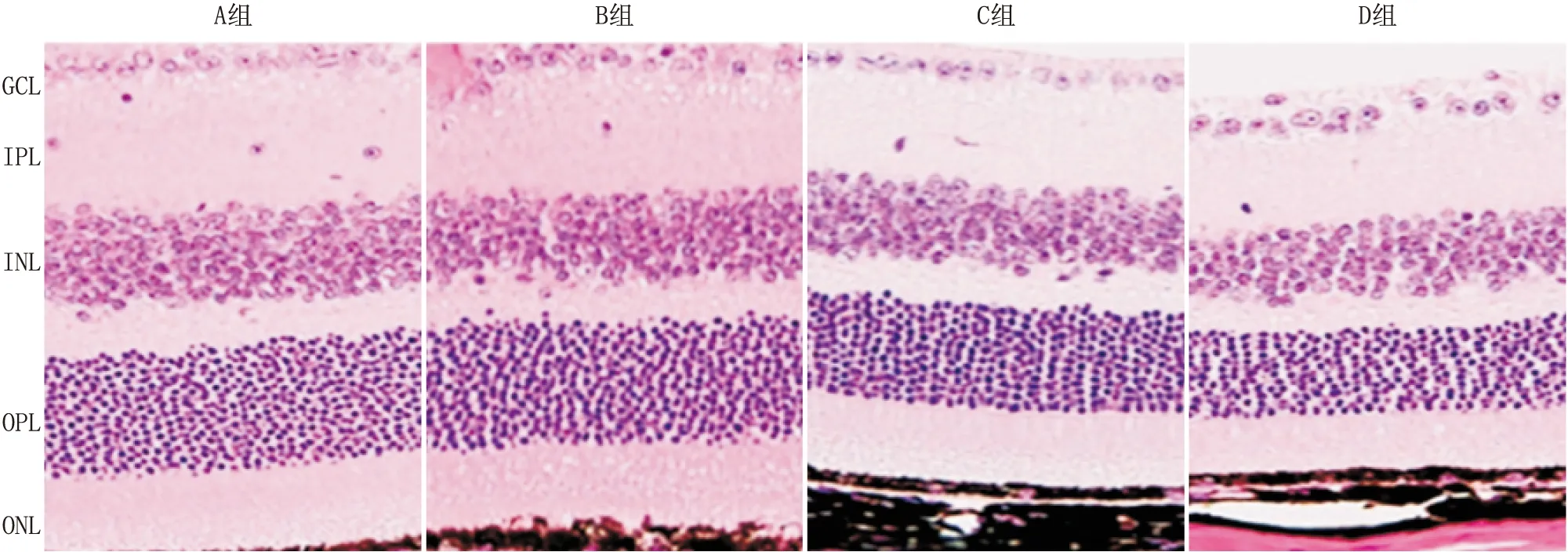
图1 HE染色检测视网膜组织的形态结构(×400)

图2 免疫荧光染色检测视网膜组织中Iba1的表达
2.3 Netrin-1基因沉默对视网膜组织中炎症因子表达的影响实时荧光定量PCR检测结果显示,C组和D组视网膜组织中IL-1β、IL-6、IL-12、TNF-α mRNA表达水平均高于A组和B组,差异均有统计学意义(均为P<0.05);D组各炎症因子表达均高于C组,差异均有统计学意义(均为P<0.05)。见表2。
表2 各组大鼠视网膜组织中炎症因子的表达水平

组别IL-1βIL-6IL-12TNF-αA组1.00±0.18 1.00±0.17 1.00±0.15 1.00±0.13 B组1.09±0.231.04±0.140.95±0.111.06±0.18C组5.37±0.52ab4.02±0.59ab3.90±0.36ab4.02±0.50abD组6.80±0.61abc4.88±0.55abc4.77±0.48abc6.83±0.59abcF值290.500138.900236.600287.500P值<0.001<0.001<0.001<0.001
注:与A组相比,aP<0.05;与B组相比,bP<0.05;与C组相比,cP<0.05
2.4 外源性Netrin-1对视网膜组织中IPL、INL、OPL、ONL厚度的影响HE染色结果显示,DR组和Netrin-1组视网膜组织中IPL、INL、OPL、ONL厚度均低于对照组,差异均有统计学意义(均为P<0.05);而且,Netrin-1组INL、ONL厚度高于DR组,差异均有统计学意义(均为P<0.05)。见图3和表3。
2.5 外源性Netrin-1对视网膜组织中Iba1表达的影响免疫荧光染色结果显示,Netrin-1组视网膜组织中Iba1表达呈现的荧光强度明显低于DR组。见图4。

图3 HE染色检测视网膜组织的形态结构(×400)
表3 各组大鼠视网膜各层组织厚度的比较

组别IPL厚度/μmINL厚度/μmOPL厚度/μmONL厚度/μm对照组32.51±0.81 29.18±0.67 9.85±0.44 43.21±1.07 DR组24.43±1.16a23.63±0.78a6.56±0.86a38.50±1.26aNetrin-1组25.19±1.07a25.51±1.04ab7.03±0.92a40.28±1.83abF值113.90067.05032.03016.740P值<0.001<0.001<0.001<0.001
注:与对照组相比,aP<0.05;与DR组相比,bP<0.05

图4 免疫荧光染色检测视网膜组织中Iba1的表达
2.6 外源性Netrin-1对视网膜组织中炎症因子表达的影响实时荧光定量PCR检测结果显示,Netrin-1组视网膜组织中IL-1β、IL-6、IL-12、TNF-α mRNA表达水平均低于DR组,高于对照组,差异均有统计学意义(均为P<0.05)。见表4。
表4 各组视网膜组织中炎症因子的表达水平

组别IL-1βIL-6IL-12TNF-α对照组1.00±0.16 1.00±0.13 1.00±0.16 1.00±0.19 DR组5.28±0.53a3.88±0.41a4.36±0.35a6.24±0.64aNetrin-1组2.66±0.49ab2.71±0.44ab2.80±0.40ab4.35±0.50abF值153.30099.740165.200182.200P值<0.001<0.001<0.001<0.001
注:与对照组相比,aP<0.05;与DR组相比,bP<0.05
3 讨论
近年来研究发现,炎症在DR的发生发展中发挥重要的作用,使用抗炎药物可阻止其发生发展;IL-1β、TNF-α等炎症因子在DR患者的外周血、玻璃体中的表达量明显升高[15]。炎症可促进内皮细胞高表达细胞间黏附分子-1、P选择素等,诱导白细胞在血管内皮的黏附和迁移,大量释放各种炎症因子,破坏内皮细胞间的连接与屏障功能[16]。Netrin-1是一种新型的抗炎因子,在各种疾病中发挥抗炎作用,如Mirakaj等[17]发现急性肺损伤可导致肺组织Netrin-1表达显著降低,给予外源性Netrin-1可抑制中性粒细胞迁移和炎症因子释放。我们推测Netrin-1可能通过抗炎机制在糖尿病视网膜损伤中发挥保护作用。
为了检测内源性Netrin-1在DR进展中的作用,本研究使用RNA干扰技术沉默Netrin-1表达,造模3个月后对视网膜组织进行HE染色,结果显示D组INL、ONL厚度薄于C组,表明Netrin-1基因沉默可进一步加重视网膜损伤。对视网膜组织中各炎症因子的表达量进行实时荧光定量PCR检测发现,Netrin-1基因沉默可导致炎症因子表达进一步升高。上述结果表明,内源性的Netrin-1表达在DR中发挥保护作用,但是RNA干扰技术仍然存在抑制效率不高等不足,未来仍需要使用Netrin-1基因敲除动物验证该结论。此外,在DR造模后1个月通过玻璃体内注射Netrin-1,结果显示外源性Netrin-1可以缓解DR导致的INL、ONL厚度降低,抑制各炎症因子表达,具有潜在的临床应用价值。
小胶质细胞是视网膜中的免疫细胞,在生理状态下一般处于静息状态,具有吞噬细胞碎片、抗原提呈、分泌神经营养因子、组织修复等功能,但是在高糖刺激下则会持续活化,分泌大量的炎症毒性因子,损伤神经及血管内皮细胞,破坏视网膜内皮屏障功能,加重病理损伤[18]。Iba1是一种钙结合蛋白,特异性表达于小胶质细胞,而且在小胶质细胞活化时其表达量显著升高,因此检测Iba1表达水平可反映小胶质细胞的活化情况。本研究对Iba1进行免疫荧光染色,结果显示Netrin-1基因沉默可上调Iba1表达,而外源性给予Netrin-1蛋白则可降低其表达,表明Netrin-1可抑制DR导致的小胶质细胞活化。
研究发现,Netrin-1可通过A2BAR受体结合发挥抗炎作用,如Mirakaj等[19]在急性腹膜炎小鼠模型中发现,外源性给予Netrin-1可以降低腹膜渗出液的炎症因子含量,抑制炎症细胞浸润,但是在A2BAR受体敲除小鼠中则无法发挥保护效应。此外,也有研究报道Netrin-1可通过其他类型受体发挥生物学作用,包括UNC5同源物、整合素α6β4和整合素α3β1等[20]。然而,这些受体是否参与Netrin-1在DR中的保护作用尚不清楚,未来需要对此进行更为深入地探讨。
综上所述,Netrin-1基因沉默可加重糖尿病大鼠视网膜损伤和炎症,外源性Netrin-1则具有保护作用。

