饲料添加益生菌对多病原阳性的凡纳滨对虾生长与存活的影响*
练小军 朱开玲 张庆起 万晓媛 谢国驷 郭程程 黄 倢
饲料添加益生菌对多病原阳性的凡纳滨对虾生长与存活的影响*
练小军1,2朱开玲1张庆起3万晓媛1谢国驷1郭程程1黄 倢1,2①
(1. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071;2. 上海海洋大学水产与生命学院 上海 201306;3. 连云港市启明水产有限公司 连云港 222100)
采用假交替单胞菌(sp.) KL-3 2010和微小杆菌(sp.) KL-C2 2014作为益生菌,进行凡纳滨对虾()投喂实验,研究上述菌株对带毒对虾的生长与存活的影响。假交替单胞菌KL-3 2010对致急性肝胰腺坏死副溶血弧菌() (VPAHPND20130629002S01)有拮抗作用和胞外蛋白酶活性,微小杆菌KL-C2 2014有胞外蛋白酶活性。待试对虾经检测为白斑综合征病毒(WSSV)、致急性肝胰腺坏死病副溶血弧菌(VPAHPND)和虾肝肠胞虫(EHP)弱阳性。经过为期60 d的养殖实验,结果显示,与投喂普通颗粒饲料的对照组相比,投喂假交替单胞菌KL-3 2010的对虾存活率提高了213%±43% (<0.01);投喂微小杆菌KL-C2 2014的对虾平均生长率提高了105.5%±28.1% (<0.05);交替投喂2株菌的对虾存活率提高了184%±52% (<0.05),平均生长率提高了70.6%±32.8%。肠道可培养优势菌研究表明,2株益生菌的投喂显著影响了对虾肠道优势菌群的种类。本研究为带毒虾苗的养殖提供一种有效的病害防控和促生长的手段。
凡纳滨对虾;益生菌;生长;存活;多病原带毒
凡纳滨对虾()是我国对虾养殖业中占据比重最大、产业化发展程度最高的对虾养殖种类。近年来,对虾养殖业存在多种病原传播,导致养殖中不断出现急性或慢性死亡、生长停滞、摄食减少等,使养殖业的可持续健康发展面临严重的威胁(Crab, 2012; Bachère, 2000; Lafferty, 2015)。在应对病害威胁中,养殖过程中的药物滥用,影响了养殖产品安全,引起了社会的关注和忧虑,探索可持续的健康养殖模式成为养殖业发展的迫切需求。
益生菌为活体微生物制剂,可以促进养殖动物的健康和生长,近年来,其应用得到迅猛发展,受到广大水产养殖者的关注。益生菌的作用包括提供营养物质、分泌分解酶促进消化吸收、分泌拮抗物或争夺生态位抑制有害微生物、降解养殖废物改善水质、激发机体的非特异性免疫提高抗病力等(楼丹等, 2009),是一类可替代药物的绿色饲料添加剂,在斑节对虾()(Moriarty, 1998)、日本对虾()(Zhao, 2012)和凡纳滨对虾(Ziaei-Nejada, 2006; 胡毅等,2008;Rengpipat, 2000; Lin, 2005; 王志杰等, 2015)、牙鲆()(王福强等, 2005)等的养殖中均获得了较好的结果。
研究表明,假交替单胞菌(spp.)是海水养殖环境中经常出现的一类细菌,该类细菌能够分泌多种胞外的生物活性物质,多具有抗细菌、抗真菌、溶藻等活性(Rodrigues, 2015; Isnansetyo, 2009; 梁静娟等, 2014; 席宇等, 2005; Holmström, 1998、1999; Bowman, 2007; Chen, 2010; Lucas-Elio, 2005)。微小杆菌(spp.)是农业常用到的益生菌,主要用来杀灭土壤中的有害真菌(张莹等, 2013; Selvakumar, 2009; Bharti, 2013; Dastager, 2010),该类菌有较高的胞外蛋白酶活性,目前,没有发现对动物或人类有致病作用,可以作为有益微生物。已有研究显示,分离自海底沉积物中的微小杆菌SWJS2有金属蛋白酶活性,所提取的蛋白酶对鱼蛋白具有酶解活性((Lei, 2016; 赵谋明等, 2014);海洋中分离的微小杆菌CFR26M能分泌胞外蛋白酶,同时,产生抗氧化物质(Kumar, 2014)。
前期研究中,作者分离鉴定到1株假交替单胞菌KL-3 2010和1株微小杆菌KL-C2 2014,确认这2株菌对凡纳滨对虾没有致病作用。本研究用上述 2株菌的菌液浸润颗粒饲料后饲喂带病原的凡纳滨对虾幼虾,观察对虾的存活、生长、非特异性免疫力和肠道菌群的变化,以期为益生菌防控对虾病害提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验对虾 凡纳滨对虾于2016年8月28日购于江苏连云港赣榆某对虾养殖场,暂养于自建的80 cm × 150 cm的室内圆形水泥池中,平均体重为(0.42±0.02) g。
1.1.2 实验用菌 假交替单胞菌KL-3 2010,2010年10月分离自山东昌邑健康大菱鲆()鱼苗肠道,保存于–80℃冰箱;微小杆菌KL-C2 2014于2014年10月分离自江苏赣榆对虾养殖池塘的底泥,保存于–80℃冰箱;致急性肝胰腺坏死副溶血弧菌()VPAHPND20130629002S01、芽孢杆菌(sp.) KL-Y 2013、酵母菌(sp.) KL-5 2016均为本实验室分离,保存于–80℃冰箱。
1.2 实验方法
1.2.1 实验用菌制备 分别将冰箱保存的假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014菌种复苏,经在2216E平板上划线活化,挑取单菌落接种于2216E海水液体培养基,于28℃摇床振荡培养过夜,采用涂布平板计数法确定菌浓度约为1011CFU/ml。
1.2.2 2株菌对VPAHPND20130629002S01的拮抗实验
在2216E液体培养基中培养VPAHPND20130629002S01,取100 μl 1.0×107CFU/ml菌液涂布于新鲜的2216E固体培养基平板上,用无菌镊子夹取5片6 mm的无菌滤纸片等距离放置在涂布VPAHPND20130629002S01的平板上,分别取8 μl假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014的新鲜菌液滴于滤纸片上,28℃培养24 h后观察抑菌圈。
1.2.3 2株菌的蛋白酶活性检测 配制酪蛋白平板(Dang, 2009),用无菌镊子夹取4片6 mm无菌滤纸片在平板上等距离放置,分别取8 μl假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014的新鲜菌液滴于滤纸片上,28℃培养24 h后观察透明圈。用芽孢杆菌KL-Y 2013和酵母菌KL-5 2016作为对照菌株。
1.2.4 2株菌的生物安全性 取凡纳滨对虾270尾,设置对照组和2个实验组,每组3个重复,每个重复均为30尾,养在10 L盐度为20的海水中;实验组水体分别加入新鲜的假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014菌液,使终浓度为1.0×108CFU/ml,观察72 h,记录对虾的活动及存活状况。
1.2.5 实验用饲料的制作 市售0号和1号对虾颗粒饲料(正大集团有限公司),含35%蛋白,粒径分别是0.5~1.0 mm和1.2 mm,室温保存。以上饲料中以料液比1∶0.5 (/g∶/ml)添加假交替单胞菌KL-3 2010(P饲料)或微小杆菌KL-C2 2014(E饲料)菌液,使饲料中最终含菌量为1011CFU/g左右,室温浸润10 h作为实验组用饲料。对照组饲料为按照料液比1∶0.5(/g∶/ml)将0号和1号颗粒饲料与无菌2216E液体培养基混合,于室温浸润10 h(C饲料)。
1.2.6 实验对虾的病原检测 随机取实验对虾30尾,分为2个样品进行合并检测,使用无菌手术刀片切取对虾肝胰腺、鳃丝和肌肉组织,放入95%乙醇(3倍体积)内保存。送至实验室后,使用海洋动物组织基因组DNA提取试剂盒(天根)和RNAiso Plus(TaKaRa)分别提取保存组织的总DNA和总RNA,分别按OIE (2016)和Tourtip等(2009)的方法对对虾白斑综合征病毒(WSSV)、传染性皮下及造血组织坏死病毒(IHHNV)、虾肝肠胞虫(EHP)、致急性肝胰腺坏死副溶血弧菌(VPAHPND)、桃拉综合征病毒(TSV)、黄头病毒(YHV)、传染性肌坏死病毒(IMNV)和偷死野田村病毒(CMNV) (Zhang, 2014)进行PCR检测。
1.2.7 实验分组及养殖管理 在江苏赣榆某室内对虾养殖场随机取实验对虾1680尾,分别置于12个80 cm ×150 cm的圆形水泥池,水体为0.5 m3,每个池子放置140尾。在正式分组饲喂开始之前,进行15 d暂养,并在暂养期间取样,对其可能携带的病原进行检测。
实验设P组、E组、PE组和空白对照C组,每组3个平行。实验对虾每天投喂3次(07:00、13:00和19:00),投喂量为对虾体重的3%~5%(随养殖时间而增加)。其中,C组投喂C饲料;P组以6 d为周期,前3 d投喂P饲料,后3 d投喂C饲料;E组以6 d为周期,前3 d投喂E饲料,后3 d投喂C饲料;PE组以6 d为周期,前3 d每餐等量交替投喂E饲料和P饲料,后3 d连续投喂C饲料。前30 d投喂0号饲料,后30 d投喂1号饲料,养殖实验进行60 d。每隔2 d换水1次,换水量约30%,水体温度为(26±2)℃,盐度为15±1,pH 8.1±0.1,连续充气,每天检查对虾摄食及存活情况,及时取出死亡对虾。
1.2.8 生长指标测定 养殖过程中,每隔15 d每组每个重复取20尾,快速称重后再放回原池,计算特定生长率;养殖结束时,记录各组对虾存活数量,测量各组对虾初始和实验结束时的体重,计算各组对虾的存活率和生长率;统计各组对虾饲料投喂量,计算饲料系数。
存活率(Survival rate, SR)(%)=存活尾数/总尾数×100
特定生长率(Specific growth rate, SGR)(%/d) =[(i+15)平均体重–T平均体重]/(T平均体重×15)×100
平均生长率(Average growth rate, AGR)(%/d)=(终末平均体重–初始平均体重)/(初始平均体重×60)×100
饲料系数(Feed conversion ratio, FCR)=摄食饲料量/(终末体重–初始体重)
1.2.9 肠道可培养优势菌分离鉴定 在养殖实验的中后期(40、50和60 d)测定对虾肠道细菌优势菌群。测定方法参考李继秋等(2006)的方法,提前2 d从每组随机取8尾虾,置于新鲜海水中暂养,不投喂饲料,待排空肠道内容物后,无菌操作取对虾肠道,置于灭菌海水中清洗后匀浆,将肠道匀浆液梯度稀释,将各稀释度的肠道匀浆液涂布2216E平板,于28℃培养箱中培养24 h后,挑取各组平板中的优势菌落,进行分离纯化培养。
按水煮法(唐晔盛等, 2002)提取DNA作为模板,用细菌16S rDNA通用引物进行PCR扩增(李筠等, 2006);将产物送生工生物工程(上海)有限公司测序。
1.2.10 血淋巴取样及血淋巴免疫相关指标测定 养殖实验结束后,对虾饥饿24 h后,每池取10尾对虾,用1 ml无菌注射器自对虾围心腔中抽取血淋巴,每组血淋巴液混合置于无菌离心管中,于4℃冰箱中静置过夜,3000 r/min离心10 min,取上层血清,置于–80℃超低温冰箱保存,待测。
酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、过氧化物酶(POD)和溶菌酶的活力以及总蛋白的浓度测定均采用测试盒(南京建成生物工程研究所)按说明书方法操作。其中,1个ACP活力单位为血清在37℃与底物作用30 min产生1 mg酚;1个SOD活力单位为反应液中SOD抑制率达50%;1个POD活力单位为37℃条件下每分钟催化产生1 μg的产物;溶菌酶活力单位为溶壁微球菌()在pH=6.4和37℃下经30 min裂解使570 nm处光吸收值下降的比率(Hultmark, 1980)。总蛋白浓度根据碱性条件下蛋白将Cu2+还原为Cu+后,与BCA试剂形成紫色络合物,在562 nm处吸光度与已知浓度蛋白标准曲线对应计算而得。
1.3 数据分析
实验数据采用SPSS 18.0软件进行单因素方差分析(One-way ANOVA),<0.05为差异显著,若差异显著,则进行Duncan多重比较,显著性水平为<0.05。
2 结果
2.1 2株菌对VPAHPND 20130629002S01的拮抗作用
假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014用滤纸片法贴附于VPAHPND20130629002S01涂布的平板,经24 h培养后,观察到KL-3 2010对VPAHPND20130629002S01具有拮抗作用,抑菌圈直径为(10.42±0.23) mm,而KL-C2 2014对VPAHPND20130629002S01没有显示拮抗效果(图1)。
2.2 2株菌的胞外蛋白酶活性
假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014在酪蛋白平板上均能形成透明圈,对照菌株芽孢杆菌KL-Y 2013没有观察到透明圈,另一株对照菌株酵母菌KL-5 2016观察到透明圈。表明2KL-3 2010和2KL-C2 2014均具有胞外蛋白酶活性(图2)。
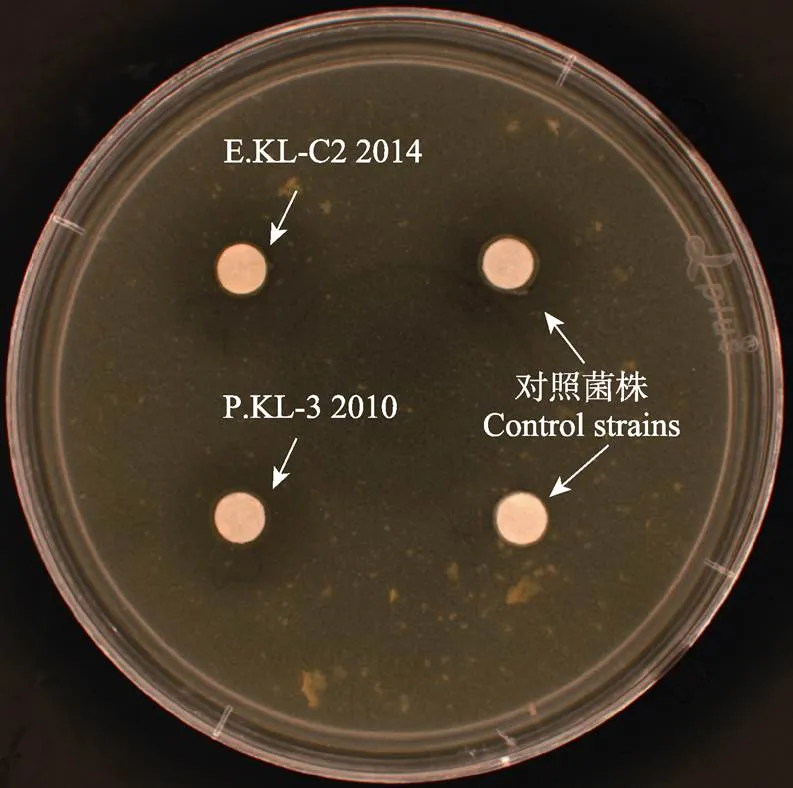
图2 假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014胞外蛋白酶活性
2.3 2株菌对凡纳滨对虾的生物安全性
分别用1.0×108CFU/ml的假交替单胞菌KL-3 2010和微小杆菌KL-C2 2014浸浴凡纳滨对虾72 h,未引起任何对虾死亡和异常表征,表明这2株菌对凡纳滨对虾无致病性。
2.4 实验用虾病原检测
实验用凡纳滨对虾用PCR方法对多病原进行检测。结果显示,所用虾苗在第2轮PCR扩增中检出了VPAHPND、WSSV和EHP阳性,表明病原携带量较低,其中,WSSV和VPAHPND在2个合并样品中均只有1个出现阳性,EHP在2个合并样品中均出现了阳性;而IHHNV、TSV、YHV、IMNV和CMNV均为阴性(表1)。
表1 实验用虾多种病原检测
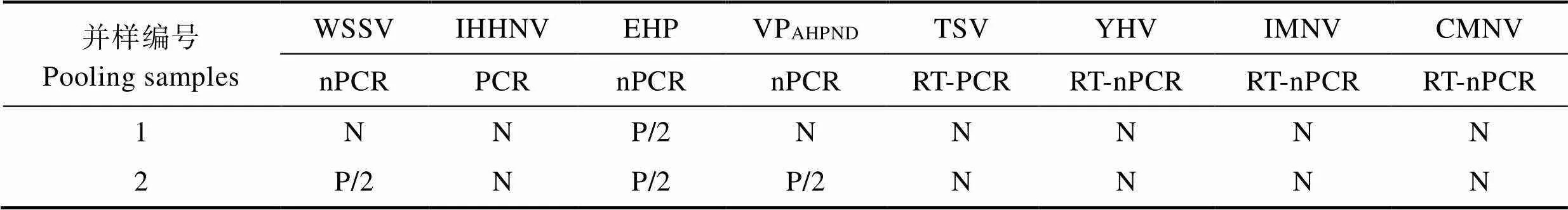
Tab.1 Detection of multiple pathogens in experimental shrimp
注:nPCR:套式PCR;RT-nPCR:反转录套式PCR;P/2:套式PCR第二轮阳性;N:阴性
Note: nPCR: Nested PCR; RT-nPCR: Reverse-transcript nested PCR; P/2: Positive in the second run of nPCR; N: Negative
2.5 养殖过程中对虾特定生长率的变化
每15 d进行的特定生长率统计结果表明,投喂16~30 d各组对虾的特定生长率比0~15 d的有所提升,但前30 d内P、E和PE组对虾的特定生长率与对照组相比没有显著差异(>0.05);在第31~45天,对照组的特定生长率出现明显下降,P组和PE组与16~30 d基本保持同一个水平,而E组显著上升,各实验组对虾的生长速度显著高于对照组(<0.05);在第46~60天,各组生长速度有不同程度的下降,但P组和E组的特定生长率仍然维持在较高的水平,并显著高于对照组(<0.05)(图3)。
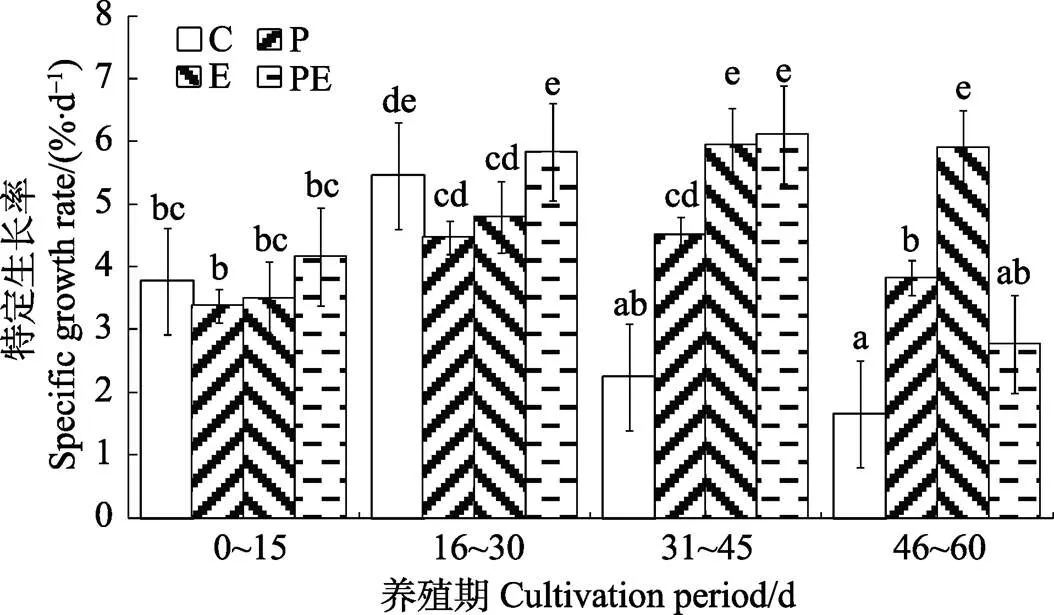
图3 投喂添加不同益生菌饲料过程中各组对虾特定生长率变化过程
C: 投喂对照商品饲料; P: 投喂添加假交替单胞菌 KL-3 2010饲料(P饲料); E: 投喂添加微小杆菌KL-C2 2014饲料(E饲料); PE: 间隔投喂P饲料和E饲料;标注相同小写字母表示无显著差异(>0.05),标注不同小写字母表示有显著差异(<0.05)。下表同
C: fed with commercial feed; P: fed withsp. KL-3 2010 added feed (P feed); E: fed withsp. KL-C2 2014 added feed (E feed); PE: fed interruptedly with P feed and E feed. Columns marked with same lowercase mean no significant difference (>0.05); different lowercases mean significant difference (<0.05). The same as in following tables
2.6 实验全程对虾生长、存活及生产特性
养殖60 d后,对各组对虾体重、存活率和饲料系数进行统计。结果显示,对照组存活率仅为25.5%± 1.8%,而P组对虾存活率达79.3%±7.6%,比对照组提高了213%±43% (<0.01);PE组对虾存活率为72.1%±10.1%,比对照组提高了184%±52% (<0.05)。对照组总平均生长率为(7.69±0.30)%/d;E组对虾总平均生长率为(15.78±1.76)%/d,比对照组提高了105.5%± 28.1%(<0.05);PE组对虾总平均生长率为(13.10± 2.12)%/d,比对照组提高了70.6%±32.8% (<0.05);P组对虾总平均生长率为(11.16±0.71)%/d,比对照组提高了45.3%±12.5% (<0.05)。
各实验组获得的单位水体产量与对照组比有显著差异(<0.05)(表2)。从高到低依次为PE组(702.5± 64.2)、P组(626.7±97.6)、E组(422.7±67.6)和C组(138.2±10.8) g/m3,分别是对照组的511%±71%、456%± 92%和308%±63%;E组、PE组和P组的饲料系数分别是对照组的68.6%±9.2%、73.0%±5.1%和76.3%± 1.0%,有显著差异(<0.05)(表2)。
2.7 肠道定植的可培养优势菌检测
养殖第40、50和60天时,取各组停喂2 d排空的对虾肠道,进行肠道内定植的优势菌培养和鉴定。结果显示,益生菌添加的颗粒饲料长期投喂改变了肠道内定植的优势菌群。在养殖40 d时,对照组对虾的肠道中定植菌量最少,无明显优势菌落,而P组肠道定植菌只有1株占绝对优势的副溶血弧菌,对该株副溶血弧菌进行了A和B基因检测,结果呈阴性,表明为非VPAHPND菌株;50 d时,P组肠道定植的优势菌除了副溶血弧菌还多了美人鱼发光杆菌(),而E组和PE组肠道定植的优势菌则分别为施罗氏弧菌()和施瓦氏菌(sp.),次优势菌为美人鱼发光杆菌;在60 d时,对照组肠道定植有美人鱼发光杆菌和副球菌(sp.)2株优势菌;而P组的肠道定植优势菌是微杆菌;E组和PE组肠道定植优势菌均为欧文斯弧菌(),且优势菌的密度要比对照组优势菌高2个数量级。其中,美人鱼发光杆菌是对照组和实验组都出现过的共同优势菌(表3)。
2.8 对虾免疫指标的变化
在养殖实验结束后,对各组凡纳滨对虾血清免疫相关酶活力以及总蛋白浓度进行了测定,结果显示,P组和E组对虾的血清ACP、SOD和POD明显高于对照组(<0.05);E组的ACP、POD、SOD和血清总蛋白浓度明显高于对照组(<0.05);但PE组除了SOD明显高于对照组(<0.05)外,其他免疫指标均低于对照组(表4)。
表2 投喂添加不同有益微生物饲料的凡纳滨对虾生长、存活和生产特性
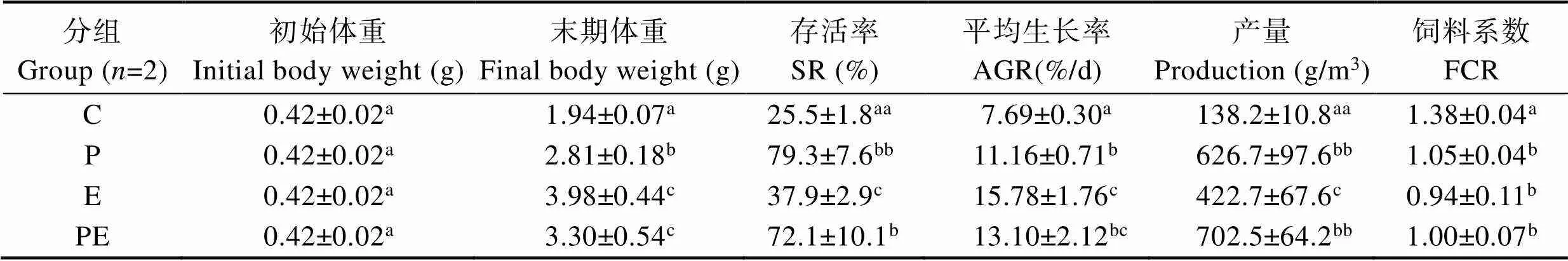
Tab.2 Growth, survival, and production properties of L.vannamei fed with diets with different probiotics addition
注:标注两个相同的字母表示极显著差异(<0.01)
Note: Duplicate lowercases mean very significant difference (<0.01)
表3 各实验组对虾肠道中定植的优势菌
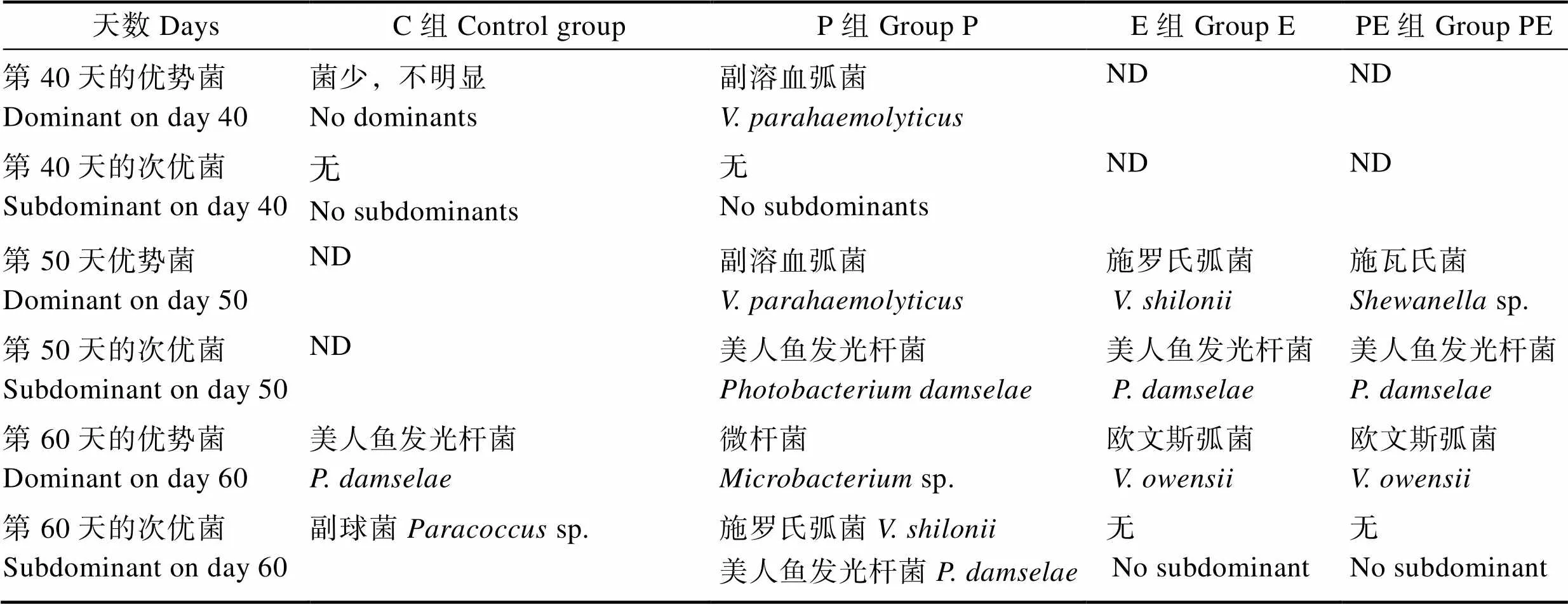
Tab.3 Dominant bacteria colonized in midgut of the experimental shrimp
注:ND: 未测试 Note: ND: Not detected
表4 不同有益菌添加饲料对凡纳滨对虾免疫的影响
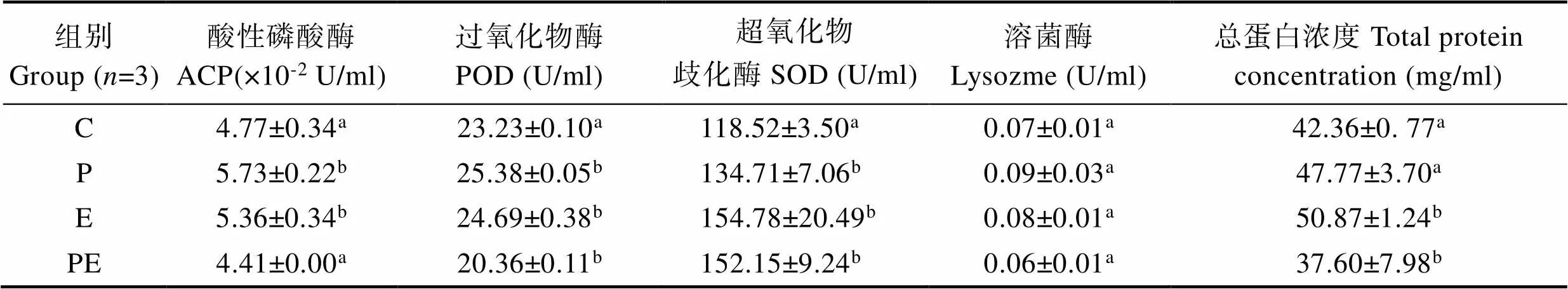
Tab.4 Effect of different dietary probiotics on immunity of L. vannamei
3 讨论
病害为当前对虾养殖业面临的主要问题之一。当前,多数养殖者缺少病原检测能力,使得携带病原的虾苗大量进入流通过程,给养殖者造成较大经济损失(黄倢等, 2016)。很多研究者开展的以健康虾苗为对象的益生菌应用报道中,对照组在存活率上不会受到实验对象本身携带病原所带来的死亡的影响,其对照组的存活率只略低于添加益生菌的实验组(胡毅等, 2008; 刘泓宇等, 2014; 王军等, 2015; 王玲等, 2011),这种情况下,用存活率难以反映益生菌的应用对虾苗产生的保护效果。本研究在普通养殖场进行,对该养殖场仅能获得的凡纳滨幼虾检出WSSV、VPAHPND和EHP病原弱阳性,反映了当前生产中面临的实际问题。在这种背景下,对照组在养殖中表现出很低的存活率,而益生菌添加组在生长和存活方面均获得了显著的正向效果,尤其是添加了假交替单胞菌KL-3 2010的P组和PE组,其存活率比对照组提高了约 2倍,这可能由于投喂的假交替单胞菌KL-3 2010可以分泌对VPAHPND有抑制作用的活性物质,使得携带VPAHPND的虾苗体内的病原没有机会繁殖暴发,从而获得比对照组显著提高的存活率。这为目前普遍携带VPAHPND的虾苗养殖中益生菌的开发和应用提供了更接近生产实际的实例。
已有研究表明,饲喂益生菌后,对虾肠道消化酶活性得到提高,显著促进对虾生长(Ziaei-Nejada, 2006; 胡毅等, 2008; 丁贤等, 2004);饲料中添加单一益生菌或多种益生菌,均可在一定程度上改变对虾肠道菌群而影响其消化,从而影响其生长特性(李桂英等, 2013)。本研究中,添加益生菌的实验组生长率比对照组均显著提高,尤其是添加了微小杆菌KL-C2 2014的实验组,其特定生长率成倍提高,推测这一方面由于实验对象携带可导致对虾生长缓慢的EHP (刘珍等, 2016; 刘亚梅等, 2017),而使对照组特定生长率从养殖中期开始出现显著下降(图3);另一方面,由于实验组投喂的2株益生菌分泌的胞外活性物质,包括各种抗菌物质和酶活性物质,改变了对虾肠道环境,直接或间接地影响了肠道菌群的组成,促进了对虾消化吸收,从而获得了显著提高的生长率。其中,添加微小杆菌KL-C2 2014的E组对虾特定生长率在整个养殖过程中都保持上升趋势(图3),直到养殖末期获得最高的平均生长率(表2),这可能与其分泌胞外蛋白酶和产生抗氧化物质有关(Kumar, 2014),其机理有待于进一步研究。该结果提示以上2株益生菌的使用可以为目前普遍存在的EHP阳性虾苗的生长难题提供一种可替代药物的解决方案。
Tannock(1998)研究表明,对肠道环境遭到破坏的动物通过饲喂有益微生物可以重新建立宿主正常的微生物群落。本研究饲喂添加益生菌的饲料60 d后,对虾肠道定植的可培养优势菌落中没有检测到所饲喂的2株益生菌,这可能是由于它们不适合对虾肠道环境生长繁殖,在2 d的停喂排空后,被其他易在肠道中定植的菌群取代。但这2株益生菌分泌的某些胞外产物及菌体本身可能在长期投喂中改变了肠道内环境,使得实验组对虾肠道定植的优势菌群与对照组相比产生显著差异。该结果表明,外源添加益生菌即使不能在肠道内优势定植,也可能通过改变宿主肠道环境而影响肠道定植的优势菌群结构,这种现象在其他一些对虾益生菌的研究报道中也被证实(郝凯, 2013; 胡毅等, 2008; 李桂英等, 2013)。
益生菌具有良好的免疫刺激作用,其作用机理可能是通过细菌本身或细胞壁成分刺激非特异性免疫系统使其发挥作用,从而提高动物免疫力(Rengpipat2000; 雷质文等, 2001; Stephensen, 1996; Thompson, 1995)。本研究中的P组和E组各项免疫指标都高于对照组,而PE组免疫指标除了SOD显著高于对照组,其他免疫指标都低于对照组(表4),但其存活率和生长率却显著高于对照组并介于P组和E组之间。以上结果提示,本研究所检测的几项免疫指标当中,SOD的水平可能在对虾抗病力和生长方面具有一定的指示性意义。
目前,对虾益生菌饲料添加多使用芽孢杆菌并以健康虾为对象,其实验组对虾在生长和存活方面与对照组相比都没有显著差异(胡毅等, 2008; 刘泓宇等, 2014; 王军等, 2015; 王玲等, 2015)。本研究以携带病原的虾苗为实验对象,使用1株假交替单胞菌和1株微小杆菌添加饲料投喂60 d,实验组获得了极显著的促生长和存活的效果,最终单位水体产量是对照组的3~5倍。其中,假交替单胞菌KL-3 2010主要与存活率的提高相关联;微小杆菌KL-C2 2014主要与促生长相关联。该结果可以为目前携带可导致死亡的VPAHPND和导致生长缓慢的EHP的虾苗的养殖提供一种可替代药物的病害防治措施。
Bachère E. Shrimp immunity and disease control. Aquaculture, 2000, 191(1–3): 3–11
Bharti N, Yadav D, Barnawal D,., a halotolerant plant growth promoting rhizobacteria, improves yield and content of secondary metabolites in(L.) Pennell under primary and secondary salt stress. World Journal of Microbiology and Biotechnology, 2013, 29(2): 379–387
Bowman JP. Bioactive compound synthetic capacity and ecological significance of marine bacterial genus. Marine Drugs, 2007, 5(4): 220–241
Chen WM, Lin CY, Chen CA,. Involvement of an L-amino acid oxidase in the activity of the marine bacteriumagainst methicillin-resistant. Enzyme and Microbial Technology, 2010, 47(1–2): 52–58
Crab R, Defoirdt T, Bossier P,. Biofloc technology in aquaculture: Beneficial effects and future challenges. Aquaculture, 2012, 356–357(4): 351–356
Dang H, Zhu H, Wang J,. Extracellular hydrolytic enzyme screening of culturable heterotrophic bacteria from deep-sea sediments of the Southern Okinawa Trough. World Journal of Microbiology and Biotechnology, 2009, 25(1): 71–79
Dastager SG, Kumaran DC, Pandey A. Characterization of plant growth-promoting rhizobacterium, NII-0906 for its growth promotion of cowpea (). Biologia, 2010, 65(2): 197–203
Ding X, Li ZJ, Chen YQ,. Effects of probiotics on growth and activities of digestive enzymes of. Fishery Sciences of China, 2004, 11(6): 580–584 [丁贤, 李卓佳, 陈永青, 等. 芽孢杆菌对凡纳对虾生长和消化酶活性的影响. 中国水产科学, 2004, 11(6): 580–584]
Hao K. The study of special probiotics toMaster's Thesis of Northwest A & F University, 2013 [郝凯. 南美白对虾专用益生菌研究. 西北农林科技大学硕士研究生学位论文, 2013]
Holmström C, James S, Neilan BA,.sp. nov., a bacterium that produces antifouling agents. International Journal of Systematic and Evolutionary Microbiology, 1998, 48(4): 1205–1212
Holmström C, Kjelleberg S. Marine, species are associated with higher organisms and produce biologically active extracellular agents. FEMS Microbiology Ecology, 1999, 30(4): 285–293
Hu Y, Tan BP, Mai KS,. Effects of dietary probiotic on growth, immunity and intestinal bacteria of juvenile. Fishery Sciences of China, 2008, 15(2): 244–251 [胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响. 中国水产科学, 2008, 15(2): 244–251]
Huang J, Zeng LB, Dong X,. Trend analysis and policy recommendation on aquatic biosecurity in China. (Chinese Journal) Engineering Sciences, 2016, 18(3): 15–21 [黄倢, 曾令兵, 董宣, 等. 水产生物安保发展趋势与政策建议. 中国工程科学, 2016, 18(3): 15–21]
Hultmark D, Steiner H, Rasmuson T,. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of. European Journal of Biochemistry, 1980, 106(1): 7–16
Isnansetyo A, Istiqomah I, Muhtadi,. A potential bacterial biocontrol agent, strain S2V2 against pathogenic marinein aquaculture. World Journal of Microbiology and Biotechnology, 2009, 25(6): 1103–1113
Kumar PKA, Suresh PV. Biodegradation of shrimp biowaste by marinesp. CFR26M and concomitant production of extracellular protease and antioxidant materials: production and process optimization by response surface methodology. Marine Biotechnology, 2014, 16(2): 202–218
Lafferty KD, Harvell CD, Conrad JM,. Infectious diseases affect marine fisheries and aquaculture economics. Annual Review of Marine Science, 2015, 7(1): 471–496
Lei F, Cui C, Zhao H,. Purification and characterization of a new neutral metalloprotease from marinesp. SWJS2. Biotechnology and Applied Biochemistry, 2016, 63(2): 238–248
Lei ZW, Huang J, Yang B,. Immune factors in haemolymph supernatant ofinfected by WSSV. Journal of Fishery Sciences of China, 2001, 8(4): 46–51 [雷质文, 黄倢, 杨冰, 等. 感染白斑综合症病毒(WSSV)的对虾相关免疫因子的研究. 中国水产科学, 2001, 8(4): 46–51]
Li GY, Sun Y, Song XL,. Potential probiotics supplement may impact intestinal digestive enzyme and bacteria composition of. Progress in Fishery Sciences, 2013, 34(4): 84–90 [李桂英, 孙艳, 宋晓玲, 等. 饲料中添加潜在益生菌对凡纳滨对虾肠道消化酶活性和菌群组成的影响. 渔业科学进展, 2013, 34(4): 84–90]
Li JQ, Tan BP, Mai KS,. Identification of one probiotic bacterium used in aquaculture. Periodical of Ocean University of China (Natural Science), 2006, 36(3): 434–438 [李继秋, 谭北平, 麦康森, 等. 一株水产益生菌的鉴定. 中国海洋大学学报(自然科学版), 2006, 36(3): 434–438]
Li Y, Yan XH, Chen JX,. Studies on the characteristics of pathogenicisolated from diseased. Periodical of Ocean University of China (Natural Science), 2006, 36(4): 649–654 [李筠, 颜显辉, 陈吉祥, 等. 养殖大菱鲆腹水病病原的研究. 中国海洋大学学报(自然科学版), 2006, 36(4): 649–654]
Liang JJ, Pang ZW, Zhang Lin,. Purification and characterization of antifungal material produced by marine. Guangdong Agricultural Sciences, 2014, 41(11): 114–117 [梁静娟, 庞宗文, 张琳, 等. 海洋假交替单胞菌抗真菌活性物质的纯化和鉴定. 广东农业科学, 2014, 41(11): 114–117]
Lin HZ, Guo Z, Yang Y,. Effect of dietary probiotics on apparent digestibility coefficients of nutrients of white shrimpBoone. Aquaculture Research, 2005, 35(15): 1441–1447
Liu HY, Li Z, Sun WW,. Effect of dietary plant extracts and probiotics on growth, non-specific immunity and disease resistance of the Pacific white shrimp().Feed Industry, 2014, 35(12): 21–26 [刘泓宇, 李正, 孙武卫, 等. 饲料中添加益生菌或植物提取物对凡纳滨对虾生长、免疫力及抗病力的影响. 饲料工业, 2014, 35(12): 21–26]
Liu YM, Qiu L, Chen DY,The relationship between body length and weight indetectedpopulations. Progress in Fishery Sciences, 2017, 38(4): 96–103 [刘雅梅, 邱亮, 程东远, 等. 检出虾肝肠孢虫()的凡纳滨对虾()群体的体长和体重关系. 渔业科学进展, 2017, 38(4): 96–103]
Liu Z, Zhang QL, Wan XY,. Development of real-time PCR assay for detecting microsporidianand the application in shrimp samples with different growth rates. Progress in Fishery Sciences, 2016, 37(2): 119–126 [刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫()实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119–126]
Lou D, Yang JF, Xie H. The effect of probiotics in aquaculture. Journal of Zhejiang Wanli University, 2009, 22(2): 78–83 [楼丹, 杨季芳, 谢和. 益生菌在水产养殖中的作用. 浙江万里学院学报, 2009, 22(2): 78–83]
Lucas-Elio P, Hernandez P, Sanchez-Amat A,. Purification and partial characterization of marinocine, a new broad- spectrum antibacterial protein produced by. Biochimica et Biophysica Acta: General Subjects, 2005, 1721(1–3): 193–203
Moriarty DJW. Control of luminousspecies in penaeid aquaculture ponds. Aquaculture, 1998, 164(1–4): 351–358
OIE. Manual of diagnostic tests for aquatic animals. World Organisation of Animal Health, 2016, http://www.oie.int/ international-standard-setting/aquatic-manual/access-online/
Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S,. Immunity enhancement in black tiger shrimp () by a probiont bacterium (S11). Aquaculture, 2000, 191(4): 271–288
Rodrigues S, Paillard C, Dufour A,. Antibiofilm Activity of the marine bacteriumsp3J6 against, the causative agent of brown ring disease. Probiotics and Antimicrobial Proteins, 2015, 7(1): 45–51
Selvakumar G, Joshi P, Nazim S,., strain 1P (MTCC 8707) a novel bacterial antagonist from the North Western Indian Himalayas. World Journal of Microbiology and Biotechnology, 2009, 25(1): 131–137
Stephensen CB, Moldoveanu Z, Gangopadhyay NN. Vitamin A deficiency diminishes the salivary immunoglobulin A response and enhances the serum immunoglobulin G response to influenza A virus infection in BALB/c mice. Journal of Nutrition, 1996, 126(1): 94–102
Tang YS, Li Y, Zhu JJ,. Colony PCR apply to the rice genome sequencing. Progress in Biochemistry and Biophysics, 2002, 29(2): 316–318 [唐晔盛, 李英, 朱静洁, 等. 菌落PCR在大规模基因组测序中的应用. 生物化学与生物物理进展, 2002, 29(2): 316–318]
Tannock GW. Studies of the intestinal microflora: A prerequisite for the development of probiotics. International Dairy Journal, 1998, 8(5): 527–533
Thompson I, Choubert G, Houlihan DF,. The effect of dietary vitamin A and astaxanthin on the immunocompetence of rainbow trout. Aquaculture, 1995, 133(2): 91–102
Tourtip S, Wongtripop S, Stentiford GD,sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp(Decapoda: Penaeidae): Fine structure and phylogenetic relationships. Journal of Invertebrate Pathology, 2009, 102(1): 21–29
Wang FQ, Li K, Shao ZT,. Growth promotion by proteinase-produced-bacteria from gastrointestinal tract of flounder to flounder juveniles. Marine Science, 2005, 29(1): 29–33 [王福强, 李坤, 邵占涛, 等. 产蛋白酶益生菌Y2-2和Y1-13对牙鲆幼鱼生长促进作用的研究. 海洋科学, 2005, 29(1): 29–33]
Wang J, Sun RJ. Study on the application of a compound microbial fermentation feed inculture. Journal of Hunan Feed, 2015(2): 32–34 [王军, 孙瑞健. 一种复合微生物发酵饲料在凡纳滨对虾养殖中的应用研究.湖南饲料, 2015(2): 32–34]
Wang L, Zhang CX, Sun M,. Effects of dietary(CGMCC No. 3755) on the growth performance and non-specific immunity of. Feed Industry, 2011, 32(4): 47–52 [王玲, 张春晓, 孙鸣, 等. 饲料中添加枯草芽孢杆菌(CGMCC No.3755)对凡纳滨对虾生长性能和非特异性免疫力的影响. 饲料工业, 2011, 32(4): 47–52]
Wang ZJ, Hu XG, Liu YM,. The isolation, identification and analysis of a nitrogen-removing bacterium strain from shrimp farming pond using bio-floc technology. Progress in Fishery Sciences, 2015, 36(2): 100–105 [王志杰, 胡修贵, 刘旭雅, 等. 自生物絮团养殖池分离具有亚硝酸盐去除功能的细菌及其鉴定和特性. 渔业科学进展, 2015, 36(2): 100–105]
Xi Y, Zhu DH, Liu HT,Advances onspecies and their extracellular bioactive compounds. Microbiology, 2005, 32(3): 108–112 [席宇, 朱大恒, 刘红涛, 等. 假交替单胞菌及其胞外生物活性物质研究进展. 微生物学通报, 2005, 32(3): 108–112]
Zhang QL, Liu Q, Liu S,. A new nodavirus is associated with covert mortality disease of shrimp. Journal of General Virology, 2014, 95(12): 2700–2709
Zhang Y, Shi P, Ma J.spp. and their applications in environmental remediation. Chinese Journal of Applied and Environmental Biology, 2013, 19(5): 898–904 [张莹, 石萍, 马炯. 微小杆菌spp.及其环境应用研究进展. 应用与环境生物学报, 2013, 19(5): 898–904]
Zhao MM, Lei FF, Zhong HB,. Enzymatic hydrolysis of fish proteins using protease produced bysp. SWJS2. Journal of Modern Food Science and Technology, 2014(2): 153–158 [赵谋明, 雷芬芬, 钟泓波, 等. 微小杆菌属SWJS2蛋白酶对鱼肉酶解特性的研究. 现代食品科技, 2014(2): 153–158]
Zhao P, Huang J, Wang XH,. The application of bioflocs technology in high-intensive, zero exchange farming systems of. Aquaculture, 2012, 354–355(2): 97–106
Ziaei-Nejad S, Rezaei MH, Takami GA,. The effect ofspp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp. Aquaculture, 2006, 252(2–4): 516–524
Effects of Probiotics-Supplemented Diets on the Growth and Survival ofCarrying Multiple Pathogens
LIAN Xiaojun1,2, ZHU Kailing1, ZHANG Qingqi3, WAN Xiaoyuan1, XIE Guosi1, GUO Chengcheng1, HUANG Jie1,2①
(1. Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao); Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071; 2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306; 3. Lianyungang Qiming Aquculture Ltd, Lianyungang 222100)
Current shrimp farming industries face difficulties associated with disease outbreak caused by pathogens on shrimp larva. The application of probiotics may provide a solution to problems associated with disease. We usedsp. strain KL-3 2010, which has antagonism against acute hepatopancreatic necrosis disease-causing(VPAHPND) and extracellular protease activity, andsp. strain KL-C2 2014, which has extracellular protease activity, as probiotics in a feeding test ofto investigate their effects on the growth and survival of shrimp. These two bacterial strains had no pathogenicity toin an immersion challenge at 108CFU/ml. Weak positive signals for white spot syndrome (WSSV), VPAHPND, and(EHP) were detected in the population of shrimp juveniles used in this study.was fed for 60 days withsp. KL-3 2010-supplemented diets (P group),sp. KL-C2 2014-supplemented diets (E group), alternation of the two diets (PE group), and normal diets (C group), respectively. Compared with the control group, the survival rate of the P group significantly improved (by 213%±43%;<0.01), the average growth rate of E group significantly increased (by 105.5%±28.1%;<0.05), and the survival rate and average growth rate of the PE group simultaneously improved (by 184%±52%;<0.05 and by 70.6%±32.8%, respectively). Feeding withsp.KL-3 2010 andsp. KL-C2 2014 diets significantly affected the species of dominant microflora colonizing the shrimp gut, but these added probiotic bacterial strains were not detected in the re-isolated and cultivated dominant bacteria colonies. The addition with these probiotics to diets significantly increased some serum immune indexes, such as superoxide dismutase. The study showed that diets supplemented with the above probiotics may provide a practical approach for disease prevention and growth promotion in shrimp farming, even for shrimp positive for multiple pathogens.
; Probiotics; Growth; Survival; Positive multiple pathogens
S963
A
2095-9869(2020)02-0121-10
黄 倢,研究员, E-mail: huangjie@ysfri.ac.cn
2019-03-16,
2019-04-23
* 江苏省苏北科技专项(科技富民强县)(BN2016058)、中国东盟海上合作基金(2016-2018)、现代农业产业技术体系(CARS-47)、青岛海洋科学与技术国家实验室鳌山科技创新项目(2015ASKJ02)、948计划(2016-X56)和山东省泰山学者建设工程专项共同资助 [This work was supported by the Special Fund for Subei Sci. & Tech. of Jiangsu Province (BN2016058), China ASEAN Maritime Cooperation Fund Project (2016-2018), China Agriculture Research System (CARS-47), Project of the Aoshan Sci. and Tech. Innovation Program of Qingdao National Laboratory for Marine Science and Technology (2015ASKJ02), 948 Program (2016-X56), and the Construction Program for Distinguished Taishan Scholars of Shandong Province of China]. 练小军,E-mail: ronaldlj@163.com
10.19663/j.issn2095-9869.20190316001
http://www.yykxjz.cn/
练小军, 朱开玲, 张庆起, 万晓媛, 谢国驷, 郭程程, 黄倢. 饲料添加益生菌对多病原阳性的凡纳滨对虾生长与存活的影响. 渔业科学进展, 2020, 41(2): 121–130
Lian XJ, Zhu KL, Zhang QQ, Wan XY, Xie GS, Guo CC, Huang J. Effects of probiotics-supplemented diets on the growth and survival ofcarrying multiple pathogens. Progress in Fishery Sciences, 2020, 41(2): 121–130
HUANG Jie, E-mail: huangjie@ysfri.ac.cn
(编辑 冯小花)

