齐墩果酸通过AMPK介导的信号通路激活自噬改善脂毒性诱导的肝细胞损伤
冯璐燕 赖尚磊 叶萤燕 张漪婷 窦晓兵 李松涛
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种以肝脏脂肪过量积聚为主要病理特征的疾病,其临床表现形式包括单纯性脂肪肝、非酒精性脂肪性肝炎,疾病可递进发展为肝纤维化、肝硬化和肝细胞癌等中末端肝病[1-2]。近年来伴随人们生活习惯和饮食结构的改变,NAFLD 在我国的患病率逐年增加,我国NAFLD的患病率从2013年报道的20.9%,增加至2018年的25%以上[3-4]。在NAFLD的治疗中祖国医学的疗效具有明显优势,采用中医药物治疗 NAFLD可减少肝脏脂肪沉积、改善脂质代谢紊乱及肝功能[5]。中药单体化合物齐墩果酸(oleanolic acid,OLA)主要来源于女贞子,《本草再新》中论述女贞子具有“养阴益肾、补气舒肝”的功效,杨念云等[6]研究发现女贞子可显著改善高脂饮食诱导的NAFLD。研究表明OLA具有调血脂、抗脂肪肝等功效[7],但其作用机制尚不明确,因此,本研究以棕榈酸(palmitic acid,PA)诱导Aml-12肝细胞建立肝细胞脂毒性模型,探究OLA对PA诱导肝细胞脂毒性的保护作用及潜在分子机制。
1 材料与方法
1.1 材料及仪器 Aml-12小鼠正常肝细胞株购自中国科学院(上海)细胞库;PA、雷帕霉素(rapamycin,Rap)、氯喹(chloroquine,CQ)、OLA、DMEM/F12 培养基购自Sigma公司;胎牛血清购自Gibco公司;抗LC3B及抗GAPDH抗体购自Cell Signaling公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术公司;二氧化碳培养箱(Thermo,USA);酶标仪(MD,USA);AllegraTM 64R低温高速离心机(Beckman,USA);数字凝胶成像系统(Protein Simple,USA)。
1.2 方法 (1)细胞培养:Aml-12细胞培养于DMEM/F-12培养基(含10%胎牛血清、100U/ml青霉素、100μg/ml链霉素、5mg/ml胰岛素,5μg/ml转铁蛋白,5ng/ml硒,40ng/ml地塞米松)于37℃、5%CO2培养箱中进行培养。(2)细胞干预:OLA不同浓度(10、20、40、80、100μmol/L)干预细胞24h后检测细胞活力。OLA保护脂毒性实验中使用OLA干预2h后加入PA处理12h,收集培养基或细胞便于进行后续实验研究。自噬激动或抑制分别采用自噬激动剂Rap(100nmol/L)或自噬抑制剂CQ(20μmol/L)对细胞预处理1h后给予其他干预。(3)PA制备:将棕榈酸溶解在乙醇中并用氢氧化钠皂化。将钠盐干燥,重新悬浮在PBS中并在80℃下加热直至其完全溶解。当溶液仍然温热时,加入等体积的20%BSA,将混合物在50℃搅拌4h,使棕榈酸与BSA结合。然后通过使用0.2μm直径的过滤器过滤将棕榈酸-BSA(3mmol/L棕榈酸:1.5mmol/L BSA;摩尔比,2:1)除菌,并分装以备使用。(4)细胞死亡检测:乳酸脱氢酶(LDH)在培养液中的释放、Hoechst染色和MTT试验。对乳酸脱氢酶测定,收集培养基,用乳酸脱氢酶检测试剂盒(Thermo Scientific Inc,VA),按照制造商的说明指示,Hoechst染色用Hoechst 33342染色液(5mg/L)染色10min。PBS漂洗后,用荧光显微镜对细胞进行成像(Leica,Whitzlar,德国)。MTT法将细胞接种于96孔板中,密度为2×104/孔,培养至80%汇合。每孔分别加入20μl[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑,5mg/ml]。细胞在37℃下孵育4h,使MTT掺入并转化为甲醛衍生物。二甲亚砜(DMSO)对甲醛衍生物有一定的增溶作用。在室温下摇床孵育10min后,用FLUOSTAR Omega在470nm处测定吸光度值(BMG LabTech,Offenburg,德国)。(5)Western Blot:收集细胞,用PBS漂洗,加适量蛋白裂解液,放冰上30min,充分涡旋震荡后,于4℃ 12000g离心15min,收集蛋白上清液,用BCA法测定蛋白质浓度。加入上样缓冲液,100℃煮5min使蛋白变性,冷却后上样。每个样品取等量蛋白用SDS-PAGE电泳分离后,低温转移至PVDF膜,含5% BSA封闭液封闭,与相应的一抗、二抗杂交,用化学发光法及数字凝胶成像仪对图像进行拍照。
1.3 统计学方法 采用SPSS 22.0统计软件。对多组不同处理方式的样本,先进行方差齐性检验,方差齐时采用one-way ANOVA方法进行显著性检验统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 肝细胞脂毒性模型建立 如图1A所示,给予Aml-12小鼠肝细胞不同浓度的PA进行干预,细胞释放的LDH水平显著增加(P<0.05),并呈现剂量依赖关系,说明肝细胞损伤显著增强。Hoechst染色结果表明PA干预以剂量依赖关系增加肝细胞的细胞核损伤(图1B)。上述结果说明PA可以剂量依赖关系诱导肝细胞脂毒性,在后续研究中选择0.5mmol/L的PA作为脂毒性诱导剂量。
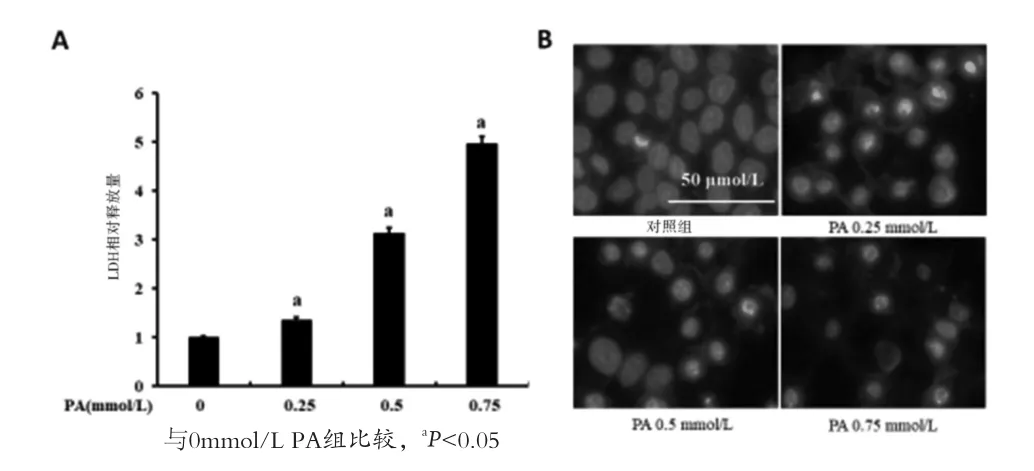
图1 不同浓度PA对Aml-12细胞脂毒性的影响(注:A:PA干预后细胞上清LDH含量检测;B:Hoechst染色观察PA诱导的肝细胞损伤)
2.2 OLA改善PA诱导的肝细胞脂毒性 给予Aml-12细 胞 不 同 浓 度 剂 量 的 OLA(10、20、40、80、100μmol/L)处理24h后,通过MTT法检测细胞活力,实验结果表明当OLA浓度>80μmol/L呈现出显著的细胞毒性(P<0.05,图2A)。因此,选择≤40μmol/L的OLA浓度进行后续研究。研究结果表明OLA干预可显著抑制PA(0.5mmol/L)诱导的肝细胞损伤(P<0.05),并呈现剂量依赖关系(图2B、C)。
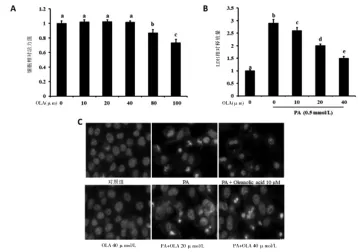
图2 OLA改善PA诱导的肝细胞脂毒性[注:A:MTT法细胞活力检测细胞;B:培养液上清LDH含量检测;C:Hoechst染色观察(400×)]
2.3 自噬调控PA诱导的肝细胞脂毒性 分别采用自噬抑制剂CQ(20μmol/L)和自噬激动剂Rapamycin(100 nmol/L)对Aml-12细胞进行预处理1h,然后给予细胞PA处理12h,检测自噬抑制或激活自噬对PA诱导的细胞损伤的影响,结果表明抑制自噬可显著加重PA诱导的细胞损伤,而激活自噬能显著改善细胞损伤情况(P<0.05,图3A)。通过Hoechst染色观察得到与上述一致的结果,即抑制自噬显著加重了PA处理导致的胞内细胞核固缩及核小体碎片增加;而激活自噬后细胞核损伤明显改善(图3B)。

图3 自噬调控PA诱导的肝细胞脂毒性[注:A:细胞上清LDH含量检测;B:Hoechst染色观察(400×)]
2.4 OLA通过激活自噬改善PA诱导的脂毒性 随后检测了OLA对肝细胞自噬的影响,分别以10、20和40μmol/L的OLA处理Aml-12肝细胞12h,通过Western blot检测自噬标志蛋白LC3B Ⅰ/Ⅱ的表达变化,结果表明OLA能以剂量依赖关系激活LC3 Ⅱ的表达(P<0.05,图4A),说明OLA可显著激活肝细胞自噬。给予Aml-12细胞自噬抑制剂CQ(20μmol/L)预处理1h后再给予OLA(40μmol/L)干预2h,随后进行PA处理12h,结果表明抑制自噬显著阻断了OLA对PA诱导脂毒性的保护作用(P<0.05,图4B)。Hoechst染色观察结果一致(图4C)。上述结果提示自噬信号通路参与了OLA对PA诱导的脂毒性的保护作用。

图4 抑制自噬抑制了OLA对PA诱导脂毒性的保护作用[注:A:Western blot测定LC3B Ⅰ/Ⅱ的蛋白表达;B:上清LDH含量检测;C:Hoechst染色观察(400×)]
2.5 OLA通过激活AMPK磷酸化激活自噬 现有研究表明AMPK的激活参与自噬的正向调控。为验证AMPK是否参与OLA激活自噬对脂毒性的保护作用,分别以10、20和40μmol/L的OLA处理Aml-12肝细胞12h,通过Western blot检测细胞内AMPK磷酸化水平,结果表明OLA以剂量依赖关系激活AMPK的磷酸化(P<0.05,图5A)。分别使用AMPK化学抑制剂(compound C,1μmol/L)或AMPK siRNA 对AMPK进行抑制,结果表明抑制AMPK可显著阻断OLA对脂毒性的缓解作用(P<0.05,图5B、C)。

图5 OLA通过激活AMPK磷酸化缓解脂毒性(注:A:Western blot测定磷酸化AMPK、AMPK的蛋白表达;B&C:LDH含量检测)
3 讨论
本研究证实OLA对PA诱导的Aml-12细胞脂毒性具有保护作用,结果表明OLA通过激活自噬发挥其有益作用。进一步研究表明AMPK信号通路参与了OLA对脂毒性的保护作用。
NAFLD已成为严重威胁人类健康的疾病。近年来中医药在防治NAFLD 已经取得了较好的效果。NAFLD在历代典籍中已有记载,并根据临床表现总结出该病“胁痛”、“痞满”、“积聚”、“肝癖(痞)”等病因病机。何道同等[8]认为,肝脾功能失常是脂肪肝发病的始动因素[8]。有研究将NAFLD病因病机归纳为饮食失调、肝郁气滞、肝失疏泄[9]。NAFLD病机可简要概括为“痰瘀互阻、脂浊积聚、肝络不和”。而女贞子具有补气舒肝之功效,已有研究表明女贞子可显著改善高脂饮食诱导的NAFLD[7],而OLA是女贞子的主要成分,研究显示OLA显著抑制高脂饮食诱导的肥胖[10],也能够保护由果糖诱导的NAFLD[11]。但是其机制并不清楚,尤其是对脂毒性的改善作用不明确,本研究通过PA诱导肝细胞建立肝细胞脂毒性模型,使用OLA进行干预,结果显示OLA能够以剂量依赖关系改善PA诱导的Aml12肝细胞脂毒性的作用。
自噬是一种重要的分解代谢程序,用于处理各种大分子细胞内容,包括蛋白质聚集体、功能失调的亚细胞器,以维持细胞稳态。当非脂肪细胞脂质过度沉积,机体可通过脂肪代谢产物、氧化应激等途径激活自噬,以保护非脂肪组织免受脂毒性损害[12],因此增强自噬是治疗非酒精性脂肪性肝病、代谢综合征等相关疾病的新途径,作者前期发现激活自噬可以保护脂毒性诱导的肝损伤[13],在本研究中证实了这个结论。更重要的是作者发现了OLA可以激活自噬,检测了OLA对Aml12肝细胞自噬的调节作用。结果表明,OLA是自噬的强诱导剂,观察到OLA作用后导致自噬标志蛋白LC3B的表达显著增加,且抑制自噬可阻断OLA的保护作用,说明OLA通过激活自噬发挥脂毒性保护作用。
目前OLA如何激活自噬的分子机制尚不清楚,研究表明AMPK是自噬的上游调控分子,而Matumba等[14]研究表明OLA可显著激活AMPK,因此,推测OLA可激活AMPK并发挥脂毒性保护作用。本研究结果显示,OLA能过激活AMPK的磷酸化,但结果表明抑制AMPK并不能完全抑制OLA对脂毒性的保护作用,说明还有其他分子信号通路参与该保护作用,需要后续深入研究。

