茶黄素预处理剂对树脂-牙本质粘结面的初期和抗老化影响
徐炯园 黎红
在树脂-牙本质粘结修复中,脱矿后的牙本质表面暴露胶原纤维和牙本质小管,随后树脂渗透,形成树脂-牙本质混合层,这是树脂-牙本质粘结修复的基础。但受制于临床现实,树脂无法完全覆盖胶原支架,导致裸露的胶原网络在内、外因素作用下降解[1-3]。其中最主要的是内源性基质金属蛋白酶(MMPs)。为了延长树脂-牙本质粘结修复体的使用寿命,现阶段的研究热点是对多种MMPs抑制策略进行应用探索[4]。在使用各类天然或人工合成的MMPs非特异性的酶抑制剂时,粘结界面的粘结强度、抗老化能力均会增加。作为一种天然起源的MMPs抑制剂[5-8],茶黄素(TFs)同时也是一种具有苯骈卓酚酮结构的酚性色素,其具有抗菌消炎、抗病毒抗氧化、降低血脂(辅助用于治疗心脑血管疾病)等多种生理功效,甚至在抗肿瘤治疗方面也有一定的辅助疗效。同时,TFs被证明在例如关节炎、牙周炎、抗胶原引起的血栓等由胶原降解而引起的疾病治疗中起到了重要的作用。但对于TFs在口腔医学的研究中,基本还局限于对于口腔软组织的治疗以及抗龋方面的作用,较少有对TFs在牙本质粘结修复方面作用的研究。本实验通过微拉伸测试仪测量树脂-牙本质粘结界面的微拉伸强度(TBS)[9]比较TFs对树脂-牙本质粘结界面强度的影响,来为口腔医学提供参考数据。
1 材料和方法
1.1 仪器与试剂 慢速切割机(Isomet Buehler),游标卡尺(Blue·Point),微拉伸测试仪(Micro Tensile Tester/Bisco),人工唾液,高纯度茶黄素,2%氯己定试剂,氯胺T,光固化树脂(3M/ESPE Z350XT树脂/光固化复合树脂),Single Bond2(3M/ESPE Adper),37%磷酸酸蚀剂5ml(登泰克),氰基丙烯酸粘合剂(Zapit),扫描电子显微镜。
1.2 方法 (1)茶黄素预处理剂配置:将茶黄素溶于蒸馏水中,配置成20μmol/L浓度的茶黄素预处理剂,并用氢氧化钙滴定至pH=7.2备用。(2)离体牙收集及实验分组:在患者知情同意下,收集杭州口腔医院口腔颌面外科门诊拔出的新鲜无龋坏第三磨牙,共48颗。刮匙刮去附着软组织后随机分成阴性对照组(A组)、阳性对照组(B组)和TFs预处理组(C组),每组各16颗离体牙,并浸泡于6.16g/L的氯胺T溶液中,4℃低温保存。收集的离体牙在1个月内进行实验使用。(3)即刻TBS测量基本过程:A、B、C三组,每组取出一半样本进行实验(8颗),见表1。(4)老化TBS测量基本过程:每组使用剩余一半样本进行实验(8颗),见表2。

表1 即刻TBS测量基本过程

表2 老化TBS测量基本过程
1.3 微拉伸试件制备及拉伸测试示意图 见图1。

图1 微拉伸试件制备及拉伸测试示意图
1.4 TBS测量及计算方式 将粘结试件用Zip胶水固定于微拉伸测试仪上以1mm/min的加载速度测试试件因拉伸断裂时的最大荷载值(N),除以试件横截面面积(mm),得到粘结强度(MPa),即TBS。
1.5 电镜扫描 选取老化后微拉伸样本进行干燥喷金,扫描电镜观察。
1.6 统计学方法 收集整理各类粘结界面的断裂模式,采用SPSS 25.0软件对每次测量的TBS进行分析。计量资料以(±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
在试件拉伸时,各组都有若干试件断裂面不在粘结界面上,因此要排除相应的数据。仅选取粘结界面破坏这种断裂方式的进行研究分析。
2.1 对不同处理因素组间的差异进行比较 老化处理后无论何种处理方式,TBS均明显下降(P<0.001),见表1。
表1 对不同处理因素组间的差异进行比较[Mpa,(±s)]

表1 对不同处理因素组间的差异进行比较[Mpa,(±s)]
试验分组 即刻TBS 老化TBS 差值 t值 P值n 均数±标准差 n 均数±标准差A组 42 18.99±2.77 50 11.85±2.19 7.14 13.808 <0.001 B组 45 21.98±2.42 50 15.69±2.40 6.28 12.682 <0.001 C组 45 18.72±2.26 49 13.44±2.74 5.29 10.160 <0.001
2.2 即刻TBS和老化TBS各试验组之间的差异进行LSD多重比较 即刻拉伸实验中,C组与A组无统计学差异(P=0.611),B组TBS大于A组和C组,且有统计学差异(P<0.001)。老化实验中,C组TBS小于B组(P<0.001),大于A组(P=0.002)。见图2。
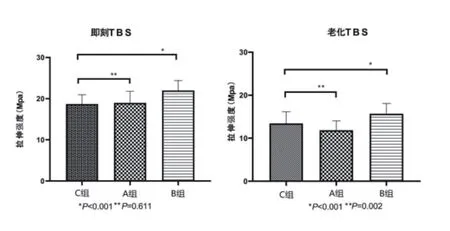
图2
2.3 扫描电镜 扫描电镜观察粘结断裂面可见,即刻试验中(图3,分别是A、B、C三电镜下图像),多数断裂在混合层靠近粘结剂方向,断裂面有树脂覆盖,未见牙本质暴露。在老化后粘结断裂面电镜扫描图(图4),可见多数断裂于混合层下部,靠近牙本质界。(AR:粘结剂;D:牙本质;DT:牙本质小管;FN:管周纤维网;R:树脂;RT:树脂突)。

图3 A、B、C三电镜下图像。a1:断裂面主要在树脂层;a2:高倍镜下a1图;b1:主要断裂在混合层下部,靠近牙本质界;b2:高倍镜下b1图可见被树脂深入牙本质小管形成锥形树脂突,管周胶原纤维网保存较完整;c1:断裂在混合层上部,带有部分树脂;c2:高倍镜下c1图

图4 老化后粘结断裂面电镜扫描图。a1:断裂面主要在牙本质层;a2:高倍镜下a1图,可见牙本质小管,部分管内树脂突缺如,管周胶原纤维网有断裂;b1:主要断裂在混合层下部,靠近牙本质界,部分断裂在牙本质层;b2:高倍镜下b1图仍可见牙本质小管内的树脂突,空隙较小,管周胶原纤维网不完整;c1:断裂在混合层下部,部分断裂在牙本质层;c2:高倍镜下c1图,牙本质小管内可见树脂突,但已有间隙,管周胶原纤维网有断裂
3 讨论
MMPs抑制剂氯己定(chlorhexidine,CHX)已被广泛应用于口腔治疗中。相关文献报道[10],MMP-2、MP-8、MMP-9 的活性在 CHX 的作用下会受到抑制,其可以交联牙本质小管管周的胶原纤维,并抑制MMPs 的作用,从而保证胶原纤维不被降解,使树脂-牙本质粘结界面持久耐用。如今,CHX已成为口腔粘结中的金标准。TFs是茶叶中找到具有确切药理作用的化合物,且具有广泛的生物活性。在抑制MMPs活性的过程中有与CHX的相似之处,作为一种苯骈卓酚酮结构的酚性色素,TFs能与多种金属离子形成络合物结晶体,从而激发了TFs作为阳离子螯合剂的作用。TFs作为一种植酸有较强的二价金属离子螯合性,尤其是在pH接近中性的情况下,TFs会与牙本质中的Ca2+、Zn2+等金属阳离子螯合。而MMPs的活化,必须将酶活性区间的阳离子配基与牙本质中的Ca2+、Zn2+等金属阳离子结合。因此,TFs能竞争性抑制MMPs的活性,从而保护树脂-牙本质粘接界面,减缓其酶解老化过程。与MMPs 人工合成抑制剂CHX比较,TFs作为一种天然化合物,其螯合阳离子方式较为温和,对牙周组织无毒、无刺激。
从电镜扫描图中可以看出TFs对牙本质胶原纤维降解活动有抑制作用,改善混合层粘结性能,从而延缓树脂-牙本质粘结界面的老化。在未使用TFs或CHX的情况下其断裂面牙本质明显脱矿,牙本质小管空虚,胶原纤维断裂。而使用TFs预处理储存3个月的样本,其断裂面牙本质小管中有残留树脂突。而对于树脂粘结剂,其与牙本质的固位力来源于树脂突固位和化学固位。因此,使用TFs预处理牙本质面,有其应用前景。
本实验结果表明,TFs起到了一定抑制牙本质MMPs和保护混合层的作用,这种作用需要≥3个月的时间来体现。减缓粘结强度下降即体现了TFs在树脂-牙本质粘结界面抗老化方面的潜力。但是,TFs抑制牙本质中MMPs的分子机制、抑制效果、持续时限以及最适抑制浓度等问题都有待于进一步的研究。

