窄谱中波紫外线联合吡美莫司乳膏对成人型特应性皮炎患者PBMC产生eotaxin和CCR3表达的影响
杨艳, 李嘉彦, 周欣, 田歆, 高爱莉, 熊斯颖, 李薇, 陈晓吟, 刘玉梅, 朱慧兰
(广州市皮肤病防治所,广东 广州 510095)
特应性皮炎(atopic dermatitis,AD)是一种慢性免疫异常性皮肤病,也是临床上常见的过敏性皮肤病,其发病机制与趋化因子存在密切关系,趋化因子与靶细胞上相应受体特异性结合是各种免疫细胞完成炎症反应中的组织定位、浸润、再循环和归巢等效应的分子基础。窄谱中波紫外线(narrowband-UVB,NB-UVB)具有生物活性较强、不良反应较少、患者依从性好等特点,已在临床上得到了较为广泛的应用,但其作用于特应性皮炎的机理还不清楚。吡美莫司乳膏为钙调神经磷酸酶抑制剂,具有免疫抑制作用。本研究检测NB-UVB联合吡美莫司乳膏治疗特应性皮炎前后,患者外周血嗜酸性粒细胞相关趋化因子eotaxin及其受体 CCR3的变化,以了解其治疗机制,现将结果报告如下。
1 材料与方法
1.1 一般资料
30例成人型中重度AD患者来自于2019年5-12月本所皮肤科门诊,其中男16例,女14例;年龄18~53岁,平均(27.97±9.37)岁;病程1~32年,平均(19.83±8.03)年。纳入标准:①符合特应性皮炎的诊断标准[1];②无严重心、肝、肾及其他脏器疾病;③治疗前3个月内未接受过任何光疗;④治疗前3个月内全身或局部未使用过糖皮质激素、免疫抑制剂。排除妊娠、哺乳及光敏感等特殊情况。本研究中患者均已签署知情同意书,研究通过伦理审批(批件号:201715)。
1.2 仪器与试剂
仪器:UV 100 L型紫外线照射仪(德国沃曼公司), 波长310~315 nm, 峰值为311 nm;BD FACSCalibur流式细胞分析仪(美国BD公司)。试剂:鼠抗人CCR3-FITC 及同型对照(美国R&D公司);人 eotaxin 定量 EIA 试剂盒(上海森雄科技实业公司)。
1.3 标本采集和处理
清晨空腹抽取所有研究对象肘静脉血10 mL,经肝素200 U抗凝,采用Ficoll 密度梯度离心法分离PBMC及细胞收集与培养。
1.4 治疗方法
采用 NB-UVB照射,每周3次,连续照射3个月。NB-UVB照射方法: 以照射仪附带的最小红斑量(minimal erythema dose,MED)测试附件测定患者皮肤(前臂)MED为参考剂量。 再根据此参考剂量减20%作为初始照射剂量, 平均为0.6 J/cm2, 治疗后再根据患者皮肤反应程度调整照射剂量。一般在前次照射后无红斑反应的前提下,每次增加照射剂量20%, 最大照射剂量为3.4 J/cm2。治疗时患者需配戴UV防护眼镜,接受全身照射者须穿短裤以保护生殖器部位。
治疗期间患者早晚一次全身均匀涂抹一薄层维生素E乳膏保湿,在医生明确诊断为AD部位上外用吡美莫司乳膏(1%浓度,每日2次,治疗3个月)。
1.5 疗效评价
采用欧洲SCORAD评分系统[2],对AD皮损及临床严重程度进行评估。采用视觉模拟尺度(visual analogue scale,VAS)评分法对瘙痒程度进行评价。于治疗前和治疗结束后记录SCORAD分值及VAS分值, 评价疗效。评分由同一位医师专门负责。
1.6 ELISA检测AD患者血清中eotaxin水平
采用双抗体夹心法, 操作步骤按试剂盒说明书进行。
1.7 荧光抗体标记及流式细胞仪检测PBMC中CCR3水平
在指标管中加入 10 μL CCR4-FITC 试剂, 然后在检测管中分别加入 100 μL 抗凝血,并设立同型对照管, 振荡混匀,室温避光孵育20 min;加入2 mL的溶血素,振荡混匀,室温避光5 min,然后1 000 r/min离心5 min,弃上清液;加入PBS 2 mL,再1 000 r/min离心5 min,弃上清液;加入PBS 300 μL混匀。应用BD FACSCalibur流式细胞分析仪上机检测。应用CellQuest软件,分别以FSC/SSC给细胞设门,获取门内10 000个细胞/每管,分析CCR3表达水平。
1.8 统计学处理
2 结果
2.1 治疗前后患者SCORAD、VAS分值变化
治疗过程中无脱落病例。治疗后患者的SCORAD及VAS分值均较治疗前明显下降,差异有统计学意义(P值均<0.01)。详见表1。
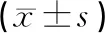
表1 AD患者治疗前后SCORAD、VAS分值比较Tab.1 Comparison of SCORAD and VAS prior to and after treatment among the
2.2 AD患者eotaxin水平及PBMC中CCR3表达水平比较
患者血清eotaxin水平治疗后明显下降,与治疗前比较,差异有统计学意义(t=3.20,P<0.01)。治疗后患者PBMC产生的CCR3表达水平亦明显低于治疗前,差异有统计学意义(t=3.59,P<0.01)。详见表2。

表2 AD患者治疗前后PBMC产生eotaxin水平及CCR3表达的比较Tab.2 Comparison of the expression levels of eotaxin and CCR3 prior to and after treatment among the
3 讨论
目前大量研究证实,嗜酸性粒细胞是特应性皮炎发病机制中的一个关键效应细胞,迟发相变态反应的持续因子。嗜酸性粒细胞在局部皮损中的浸润与CC型趋化因子有密切的关系。趋化性细胞因子与靶细胞上相应趋化因子受体特异性结合是各种免疫细胞完成炎症反应中的组织定位、浸润、再循环和归巢等效应的分子基础[3]。
eotaxin是 CC 型化学趋化因子家族的成员,一种嗜酸性粒细胞(Eos)选择性的β-趋化剂,正在成为治疗过敏性疾病的重要标靶。eotaxin 趋化嗜酸性粒细胞到反应部位并促使它们分泌大量的毒性成分: 嗜酸性粒细胞阳离子蛋白、 嗜酸性粒细胞衍生的神经、嗜酸性粒细胞碱性蛋白和嗜酸性粒细胞过氧化物酶,这些物质可引起皮肤的组织损伤和瘙痒,从而表现为特应性皮炎的一系列临床症状。 体内外的实验均证实, 在抗原刺激下, 组胺可以增强内皮细胞表面eotaxin的表达,并且可以提高嗜酸性粒细胞的黏附能力以及从微血管中迁移至组织的能力[4]。体外实验亦证实,嗜酸性粒细胞可迁移和通过重组的人型血管内皮黏附分子-1 预先涂铺过的滤纸,而eotaxin能明显增强嗜酸性粒细胞的这种迁移能力[5]。有学者发现eotaxin可以引起局部嗜酸性粒细胞的增多,而且呈时间和剂量的依赖性,同时伴随肥大细胞脱颗粒的加强和组胺释放的增加[6-7]。选择性的CCR3拮抗剂的应用可明显抑制eotaxin 所致的嗜酸性粒细胞的趋化募集,而更为重要的一点是,迟发相变态反应中的嗜酸性粒细胞的募集也同样得到了抑制[8-9]。而国内胡南等[10]已经证实eotaxin在AD患者外周血表达增强。
NB-UVB 照射通过抑制嗜酸性粒细胞在细胞趋化与活化抑制细胞因子合成而起到治疗特应性皮炎作用,治疗成人及儿童AD 患者具有疗效好、安全、光毒反应轻且不增加光照后皮肤癌发生率等优点,是中、重度AD 的一线光疗法[11]。Dayal等[12]在一项NB-UVB治疗的长期安全性的研究中,对30例4~14岁的儿童AD患者采用NB-UVB治疗,每周2次,很多患儿在第6次照射时SCORAD和VAS分值明显下降,第24次治疗后分值下降更为明显,在停止照射后的第2年上述分值仍维持较低水平,未见反复及不良反应,取得了良好的疗效。
外用钙调磷酸酶抑制剂 (topical calcineurin inhibitors,TCIS)包括他克莫司和吡美莫司,其唯一被批准使用的适应症是AD。吡美莫司(pimecrolimus)是由链霉菌Streptomyceshygroscopicusvarascomycetes产生的子囊霉素巨内酰胺的衍生物,其外用制剂为 1%乳膏。吡美莫司选择性地抑制前炎症细胞因子的产生和释放,与FKBP-12有高亲和性,在基因转录水平阻断淋巴细胞的细胞因子合成,下调 Th1(IL-2、INF-γ)以及Th2 (IL-4/IL-5/IL-10)的合成;研究证实吡美莫司可选择性作用于皮肤的肥大细胞以及T淋巴细胞,但不影响成纤维细胞、角质形成细胞及内皮细胞系,不诱导细胞凋亡,且经皮肤吸收少,具有较强抗炎活性,但不具有糖皮质激素的副作用[13-16]。大量短期临床研究均已证实吡美莫司外用治疗成人和儿童AD安全有效[17],大规模长期临床观察以及药代动力学研究也进一步证实了 TCIs 的临床有效性和安全性[18]。
大量文献证实窄谱中波紫外线或吡美莫司乳膏治疗AD的疗效较佳,但具体作用机制不明,以往的文献也已证实正常人外周血血清中eotaxin水平远低于AD组[19-21]。目前国内外就窄谱中波紫外线联合吡美莫司乳膏治疗成人型AD的疗效较少。本研究结果显示,窄谱中波紫外线联合吡美莫司乳膏治疗成人型AD患者后,SCORAD和VAS评分明显降低,且PBMC产生的eotaxin含量及受体CCR3明显下降,提示联合治疗可能通过降低eotaxin和CCR3表达,从而减少嗜酸性粒细胞的募集和活化,并进一步减少炎性介质和毒性蛋白的释放,达到减轻特应性皮炎患者组织损伤和皮肤瘙痒的目的。
综上所述,窄谱中波紫外线联合吡美莫司乳膏治疗成人型AD安全、有效,作用可能是通过降低eotaxin和CCR3的表达这一途径来实现,但本研究样本量较小,需在下一步行大样本研究证实,以供临床医生参考。

