血清25-羟维生素D3水平与婴儿特应性皮炎严重度的相关性研究
阮富旺,杨万勇,陈波,陈小珑,刘伟畴,张志斌
(1.东莞光华医院医学检验中心,广东 东莞523416;2.东莞市人民医院检验科,广东 东莞523059)
特应性皮炎以多形皮疹、瘙痒、渗出等为主要临床表现。多数患者在婴儿时期即首次发病,且病情反复难愈,严重影响生活质量。环境因素、遗传因素、免疫紊乱等均与本病的发病和病情变化密切相关[1]。临床研究显示,Th1/Th2表达失衡是特应性皮炎发病的重要机制,调节Th1/Th2的平衡有利于改善特应性皮炎的病情[2]。维生素D是临床常用的一种脂溶性维生素,不仅具有维持钙磷平衡和调控脂代谢的作用,还在宿主的免疫应答过程中起重要作用[3]。维生素D及其受体可调节Th1/Th2介导的免疫反应,25-羟维生素D3(25-(OH)D3)是维生素D在体内的主要存在形式,25-(OH)D3为重要的免疫调节剂,25-(OH)D3的缺乏与Th1/Th2免疫应答失衡直接相关[3,4]。目前,有关25-(OH)D3与特应性皮炎发病及其病情严重程度相关性的关系仍存在一定的争议。本研究探讨血清25-(OH)D3水平与婴儿特应性皮炎严重度的相关性,以进一步探究25-(OH)D3与特应性皮炎的关系,报告如下。
1 资料与方法
1.1 一般资料 选取自2017年1月到2018年12月的特应性皮炎患儿160例为研究对象,其中,男114例,女46例,患儿月龄1~24个月,平均月龄为14.18 ±6.68个月,轻度特应性皮炎组54例,中度特应性皮炎54例,重度特应性皮炎52例。本研究经过所有婴儿家长的知情同意,并报医院伦理委员会批准后实施。
1.2 纳入和排除标准 参照《中国特应性皮炎诊断和治疗指南》[5]的诊断标准明确诊断。所有患儿均为1~24月龄,根据患儿的皮损位置和特点、哮喘或者过敏性鼻炎病史等资料,明确特应性皮炎的临床诊断。同时排除合并除哮喘或者过敏性鼻炎之外的其他慢性全身性疾病的患儿、25-(OH)D3缺乏症等影响本研究检测结果的患儿;排除已经接受光疗等全身治疗或者近期服用糖皮质激素的患儿。
1.3 研究方法 所有患儿均入院后第1天采集外周静脉血行血清25-(OH)D3、嗜酸性粒细胞比例的检测。血清25-(OH)D3的检测方法为量子点荧光免疫层析法,试剂盒购自美康基因科学公司;嗜酸性粒细胞的检测采用日本SYSMEX XN-550全自动血液分析仪。结果判读标准:25-(OH)D3缺乏:25-(OH)D3<25nmol/L,25-(OH)D3不足:25 nmol/L≤25-(OH)D3<50nmol/L,25-(OH)D3充足:25-(OH)D3≥50nmol/L[6]。同时由调查员通过询问患儿家长,采集患儿的性别、年龄、病程、喂养方式(母乳喂养、人工喂养、混合喂养)、是否补充25-(OH)D3、皮损的渗出情况、SCORAD评分[7]等。
1.4 观察指标 分析特应性皮炎患儿的血清25-(OH)D3、嗜酸性粒细胞比例的检测结果。对比轻中度特应性皮炎患儿和重度特应性皮炎患儿的血清25-(OH)D3、嗜酸性粒细胞比例水平。通过多因素Logistic回归分析特应性皮炎患儿25-(OH)D3缺乏的危险因素。通过Pearson相关分析特应性皮炎患儿血清25-(OH)D3与SCORAD评分、嗜酸性粒细胞比例的相关性。
1.5 统计学分析 采用SPSS 17.0进行分析,计量资料采用均数±标准差(±s)表示,对比采用t检验或方差分析,计数资料的对比采用χ2检验,危险因素分析采用多因素Logistic回归分析,相关性分析采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 特应性皮炎患儿25-(OH)D3、IgE、嗜酸性粒细胞水平调查结果分析 患儿就诊前曾补充25-(O H)D3的有91例(56.87%),未补充的有69例(43.13%)。25-(OH)D3缺乏或者不足的有62例(38.75%),嗜酸性粒细胞比例升高的有73例(45.62%),见表1。
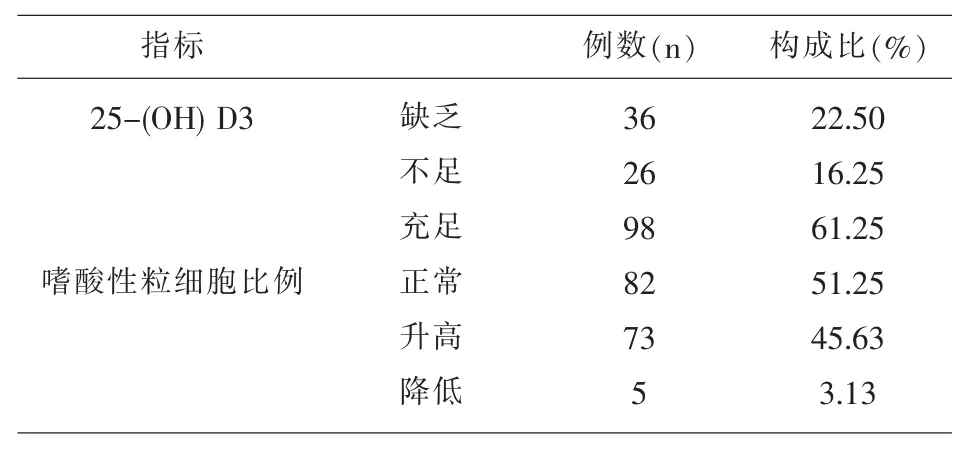
表1 特应性皮炎患儿25-(OH)D3、嗜酸性粒细胞水平构成分析
2.2 轻中度和重度特应性皮炎患儿25-(OH)D3、嗜酸性粒细胞水平的对比 重度特应性皮炎患儿平均月龄为10.01±6.64个月,25-(OH)D3为46.46±18.91nmol/L,显著低于轻、中度特应性皮炎患儿,而嗜酸性粒细胞比例为0.125±0.039,显著高于轻、中度特应性皮炎患儿(P<0.05),见表2。
表2 轻中度和重度特应性皮炎患儿25-(OH)D3、嗜酸性粒细胞水平的对比(±s)

表2 轻中度和重度特应性皮炎患儿25-(OH)D3、嗜酸性粒细胞水平的对比(±s)
注:和重度特应性皮炎对比,aP<0.05
组别 例数(n)轻度特应性皮炎中度特应性皮炎重度特应性皮炎54 54 52月龄(月) 25-(OH)D3(nmol/L)16.45±6.28a 13.82±6.87a 10.01±6.64 81.33±16.24a 64.92±15.85a 46.46±18.91嗜酸性粒细胞比例0.036±0.018a 0.059±0.027a 0.125±0.039
2.3 影响特应性皮炎患儿25-(OH)D3缺乏的危险因素分析 喂养方式为特应性皮炎患儿25-(OH)D3缺乏的危险因素,其中,母乳喂养患儿发生25-(OH)D3缺乏的风险显著高于人工喂养患儿(P<0.05);补充25-(OH)D3是特应性皮炎患儿25-(OH)D3缺乏的保护性因素(P<0.05),见表3。
2.4 25-(OH)D3与SCORAD评分、嗜酸性粒细胞比例的相关性分析 特应性皮炎患儿血清25-(OH)D3与SCORAD评分、嗜酸性粒细胞比例均呈负相关关系(r=-0.371、-0.342,P<0.05)。
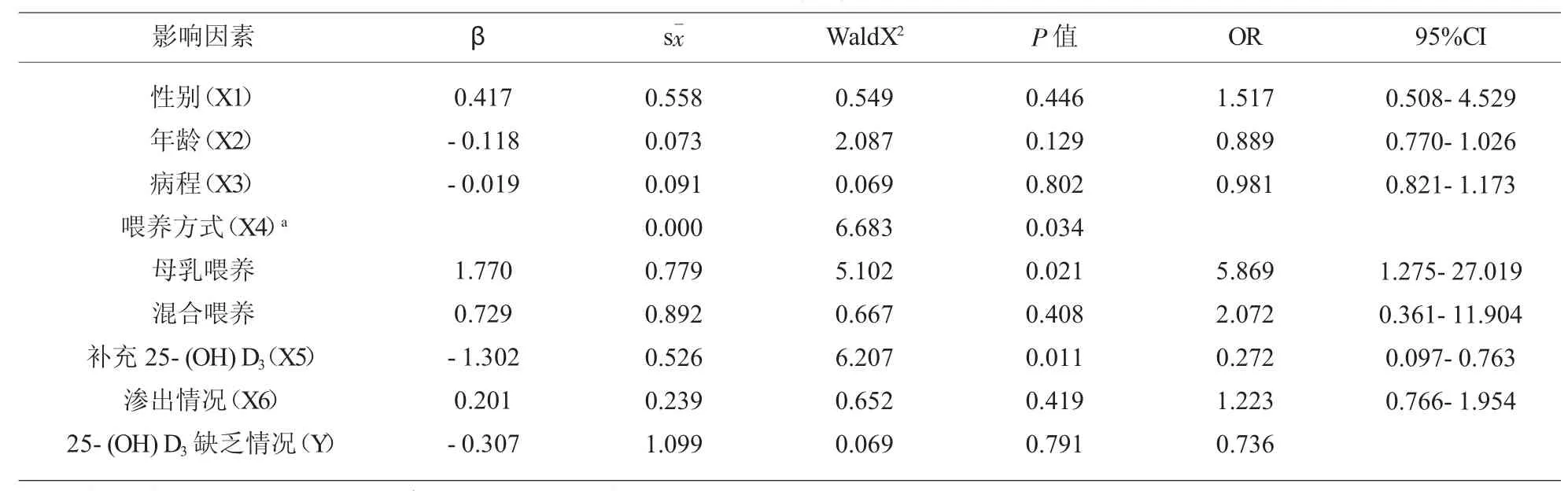
表3 影响特应性皮炎患儿25-(OH)D3缺乏的危险因素分析
3 讨论
临床调查显示,特应性皮炎患者的25-(OH)D3水平显著低于健康人群,且病情越重,25-(OH)D3降低越明显[8]。由此推测,25-(OH)D3缺乏与特应性皮炎的发病相关。然而,也有相关研究认为特应性皮炎病情的严重程度与25-(OH)D3的水平没有显著的相关性[9]。另外有研究认为,遗传的差异导致了上述有关25-(OH)D3与特应性皮炎的相关性研究结论的差异[10]。在本研究中,重度特应性皮炎患儿的血清25-(OH)D3水平显著低于轻、中度特应性皮炎患儿,同时,患儿25-(OH)D3水平与SCORAD评分呈负相关关系,因此,25-(OH)D3水平的高低可能与特应性皮炎的严重程度存在一定的联系。
25-(OH)D3可增强机体抵御病原微生物的能力,同时还可调节机体免疫应答过程中的炎症因子的表达[11]。临床研究显示,25-(OH)D3可抑制特应性皮炎急性发作期过程中IL-4等Th2相关炎症细胞因子的表达,从而减轻炎症反应,而在特应性皮炎慢性期,则可抑制INF-γ等Th1相关炎症细胞因子的表达和Th1细胞的增殖,改善患者的临床症状[12]。研究表明[13-15],特应性皮炎患者25-(OH)D3缺乏或不足的比例显著升高,且特应性皮炎的严重程度与25-(OH)D3的水平密切相关。在本研究中,38.16%的患儿存在25-(OH)D3缺乏或者不足的情况。喂养方式为特应性皮炎患儿25-(OH)D3缺乏的危险因素,且母乳喂养患儿发生25-(OH)D3缺乏的风险显著高于人工喂养患儿。这提示在母乳喂养阶段,母亲应加强补充25-(OH)D3,避免25-(OH)D3缺乏,作为早期预防婴儿特应性皮炎的措施之一。本研究结果表明,补充25-(OH)D3是婴儿特应性皮炎25-(OH)D3缺乏的保护性因素。先关研究显示[16],婴儿特应性皮炎有妊娠晚期孕妇25-(OH)D3缺乏关系密切,加强补充孕妇与婴儿25-(OH)D3对有助于防治婴儿特应性皮炎。
本研究结果也显示,重度特应性皮炎患儿嗜酸性粒细胞比例显著高于中度特应性皮炎患儿。相关研究显示,25-(OH)D3可使嗜酸性粒细胞上趋化因子受体4的表达上调,因而起到防治过敏性疾病的作用[17-19]。本研究结果显示,嗜酸性粒细胞比例与25-(OH)D3水平呈负相关关系,这提示25-(OH)D3对特应性皮炎的防治作用可能与其对嗜酸性粒细胞功能的影响有关。
综上所述,血清25-(OH)D3水平降低与婴儿特应性皮炎的严重程度相关,临床应重视患儿血清25-(OH)D3水平的检测并积极防治25-(OH)D3缺乏以提高婴儿特应性皮炎的防治效果。

