肥胖症儿童临床相关因素
李 超,宋文惠
(1.山西医科大学 儿科医学系,山西 太原 030001;2.山西省儿童医院 内分泌遗传代谢科,山西 太原 030001)
肥胖症是多种因素相互作用所造成的体内脂肪堆积过多和(或)分布异常、体重增加。肥胖症增加了代谢紊乱的风险,影响儿童健康,成为儿童糖尿病、血脂紊乱、高血压、非酒精性脂肪肝(NAFLD)等并发症的危险因素[1]。本文通过对103例肥胖症儿童血脂、空腹血糖、餐后2 h血糖、空腹胰岛素、肝功能,肝脏彩超等数据分析研究,探讨肥胖症儿童相关并发症高血压、NAFLD、糖代谢异常、血脂紊乱的发生情况,以帮助早期识别和干预。
1 资料与方法
1.1一般资料 将103例肥胖症儿童分为轻度肥胖、中度肥胖、重度肥胖。 肥胖症诊断标准是参照诸福棠《实用儿科学》[2]与同性别同年龄健康儿童相比,凡超过身高标准体质量的20%者为肥胖, 超过20%~30%为轻度肥胖,超过30%~50%为中度肥胖,超过50%为重度肥胖,排除与内分泌、遗传、代谢等疾病有关的肥胖。103例肥胖症儿童中男65例、女38例。年龄(10.3±2.2)岁。轻度肥胖30例, 中度肥胖39例, 重度肥胖34例。见表1。
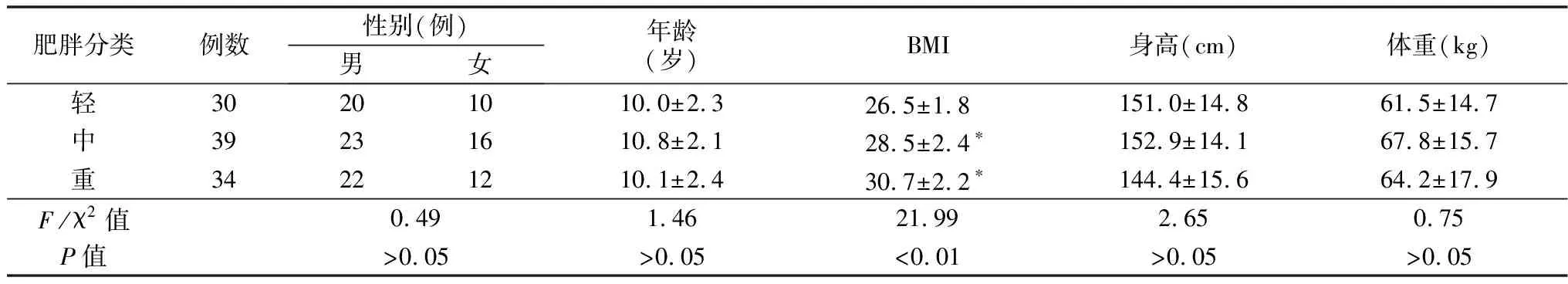
表1 103例肥胖症儿童一 般 资 料
注:与轻度比较,*P<0.05
1.2方法 体检资料 清晨排空大小便,脱鞋帽,穿单衣,测量身高(cm)、体重(kg),连续测量3次取其均值;体重指数:BMI= 体重/身高的平方(kg/m2);取坐位由专人以欧姆龙电子血压计测量右臂肱动脉血压,每次间隔2 min,连测3次取其平均值。生化指标采取前日晚清淡饮食,空腹8~12小时后于次日测口服葡萄糖耐量试验(OGTT),甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、肝功能、空腹胰岛素等。
1.3诊断标准
1.3.1高血压、收缩压(SBP)和(或)舒张压(DBP)在同年龄、同性别第95百分位以上[2]。
1.3.2血脂紊乱 空腹TG≥1.7 mmol/L和(或)HDL-C<1.0 mmol/L和(或)LDL-C≥3.36 mmol/L和(或)TC≥5.2 mmol/L[2]。
1.3.3糖耐量减低(IGT)和2型糖尿病(T2DM )诊断标准 IGT指空腹血糖(FPG)5.6~6.9 mmol/L,餐后2 h血糖(PBG)7.8~11.1 mmol/L;T2DM指空腹血糖≥7.0 mmol/L,餐后2 h血糖(PBG)≥11.1 mmol/L[2]。
1.3.4非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD )诊断标准 参考《非酒精性脂肪性肝病诊断标准》[3]具备下列第(1)项加其余任一项者可诊断为脂肪肝:(1)肝区近场弥漫性点状高回声,回声强度高于脾脏和肾脏,少数表现为灶性高回声。(2)远场回声衰减,光点稀疏。(3)肝内管道结构显示不清。(4)肝脏轻度或中度大,肝前缘变钝。排除长期饮酒、病毒性肝炎、肝硬化、胆管梗阻、药物性肝病和自身免疫性肝炎等所致的脂肪肝。丙氨酸转氨酶(ALT)>40 U/L异常[2]。
1.3.5胰岛素抵抗(IR) 按照HOMA-IR公式计算,HMOA-IR=FPG(空腹血糖)×FINS(空腹胰岛素)/22.5。

2 结 果
2.1血脂比较 3组肥胖儿童间TG、TC、HDL-C、LDL-C差异有统计学意义(P<0.05)。且重度肥胖组与中度肥胖组及轻度肥胖组相比TG、TC、HDL-C 、LDL-C差异有统计学意义(P<0.05)。中度肥胖组与轻度肥胖组相比TG、TC、LDL-C、HDL-C差异有统计学意义(P<0.05)。表现为非高密度脂蛋白胆固醇(TG、TC、LDL-C)随体重增加有所上升,而HDL-C有所降低。 见表2。
2.2血糖、HMOA-IR及ALT比较 3组肥胖儿童间FPG、PBG、ALT差异无统计学意义(P>0.05)。表明不同肥胖组之间的FPG、PBG、ALT波动不大,可能与样本量少有关。3组间HMOA-IR差异有统计学意义(P<0.05)。见表2。
2.3血压比较 3组儿童间DBP和SBP差异有统计学意义(P<0.05)。且重度肥胖组与中度肥胖组及轻度肥胖组比较DBP及SBP差异有统计学意义(P<0.05)。见表2。
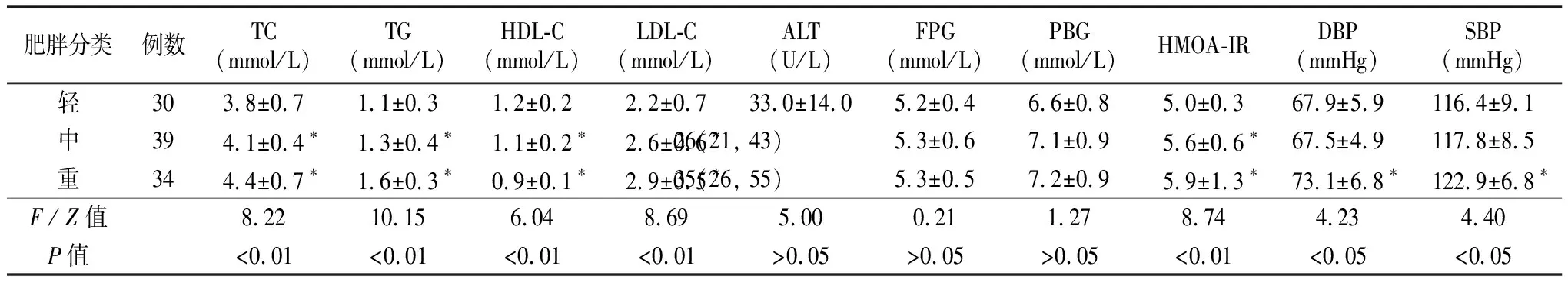
表2 3组各项指标测量结果
注: 与轻度比较,*P<0.05;总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、丙氨酸转氨酶(ALT)、空腹血糖(FPG)、餐后2 h血糖(PBG)、胰岛素抵抗指数(HMOA-IR)、舒张压(DBP)、收缩压(SBP)
2.4肥胖症儿童并发症 本次研究的103例肥胖症儿童其中并发高血压19例(18.4%);血脂紊乱36例(35.0%);糖代谢异常18例(17.5%),其中2型糖尿病 (T2DM )2例(1.9%),该T2DM患儿为中、重度肥胖症者。并发NAFLD 24例(23.3%),其中有肝功能异常14例(13.6%)。本次调查发现3组肥胖儿童并发血脂紊乱的人数差异有统计学意义(P<0.05),而并发糖代谢异常、NAFLD及高血压的人数差异无统计学意义(P>0.05)。见表3。
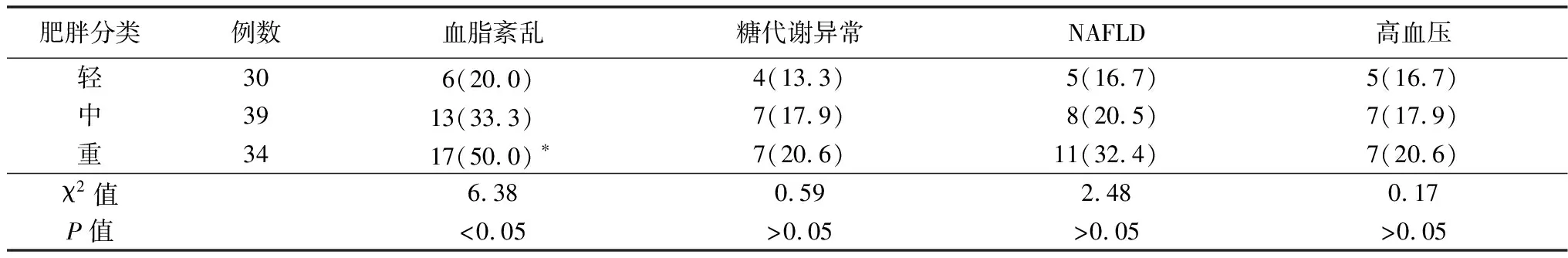
表3 肥胖症儿童并发症发病情况[例(%)]
注:与轻度比较,*P<0.05
3 讨 论
3.1儿童肥胖症是与生活方式密切相关, 是以过度营养、运动不足、行为异常为特征的全身脂肪组织过度增生的一种慢性疾病。随着经济水平的提高和生活方式的改善,儿童肥胖的发生率逐渐增高,且肥胖程度与年龄有一定的相关性[4]。本研究发现肥胖儿童的平均年龄10.3岁,表明肥胖症好发于学龄期和青春发育期,因此该时期的儿童应积极预防肥胖症的发生[4]。
3.2肥胖与糖代谢异常 儿童时期脂肪量的增加可以引起胰岛素抵抗(IR),从而增加患糖尿病的风险[5]。本研究发现并发糖代谢异常18例(17.5%),其中2型糖尿病2例(1.9%)。提示肥胖儿童的糖代谢异常是以糖耐量低减(IGT)为主。3组肥胖儿童之间空腹血糖及餐后2 h血糖之间差异无统计学意义(P>0.05),可能与样本量少有关。而胰岛素抵抗指数差异有统计学意义(P<0.05)。本研究与Hagman等[6]研究一致。患儿胰岛素抵抗指数升高, 提示胰岛素敏感性下降, 存在胰岛素抵抗。胰岛素抵抗被认为是糖代谢障碍的初期[7]。肥胖是导致IR形成的关键因素,随着胰岛素分泌相对的下降,血糖浓度和游离脂肪酸水平升高促使β细胞功能下降。通过对β细胞的糖毒和脂毒作用加剧了病变的进展[8]。因此,肥胖儿童要定期检测血清胰岛素,及早采取措施预防糖尿病的发生。
3.3肥胖与血脂紊乱 肥胖症易导致脂代谢紊乱。本研究发现并发血脂紊乱的人数为36例, 提示肥胖易引起儿童血脂异常。3组间TC、TG、LDL-C、HDL-C差异有统计学意义,表现为TC、TG、LDL-C的升高和HDL-C的降低,预示发生动脉粥样硬化的概率增加。研究发现LDL-C是动脉粥样硬化重要的危险因素,巨噬细胞吞噬LDL-C形成泡沫细胞,泡沫细胞引起血管内皮损伤最终引起动脉硬化。而HDL-C有相反的作用能通ATP结合盒转运蛋白A1(ABCA1)清除泡沫细胞中的胆固醇[9]。HDL-C每增加0.06 mmol/L,动脉粥样硬化的风险降低2%~3%。HDL-C的保护作用在于逆向转运胆固醇及防止LDL-C氧化[10]。所以肥胖不仅增加了动脉粥样硬化的危险,而且损伤了其防御功能。
3.4肥胖与高血压 本研究发现并发高血压19例(18.4%), 3组间血压值差异有统计学意义。重度肥组胖儿童高血压发生率最高, 中度肥胖组次之, 轻度肥胖组儿童最低。且随着体重的增加SBP与DBP呈现上升趋势。已有研究指出儿童体重每增加10 kg,其收缩压升高2.3~3 mmHg,舒张压升高0.8~3 mmHg,高血压的发生率是正常体重儿童的34倍[11]。研究发现, 减肥后SBP与DBP可恢复正常, 且大多数血压较肥胖恢复正常早[12]。提示肥胖对收缩压、舒张压均有影响, 且在儿童时期已经开始,减轻体重是降低高血压发生率的重要措施。
3.5肥胖与NAFLD NAFLD是儿童中最常见的慢性肝病,肥胖是NAFLD的最大危险因素。肝脏中游离脂肪酸可损害肝细胞膜、线粒体和溶酶体膜等,引起肝细胞脂肪变性、坏死甚至出现纤维化等改变[13]。本研究发现并发NAFLD24例(23.3%),其中有肝功能异常14例(13.6%),该14例肥胖患儿主要表现为ALT增高。表明肥胖儿童非酒性脂肪肝病易引起肝功能损害。研究推荐ALT作为NAFLD的筛查,在超重和肥胖儿童中ALT大于同性别正常上限(男孩ALT>50 U/L,女孩>44 U/L)的2倍,对NAFLD诊断的敏感性为88%,特异性为26%[14]。患有NAFLD 的肥胖儿童要密切监测肝功能(ALT),对肝功能明显异常者及时予药物干预,以防对肝细胞进一步损伤。
综上所述,儿童肥胖症会引起血糖、血脂指标异常、胰岛素抵抗等现象,使儿童患高血压、NAFLD及糖尿病等疾病的风险增加。对儿童的生长发育产生严重的不利影响。肥胖症儿童要采取饮食控制、加强体育锻炼等干预措施,同时要定期体检,以此调节其各项指标的水平,降低由肥胖导致的各种并发症的发生率。

