罗非鱼不同养殖阶段喹诺酮类耐药菌群数量与组成分析
吴甘林 邓玉婷 张瑞泉 谭爱萍 赵飞 姜兰
摘要:【目的】評估不同养殖阶段罗非鱼肠道及养殖环境中喹诺酮类耐药菌产生的风险,筛选出水产养殖耐药性监测指示菌,为建立科学的水产品耐药防控技术提供参考依据。【方法】选取萘啶酸(第一代)和恩诺沙星(第三代)2种喹诺酮类药物,通过平板计数法统计不同养殖阶段(苗种阶段、中间阶段及上市阶段)罗非鱼肠道及养殖环境(池塘水和底泥)中喹诺酮类耐药菌的数量及耐药率,然后采用高通量测序分析不同养殖阶段喹诺酮类耐药菌群的结构特征及组成变化。【结果】在不同养殖阶段罗非鱼肠道及其养殖环境中的细菌总数相对稳定,罗非鱼肠道的细菌总数维持在4.6×105~1.6×106 CFU/g,池塘水的细菌总数维持在5.2×103~2.1×104 CFU/g,池塘底泥的细菌总数维持在4.8×103~3.2×104 CFU/g。苗种阶段罗非鱼肠道菌群对萘啶酸和恩诺沙星的耐药率均高于中间阶段和上市阶段,分别为34.7%和19.0%。各养殖阶段的罗非鱼肠道及养殖环境优势菌群均以气单胞菌属、埃希菌—志贺氏菌属、鲸杆菌属、邻单胞菌属、芽孢杆菌属和肠杆菌属细菌为主。随着养殖阶段的推移,罗非鱼肠道中的气单胞菌属相对丰度呈下降趋势,而鲸杆菌属呈上升趋势;而养殖环境中的菌群结构无明显规律性变化。在罗非鱼肠道及养殖环境喹诺酮类耐药菌群中,埃希菌—志贺氏菌属和气单胞菌属的相对丰度较高,且随着养殖阶段的推移呈不同程度上升趋势。【结论】罗非鱼养殖的耐药风险主要集中在养殖前期阶段,埃希菌属和气单胞菌属是喹诺酮类耐药的主要菌群,应加强不同养殖阶段的饲养管理,减少病害发生以减轻抗菌药物使用带来的风险。此外,可选用埃希菌属和气单胞菌属作为水产养殖细菌耐药性监测的指示菌,实时监控喹诺酮类药物耐药性的产生与传播。
关键词: 罗非鱼;肠道;养殖环境;喹诺酮类药物;耐药菌群
中图分类号: S965.125 文献标志码: A 文章编号:2095-1191(2020)12-3073-10
Abstract:【Objective】In order to evaluate the bacterial resistance risk to quinolones in tilapia intestine and its culture envrionment, and find out the bacterial indicator of antimicrobial resistance surveillance, which could provide reference for the establishment of scientific prevention and control technology of aquatic product drug resistance. 【Method】Two quinolones of nalidixic acid (first generation) and enrofloxacin (third generation) were selected. The number and resistance rate of quinolones resistant bacteria in intestinal tract and culture environment (pond water and sediment) of tilapia were calculated by plate counting method, then high throughput sequencing was used to analyze the structural characteristics and composition of quinolones resistant flora in different breeding stages. 【Result】The results showed that total viable counts of bacteria in the tilapia intestine and the culture environment was comparatively stable at different breeding stages. The total number of bacteria in tilapia intestine, pond water and sediment maintained at 4.6×105-1.6×106 CFU/g, 5.2×103-2.1×104 CFU/g and 4.8×103-3.2×104 CFU/g, respectively. The resistance rates of fish intestinal bacteria to nalidixic acid and enrofloxacin at the fingerling stage were higher than other two stages, reaching 34.7% and 19.0%, respectively. The dominant flora of tilapia intestines and culture environment at each breeding stage were Aeromonas, Escherichia-Shige-lla, Cetobacterium, Plesiomonas, Bacillus and Enterobacter. As breeding time progressed, the flora of tilapia intestine was observed that the relative abundance of Aeromonas was decreased, while the relative abundance of Cetobacterium was increased. There was no obvious regular change in the structure of the bacterial community in the culture environment. Among the quinolone-resistant flora of tilapia intestines and culture environment, the relative abundance of Escherichia-Shigella and Aeromonas was relatively high, and increased in varying degrees with the pass of the breeding stage.【Conclusion】In conclusion, high risk of quinolones resistance is observed in tilapia intestine and aquatic environment at the fingerlings stage. Escherichia and Aeromonas are the dominant flora of quinolone resistance. It is necessary to strengthen the feeding management of different breeding stages and reduce the occurrence of diseases to reduce the risk of antimicrobial use. Escherichia and Aeromonas should be as indicator bacteria of antimiorcobial resistance in aquaculture, to monitor drug resistance occurrence and transmission of quinolones.
Key words: tilapia; intestine; aquaculture environment; quinolone; drug resistance microbiota
Foundation item:National Key Research and Development Program of China(2017YFC1600704); Construction Project of Modern Agricultural Industry Technology System(CARS-46); Central Public-interest Scientific Institution Basal Research Fund of Chinese Academy of Fishery Sciences(2018SJ-YB04)
0 引言
【研究意义】随着水产养殖业规模化和集约化程度的不断提高,水产养殖动物各种病害的发生与流行日趋严重,为减轻水产病害发生造成的损失,养殖过程不可避免地使用抗菌药物(Kümmerer,2009)。但与发达国家相比,我国养殖业抗菌药物的使用管理仍不规范,在养殖过程中不科学合理使用抗菌药物的现象时有发生;且抗菌药物的不合理使用极易导致耐药细菌增加,其中又以喹诺酮类药物的耐药问题最严重(Hao et al.,2015;Liu et al.,2017)。细菌对抗菌药物产生耐药性已成为全球严峻的公共卫生问题,世界卫生组织将其列为未来几十年人类健康的三大威胁之一(McEwen and Collignon,2018)。在水产养殖生态系统中,耐药菌群数量越多,其携带的耐药基因传递给耐药致病菌的可能性越大,同时可能会通过水产动物源食品及环境污染等进入食物链,而对人体健康产生威胁(McEwen and Collignon,2018)。因此,在耐药致病菌出现或广泛传播前,了解水产养殖各环节的耐药风险,并制定相应的预警和防控措施,对确保水产品质量安全具有重要意义。【前人研究进展】罗非鱼因其繁殖能力强、生长速度快、抗逆性强、肉质鲜美及骨刺少等特点,已发展成为全球性的水产养殖品种,也是我国出口量较大的水产养殖品种之一(叶富良,2004;代云云等,2016)。在罗非鱼养殖过程中,以链球菌(Streptococcus)和气单胞菌(Aeromonas)等病原菌引起的细菌性疾病最常见,且危害较大(黄钧等,2012;Deng et al.,2014;黎铭等,2019;谢云丹等,2019)。水产养殖动物体内及其养殖环境中含有丰富的微生物和遗传物质资源,养殖过程中若大量投喂抗菌药物,在抗菌药物的压力下其正常菌群可能因自身基因改变或捕获外源耐药基因等而对抗菌药物产生耐药性,并通过耐药元件如质粒、整合子及插入序列等将耐药基因传递给致病菌(Zhang et al.,2011;Liu et al.,2017)。喹诺酮类药物是水产养殖中治疗细菌性疾病最常用的抗菌药物之一。萘啶酸是第一代最早开发的喹诺酮类药物,但抗菌谱窄且易产生耐药性;第三代药物(氟喹诺酮类)在喹诺酮母核引入氟原子后有效增强了抗菌活性,恩诺沙星即为第三代动物专用代表药物(王瑞旋和陈毕生,2007)。不同代的喹诺酮类药物因分子结构不同,细菌对其产生耐药性的机制也存在明显差异。吕小丽等(2017)在检测罗非鱼链球菌对不同喹诺酮类药物的耐药性时发现,依诺沙星的耐药率最高(80%),诺氟沙星的耐药率也达40%,而环丙沙星、氧氟沙星和左氟沙星的耐药率均低于10%。随着喹诺酮类药物在水产养殖上的推广应用,喹诺酮类耐药性也不断增强(王瑞旋和陈毕生,2007;Hao et al.,2015;Liu et al.,2017)。已有研究证实,罗非鱼嗜水气单胞菌(A. hydrophila)对诺氟沙星、环丙沙星和氧氟沙星等常见喹诺酮类药物的耐药率均高于39%(林居纯等,2009;丁正峰等,2011)。【本研究切入点】目前,国内外对水产养殖环境或水产品的细菌耐药性研究多限于某一种属的菌株,其结果对反映鱼体内或养殖环境中细菌的耐药情况存在片面性(袁伟,2017;Lee and Wendy,2017;郭学中等,2018),且鲜见针对水产养殖环节的耐药风险进行评估。本课题组前期研究发现分离自同一样品不同科属细菌的耐药表型及耐药基因分布差异显著(郭学中等,2018),但耐药菌株在动物体内和环境介质中的传播机制尚未明确。【拟解决的关键问题】选取萘啶酸(第一代)和恩诺沙星(第三代)2种喹诺酮类药物,通过平板计数法了解不同养殖阶段罗非鱼肠道及养殖环境中喹诺酮类耐藥菌的产生比例,评估不同养殖阶段的耐药风险;同时分析喹诺酮类耐药菌群组成,筛选出水产养殖耐药监测指示菌,以期为建立科学的水产品耐药防控技术提供参考依据。
1 材料与方法
1. 1 含药培养基配制
根据美国国家临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)针对萘啶酸和恩诺沙星的药物敏感性判定标准,选取这2种药物的耐药值作为耐药菌的筛选浓度。分别配制含萘啶酸(终浓度128 μg/mL)和恩诺沙星(终浓度4 μg/mL)的平板计数琼脂琼脂培养基(PCA)、胰蛋白胨大豆琼脂培养基(TSA)及不含药物的PCA培养基和TSA培养基。
1. 2 样品采集
选定广东省阳春市的3个罗非鱼养殖场,分别于2018年6、8和10月进行样品采集,每个养殖场均采集罗非鱼、池塘水和池塘底泥等样品。不同养殖阶段的罗非鱼各取5~10尾,体重分别为:苗种阶段24.6±3.0 g/尾,中间阶段242.72±76.8 g/尾,上市阶段809.1±72.7 g/尾。每个池塘选取3个采水点,用采水器采集鱼塘表面下10~15 cm的水体1 L,相同采水点位置各采集池塘底泥50 g。
1. 3 样品处理
罗非鱼样品处理:将采集的罗非鱼先进行体重及体长测量,然后以75%酒精擦拭鱼体体表并置于超净工作台上。用无菌剪刀自肛门处沿腹部剪至嘴部,取出肠道置于干净解剖盘中,去除肠道外围脂肪及血液等,以无菌剪刀剪下全部肠道。将同一养殖场的罗非鱼肠道样品混合,剪碎研磨,肠道样品称重后按肠与水1∶5的比例加入无菌生理盐水,置于装有玻璃珠的三角烧瓶中,在振荡器中以160 r/min的速度振荡30 min后静置30 min,取上清液,4 ℃保存备用。水样处理:同一养殖场不同采样点的水样各取500 mL混合,4 ℃保存备用。池塘底泥样品处理:同一养殖场的底泥样品各称取20 g,混合后置于装有玻璃珠的三角烧瓶中,按泥与水1∶5的比例加入无菌生理盐水,在振荡器中以160 r/min的速度振荡30 min再静置30 min,取上清液,4 ℃保存备用。
1. 4 细菌培养计数
取预处理样品,用无菌生理盐水按10倍系列稀释为5个梯度,然后从5个梯度稀释液中各取1.0 mL接种于含萘啶酸或恩诺沙星及不含药的PCA培养基上,30 ℃静置培养48~72 h后计数,再对样品耐药率进行计算。
耐药率(%)=样品在药物筛选培养基上生长的
菌落数/样品在不含药培养基上 生长的菌落总数×100
1. 5 细菌总DNA提取及16S rDNA高通量测序
取预处理样品0.1 mL,分别涂布于含萘啶酸或恩诺沙星及不含药的TSA培养基上,30 ℃静置培养18~20 h。用无菌生理盐水洗下TSA培养基上的菌落,吹打混匀,5000×g离心5 min,弃上清液,细菌沉淀物采用Bacterial DNA Kit试剂盒(OMEGA)进行DNA提取。以提取获得的DNA为模板,以27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TA CGGYTACCTTGTTACGACTT-3')为引物,进行PCR扩增,扩增产物采用1.0%琼脂糖凝胶电泳进行检测,经胶回收和纯化试剂盒分别回收纯化后,送至广州基迪奥生物科技有限公司进行16S rDNA高通量测序,测序区域为V3~V4区,测序平台为HiSeq2500 PE250。
2 结果与分析
2. 1 不同养殖阶段罗非鱼肠道及养殖环境的菌群数量特征
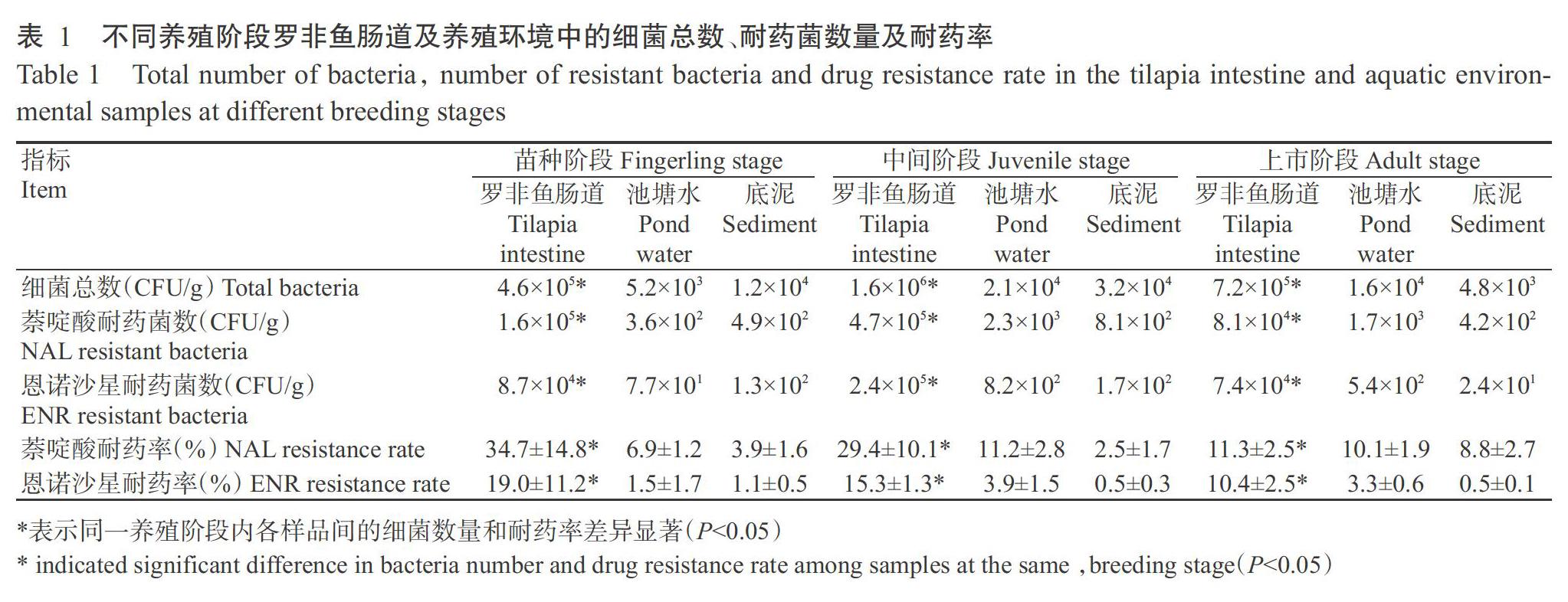
2. 1. 1 罗非鱼肠道及养殖环境细菌总数在养殖过程中的变化情况 通过平板计数法对所采集的样品进行细菌总数分析,结果(表1)显示,罗非鱼肠道、池塘水和底泥在苗种阶段、中间阶段及上市阶段的细菌总数相对稳定,无显著差异(P>0.05,下同);但罗非鱼肠道样品的细菌总数显著高于养殖环境样品(P<0.05,下同)。其中,罗非鱼肠道的细菌总数维持在4.6×105~1.6×106 CFU/g,池塘水的细菌总数维持在5.2×103~2.1×104 CFU/g,池塘底泥的细菌总数维持在4.8×103~3.2×104 CFU/g。
2. 1. 2 不同养殖阶段罗非鱼肠道及养殖环境细菌对喹诺酮类药物的耐药情况 罗非鱼肠道及养殖环境样品经含萘啶酸或恩诺沙星的PCA培养基培养48~72 h后,分别统计筛选获得的耐药菌菌落数,并与不含药物PCA培养计数后的菌落总数进行比较,计算出不同来源样品菌群在不同养殖阶段的耐药率。结果显示,不同来源样品菌群对萘啶酸的耐药率均高于对恩诺沙星的耐药率。其中,罗非鱼肠道菌群对萘啶酸的耐药菌数平均为2.3×105 CFU/g,耐药率为25.6%,对恩诺沙星的耐药菌数平均为1.3×105 CFU/g,耐药率为14.6%;养殖环境(池塘水和底泥)无论从耐药菌数和耐药率均远低于罗非鱼肠道。对比不同养殖阶段,发现苗种阶段罗非鱼肠道菌群对喹诺酮类药物的耐药率高于中间阶段和上市阶段。苗种阶段罗非鱼肠道菌群对萘啶酸的耐药率为34.7%、中间阶段的耐药率为29.4%、上市阶段的耐药率为11.3%,苗种阶段罗非鱼肠道菌群对恩诺沙星的耐药率为19.0%、中间阶段的耐药率为15.3%、上市阶段的耐药率为10.4%;而池塘水和底泥菌群在各养殖阶段的耐药率波动相对较小(表1)。
2. 2 不同养殖阶段罗非鱼肠道及养殖环境的菌群结构特征
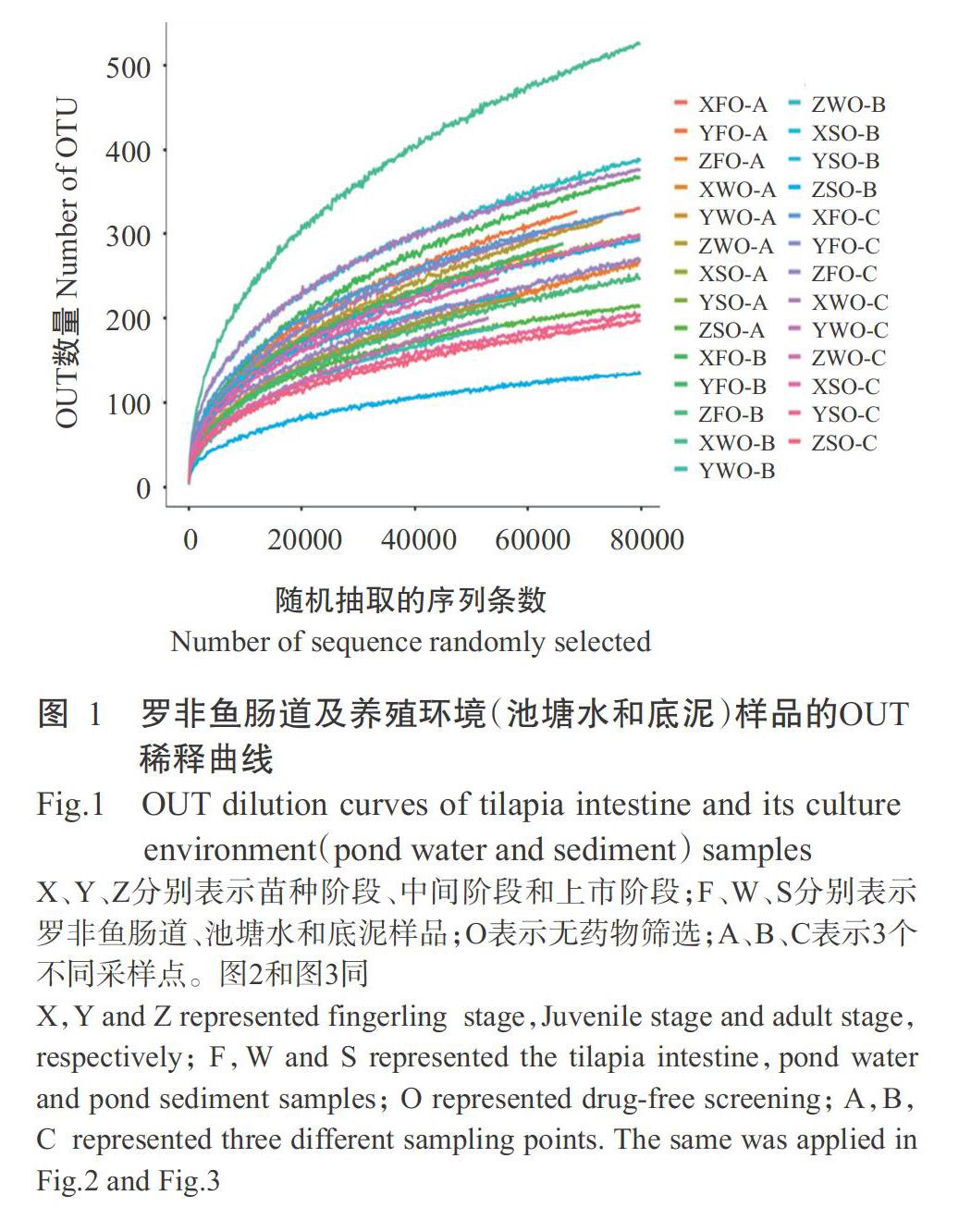
2. 2. 1 不同养殖阶段罗非鱼肠道及养殖环境的微生物多样性分析 不同养殖阶段罗非鱼肠道及养殖环境微生物α多样性指数显示,OTU稀释曲线趋于平缓并达平台期(图1),说明测序量趋于饱和,高通量测序结果可较全面反映样品中的微生物组成。其中,罗非鱼肠道微生物在苗种阶段和上市阶段的Shannon指数和Simpson指数较接近,且均小于中间阶段,即中间阶段的罗非鱼肠道微生物多样性高于苗种阶段和上市阶段;池塘水微生物在苗种阶段和上市阶段的Shannon指数和Simpson指数也较接近,但均大于中间阶段,说明中间阶段的池塘水微生物多样性低于苗种阶段和上市阶段;池塘底泥微生物在3个养殖阶段的Shannon指数和Simpson指数均较接近,说明池塘底泥微生物多样性在养殖期间较稳定,变化不明显。
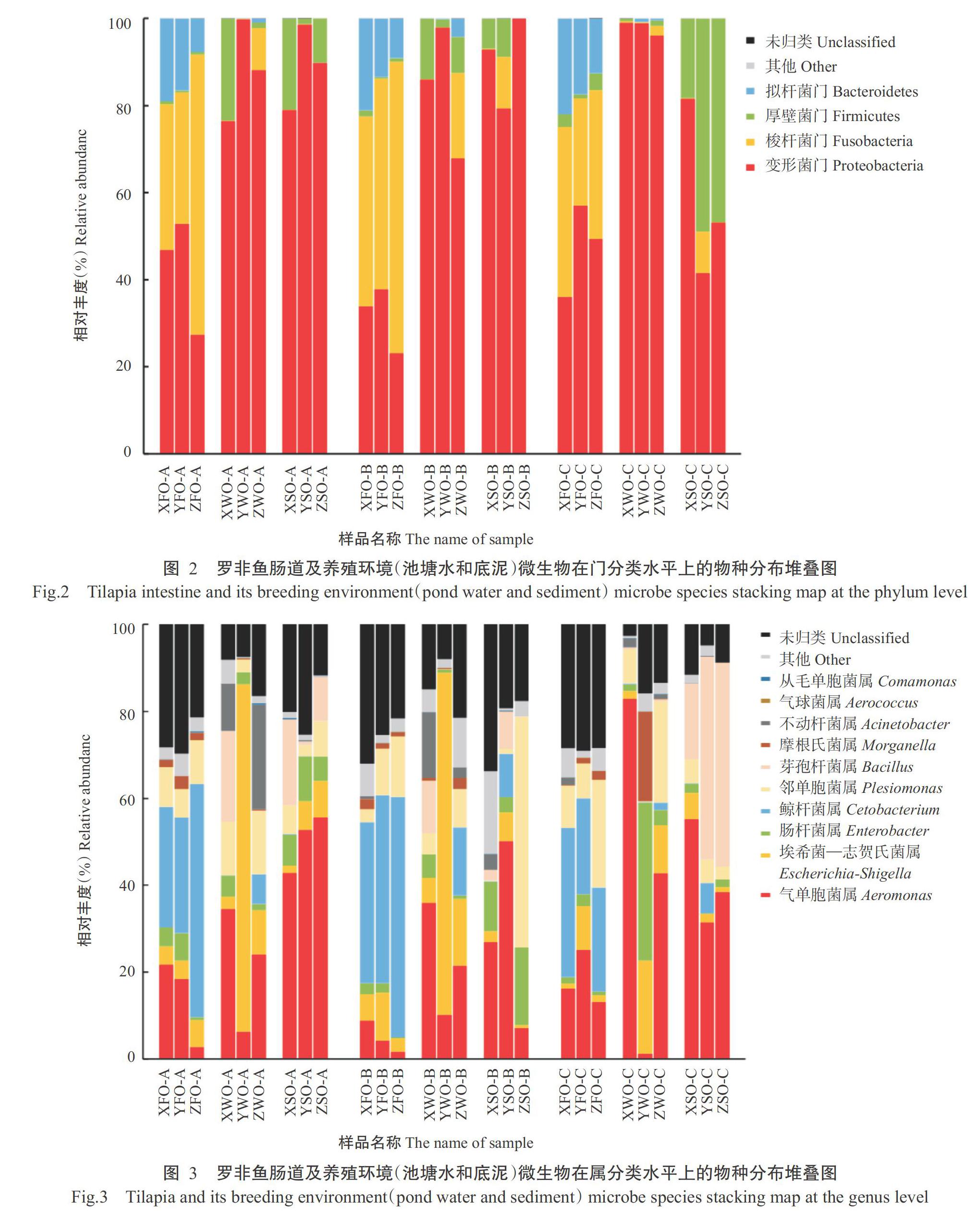
2. 2. 2 不同养殖阶段罗非鱼肠道及养殖环境的微生物物种组成 经高通量测序可知,罗非鱼肠道及养殖环境中的可培养微生物主要可归类为8个门(图2),分别是变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、平生菌门(Planctomycetes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)和疣微菌門(Verrucomicrobia)。其中,3个采样点的优势菌群均集中在变形菌门、梭杆菌门、厚壁菌门和拟杆菌门;罗非鱼肠道微生物在各养殖阶段均以变形菌门和梭杆菌门占绝对优势(二者相对丰度之和超过80%),而池塘水和底泥微生物在各养殖阶段以变形菌门占绝对优势(相对丰度均超过75%)。
罗非鱼肠道及养殖环境中的可培养微生物主要可归类为10个属(图3),分别是气单胞菌属(Aeromonas)、埃希菌—志贺氏菌属(Escherichia-Shigella)、鲸杆菌属(Cetobacterium)、邻单胞菌属(Plesiomonas)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、不动杆菌属(Acinetobacter)、摩根氏菌属(Morganella)、爱德华菌属(Edwardsiella)和变形杆菌属(Proteus)。各养殖阶段罗非鱼肠道及养殖环境(池塘水和底泥)的优势菌群均以气单胞菌属、埃希菌—志贺氏菌属、鲸杆菌属、邻单胞菌属、芽孢杆菌属和肠杆菌属为主。随着养殖阶段的推移,罗非鱼肠道中的气单胞菌属相对丰度呈下降趋势,而鲸杆菌属呈上升趋势;养殖环境(池塘水和底泥)中的菌群结构在不同养殖阶段无明显规律性变化,可能是受外界环境因素影响较大。
2. 3 不同养殖阶段罗非鱼肠道及养殖环境喹诺酮类耐药菌的菌群结构特征
2. 3. 1 不同养殖阶段罗非鱼肠道及养殖环境萘啶酸耐药菌的菌群结构特征 通过含萘啶酸TSA培养基筛选菌群再进行高通量测序,结果显示其属分类水平的优势菌群主要为埃希菌—志贺氏菌属、肠杆菌属和气单胞菌属(图4)。罗非鱼肠道及养殖环境样品中对萘啶酸耐药的优势菌群主要为埃希菌—志贺氏菌属、肠杆菌属和气单胞菌属,三者的相对丰度之和在罗非鱼肠道样品中超过70%,在养殖环境(池塘水和底泥)中高达90%以上。随着养殖阶段的推移,罗非鱼肠道及池塘水中的埃希菌—志贺氏菌相对丰度逐渐上升,底泥中则表现为气单胞菌属相对丰度逐渐上升。
2. 3. 2 不同养殖阶段罗非鱼肠道及养殖环境恩诺沙星耐药菌的菌群结构特征 通过含恩诺沙星TSA培养基筛选菌群再进行高通量测序,结果显示其属分类水平的优势菌群主要为埃希菌—志贺氏菌属和气单胞菌属(图5),两者的相对丰度之和在罗非鱼肠道样品中在50%以上,在养殖环境(池塘水和底泥)中高达90%以上。比较不同养殖阶段,罗非鱼肠道菌群中对恩诺沙星耐药的气单胞菌属在中间阶段的相对丰度显著高于苗种阶段和上市阶段;养殖环境(池塘水和底泥)样品中对恩诺沙星耐药的菌群无明显规律性变化。
3 讨论
关于鱼类肠道菌群及养殖环境微生物多样性分析是近年来的一个研究热点。鱼肠道菌群可分为固有菌群和非固有菌群,在鱼类维持机体代谢、发育进化及免疫等方面发挥重要作用(Wang et al.,2017)。鱼类肠道微生物的群落结构特征不仅受限于鱼体自身且与其养殖环境密切相关,还与其所处环境的各种理化性质及生物因子相关(陈孝煊等,2005)。鱼类肠道内的细菌种类繁多,包括好氧菌、兼性厌氧菌和专性厌氧菌,且数量庞大。由于所处水体环境和食性等因素的差异,不同鱼类的肠道细菌组成和数量也各不相同。鱼类肠道中的厌氧菌总数远大于需氧菌总数,但厌氧菌多数定殖于肠壁,其含量相对较稳定;而需氧菌主要游离于肠腔内,其含量随机波动性较大。本研究采用平板计数法统计得出罗非鱼肠道的细菌总数在4.6×105~1.6×106 CFU/g,与已报道其他淡水鱼类(鲢、鲤和鲫)肠道的细菌数量差异不明显,但低于草鱼肠道的细菌总数(在107 CFU/g左右)(周玉法等,2012)。
已有研究表明,非固有菌群中存在多种条件致病菌,包括气单胞菌属、假单胞菌属和分支杆菌属等,且这些细菌多数为需氧菌或兼性厌氧菌(Dong et al.,2018)。为了解非固有菌群中潜在的条件致病菌和耐药菌组成,本研究采用高通量测序分析不同养殖阶段罗非鱼肠道及养殖环境的菌群结构特征,结果表明,罗非鱼肠道可培养微生物中的优势菌群主要是气单胞菌属、埃希菌—志贺氏菌属、鲸杆菌属、邻单胞菌属和肠杆菌属细菌,且随着养殖阶段的推移,罗非鱼肠道中的气单胞菌属相对丰度呈下降趋势,而鲸杆菌属呈上升趋势;C采样点罗非鱼肠道鲸杆菌属的变化趋势与A和B采样点的变化趋势略有不同,可能与饲料投喂和营养摄入差异有关。佟延南等(2018)研究表明,罗非鱼肠道优势菌群主要为乳球菌属(Lactococcus)、聚球藻属(Synechococcus)、梭菌属(Clostridium)、假单胞菌属(Pseudomonas)、分枝杆菌属(Mycobacterium)和鲸杆菌属;刘志刚等(2018)研究发现,健康罗非鱼肠道优势菌群为芽孢杆菌属、乳球菌属和鲸杆菌属,链球菌发病罗非鱼肠道优势菌群为链球菌属、分支杆菌属和芽孢杆菌属。可见,罗非鱼肠道存在比例较高的条件致病菌,且多属于可培养的需氧或兼性厌氧菌,可在细菌病害或细菌耐药性监测中作为指示菌。养殖环境(池塘水和底泥)的优势菌群组成与罗非鱼肠道菌群组成存在一定差异,其中罗非鱼肠道优势菌群种类与池塘水的优势菌群种类相似,但相对丰度有明显差异,如养殖池塘水中的鲸杆菌属相对丰度小于1%,而罗非鱼肠道中的鲸杆菌属相对丰度大于20%,与刘志刚等(2018)的研究结果相似。鲸杆菌属细菌是淡水鱼肠道中常见的革兰氏阴性菌(Larsen et al.,2014),可产生醋酸及维生素B12等物质,在鱼类生长发育过程中发挥重要作用(Tsuchiya et al.,2008;Li et al.,2015)。本研究也发现,随着养殖阶段的推移,罗非鱼肠道中的鲸杆菌属相对丰度逐渐上升趋势,符合鱼体的生长发育规律。
目前,国内外有关罗非鱼喹诺酮类药物的耐药性研究主要集中在罗非鱼体内分离获得的病原菌。Lee和Wendy(2017)对分离自红色杂交罗非鱼(Oreochromis spp.)的嗜水气单胞菌和迟缓爱德华氏菌(Edwardsiella tarda)进行16种抗菌药物的耐药性分析,袁伟(2017)对我国南方地区的罗非鱼源无乳链球菌进行5种喹诺酮类药物的敏感性测定,结果均发现不同病原菌对喹诺酮类药物的敏感性各有差异,与不同地区、不同来源及不同菌种等有关。郭学中等(2018)研究表明,分离自同一罗非鱼产品的气单胞菌和大肠埃希菌(Escherichia coli)对恩诺沙星的耐药率也存在明显差异,其中,气单胞菌对恩诺沙星的耐药率为2.50%,而大肠埃希菌对恩诺沙星的耐药率为25.82%。本研究采用平板计数法分析各样品的总体耐药细菌情况,结果发现罗非鱼肠道中对萘啶酸耐药的细菌数量平均为2.3×105 CFU/g,耐药率为25.6%,对恩诺沙星耐药的细菌数量平均为1.6×105 CFU/g,耐药率为17.9%;而养殖环境(池塘水和底泥)无论从耐药菌数量和耐药率均低于罗非鱼肠道。余丽等(2016)采用平板计数法统计水产品中的四环素耐药细菌情况,结果显示鱼肠中四环素耐药菌数量达106 CFU/g。可见,鱼类肠道可能是耐药细菌蓄积的主要场所。Singh等(2009)采用平板計数法对不同养殖阶段的鲤进行四环素耐药性分析,结果发现成鱼阶段对土霉素的耐药菌数及耐药率均高于鱼苗阶段和鱼卵阶段,但本研究发现鱼苗阶段的喹诺酮类耐药菌数相对较高,可能与不同品种的具体养殖情况有关。本研究的3个样品采集养殖场在试验期间均未发生病害,也未使用抗菌药物,苗种阶段的喹诺酮类耐药菌数较高可能与培苗过程曾使用药物有关。
近年来,随着高通量测序技术的发展,耐药性研究已从单一细菌耐药转变为以微生物群落为对象的耐药组学研究(Boolchandani et al.,2019)。肠道菌群是一个庞大而复杂的微生物生态系统,细菌个体间紧密接触更利于耐药基因通过水平基因转移在菌群间传播,因此,肠道菌群组成的耐药基因储库可介导菌群间多种耐药基因持续、广泛传播(高琰宇等,2018)。抗菌药物直接服用引起肠道菌群结构改变,是导致菌群耐药菌株和耐药基因增多且广泛分布的主要原因(高琰宇等,2018)。Yuan等(2019)通过检测市售四大家鱼肠道菌群的耐药菌株和耐药基因,发现四大家鱼的肠道菌群主要有梭菌门、变形门、厚壁菌门、拟杆菌门和放线菌门,不同类型的耐药基因与不同菌群相关,如四环素耐药基因tetA主要与棒杆菌属(Corynebacterium)相关、β-内酰胺酶耐药基因blaTEM-1主要与布鲁氏菌(Brucella)相关。Zimmermann和Curtis(2019)对42篇关于喹诺酮类药物对人类肠道菌群影响的报道进行分析,发现有4篇报道中志愿者服用环丙沙星后,其肠道菌群多样性呈不同程度的降低,而多篇报道指出经喹诺酮类药物治疗后,肠杆菌科(Enterobacteriaceae)细菌、大肠埃希菌、芽孢杆菌属及棒状杆菌属的相对丰度呈下降趋势,弯曲杆菌属(Citrobacter)、肠杆菌属和克雷伯氏菌属(Klebsilla)的相对丰度则呈上升趋势,此外,多数厌氧菌如拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)和梭菌属(Clostridium)的相对丰度也有不同程度的下降趋势。恩诺沙星主要作用需氧和兼性厌氧菌,对肠道菌群占优势地位的厌氧菌作用不强(秦玉玲等,2009)。本研究采用含恩诺沙星TSA培养基筛选耐药菌,结果发现罗非鱼肠道耐药菌群以埃希菌属—志贺氏菌属和气单胞菌属的相对丰度较高,且气单胞菌属在中间阶段的相对丰度较高;通过含萘啶酸TSA培养基筛选的耐药菌群以埃希菌属—志贺氏菌属和肠杆菌属为主,肠杆菌属在苗种阶段的相对丰度较高,但随着养殖阶段的推移而下降,埃希菌属—志贺氏菌属的相对丰度则随着养殖阶段的推移呈上升趋势。可见,埃希氏菌属和气单胞菌属最易产生喹诺酮类耐药。埃希菌属的大肠埃希菌是人类和动物体内及环境中分布最广泛的细菌,也是常见的食源性细菌。不同来源大肠埃希菌对喹诺酮类药物的耐药性已呈越来越严重的趋势(郭学中等,2018;Poirel et al.,2018;Tomova et al.,2018),对食品安全及人类健康已产生严重威胁。气单胞菌属是水产动物的常见病原菌,其耐药性的产生同样会对水产品质量安全产生影响(郭学中等,2018;谭爱萍等,2019)。此外,埃希菌属—志贺氏菌属和气单胞菌属耐药细菌在水产养殖过程中的喹诺酮类耐药风险相对较高,提示大肠埃希菌和气单胞菌可作为水产养殖喹诺酮类耐药性监测的指示菌。
4 结论
罗非鱼养殖的耐药风险主要集中在养殖前期阶段,埃希菌属和气单胞菌属是喹诺酮类耐药的主要菌群,应加强不同养殖阶段的饲养管理,减少病害发生以减轻抗菌药物使用带来的风险。此外,可选用埃希菌属和气单胞菌属作为水产养殖细菌耐药性监测的指示菌,实时监控喹诺酮类药物耐药性的产生与传播。
参考文献:
陈孝煊,吴志新,周文豪. 2005. 鱼类消化道菌群的作用与影响因素研究进展[J]. 华中农业大学学报,24(5):523-528. [Chen X X,Wu Z X,Zhou W H. 2005. Study on the effects and influencing factors of microflora in the digestive tract of fish[J]. Journal of Huazhong Agricultural University,24(5):523-528.]
代云云,袁永明,袁媛,張红燕. 2016. 中国罗非鱼产品出口贸易情况分析及展望[J]. 中国农学通报,32(32):42-47. [Dai Y Y,Yuan Y M,Yuan Y,Zhang H Y. 2016. Current and future situation of tilapia product export in China[J]. Chinese Agricultural Science Bulletin,32(32):42-47.]
丁正峰,薛晖,王晓丰,杨林. 2011. 江苏主要水产病原菌耐药谱系监测[J]. 江苏农业科学,39(2):344-347. [Ding Z F,Xue H,Wang X F,Yang L. 2011. Surveillance of drug resistance of major aquatic pathogens in Jiangsu[J]. Jiangsu Agricultural Sciences,39(2):344-347.]
高琰宇,毕文静,吴新颜,朱骁,罗义. 2018. 细菌耐药影响肠道菌群及其宿主免疫调控[J]. 生物工程学报,34(8):1259-1269. [Gao Y Y,Bi W J,Wu X Y,Zhu X,Luo Y. 2018. Bacterial resistance influences intestinal flora and host immune regulation[J]. Chinese Journal of Biotechnology,34(8):1259-1269.]
郭学中,张瑞泉,姜兰,谭爱萍,邓玉婷,李金祥,赵飞,刘付翠,何山. 2018. 罗非鱼水产品中的喹诺酮类药物耐药菌和耐药基因检测分析[J]. 中国水产科学,25(5):1032-1039. [Guo X Z,Zhang R Q,Jiang L,Tan A P,Deng Y T,Li J X,Zhao F,Liu F C,He S. 2018. Detection and analysis of quinolone resistance and resistance-associated genes in bacteria isolated from tilapias sold in the supermarkets[J]. Journal of Fishery Sciences of China,25(5):1032-1039.]
黄钧,施金谷,黄艳华,温华成,陈武仕,秦纪璇,覃丽芬,滕忠作. 2012. 罗非鱼竖鳞病病原菌的分离鉴定及药敏试验[J]. 南方农业学报,43(8):1230-1234. [Huang J,Shi J G,Huang Y H,Wen H C,Chen W S,Qin J X,Qin L F,Teng Z Z. 2012. Isolation and identification of lepidorthosis pathogenic bacteria in tilapia and its drug sensitivity test[J]. Journal of Southern Agriculture,43(8):1230-1234.]
黎铭,马春霞,黎建斌,雷爱莹,李莉萍,李大列,陈福艳,陈明. 2019. 无乳链球菌对罗非鱼肠道菌群的影响[J]. 南方农业学报,50(8):1647-1656. [Li M,Ma C X,Li J B,Lei A Y,Li L P,Li D L,Chen F Y,Chen M. 2019. Effects of Streptococcus agalactiae on intestinal flora of tilapia[J]. Journal of Southern Agriculture,50(8):1647-1656.]
林居纯,罗忠俊,舒刚,吕程. 2009. 嗜水气单胞菌临床分离菌对抗菌药物的耐药性调查[J]. 安徽农业科学,37(15):7024-7025. [Lin J C,Luo Z J,Shu G,Lü C. 2009. Investigation on drug resistance of clinical isolates from Aero-monas hydrophila on antibiotics[J]. Journal of Anhui Agricultural Sciences,37(15):7024-7025.]
刘志刚,卢迈新,可小丽,王淼,张德锋. 2018. 尼罗罗非鱼肠道及养殖环境中菌群结构与链球菌病的相关性[J]. 水产学报,42(10):1635-1647. [Liu Z G,Lu M X,Ke X L,Wang M,Zhang D F. 2018. Correlation between microflora structure in intestinal tract and aquaculture environment of tilapia(Oreochromis niloticus) and streptococcicosis[J]. Journal of Fisheries of China,42(10):1635-1647.]
吕小丽,黎姗梅,彭民毅,韩书煜,蒙兰丽,韦慕兰,黄维,黄钧. 2017. 广西罗非鱼主养区致病性链球菌及其耐药性调查[J]. 广西畜牧兽医,33(3):143-148. [Lü X L,Li S M,Peng M Y,Han S Y,Meng L L,Wei M L,Huang W,Huang J. 2017. Investigation on pathogenic Streptoco-ccus and its drug resistance in the tilapia main breeding area of Guangxi[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,33(3):143-148.]
秦玉玲,趙静静,黄显会,高延玲,陈杖榴,曾振灵,刘健华. 2009. 低浓度恩诺沙星对离体恒化器模型中人体肠道菌群的影响[J]. 中国农业科学,42(12):4358-4365. [Qin Y L,Zhao J J,Huang X H,Gao Y L,Chen Z L,Zeng Z L,Liu J H. 2009. Effects of enrofloxacin on human intestinal mocrofloa in chemostat model[J]. Scientia Agricultura Sinica,42(12):4358-4365.]
谭爱萍,邓玉婷,姜兰,赵飞,张瑞泉. 2019. 水产动物源气单胞菌喹诺酮类耐药与PMQR基因、QRDR突变相关性分析[J]. 中国农业大学学报,24(4):102-111. [Tan A P,Deng Y T,Jiang L,Zhao F,Zhang R Q. 2019. Correlation between PMQR genes/QRDR mutations and quinolones resistance in Aeromonas from aquatic animals[J]. Journal of China Agricultural University,24(4):102-111.]
佟延南,李芳远,李忠琴,赵光军,李高俊,王德强. 2018. 不同养殖阶段罗非鱼肠道微生物多样性的动态分析[J]. 南方农业学报,49(7):1415-1422. [Tong Y N,Li F Y,Li Z Q,Zhao G J,Li G J,Wang D Q. 2018. Dynamic analysis of intestinal microbial diversity in tilapia at different culture stages[J]. Journal of Southern Agriculture,49(7):1415-1422.]
王瑞旋,陈毕生. 2007. 喹诺酮类药物在水产养殖中的应用研究概况[J]. 南方水产,3(3):73-79. [Wang R X,Chen B S. 2007. Review on applied research of quinolones in aquaculture[J]. South China Fisheries Science,3(3):73-79.]
谢云丹,冯娟,刘婵,邓益琴,王江勇,苏友禄. 2019. 自然感染无乳链球菌罗非鱼的比较病理学及毒力基因谱分析[J]. 南方水产科学,15(2):47-57. [Xie Y D,Feng J,Liu C,Deng Y Q,Wang J Y,Su Y L. 2019. Comparative pathological study of tilapia naturally infected with Streptoco-ccus agalactiae and virulence gene profiling of isolated strains[J]. South China Fisheries Science,15(2):47-57.]
叶富良. 2004. 广东罗非鱼养殖生产现状[J]. 南方水产,(2):3-5. [Ye F L. 2004. Tilapia aquaculture production status in Guangdong[J]. South China Fisheries Science,(2):3-5.]
余丽,熊丽娜,石磊,叶蕾. 2016. 广州市售鱼、虾、蛤蚌中四环素耐药菌及四环素耐药基因的研究[J]. 现代食品科技,32(10):239-245. [Yu L,Xiong L N,Shi L,Ye L. 2016. Tetracycline-resistant bacteria and tetracycline-resistant genes from fish,shrimp,and clams in Guangzhou[J]. Mo-dern Food Science and Technology,32(10):239-245.]
袁偉. 2017. 中国罗非鱼源无乳链球菌流行特征及耐药性研究[D]. 上海:上海海洋大学. [Yuan W. 2017. Epidemiological characteristics and drug resistance of Streptococcus agalactiae isolated from tilapia in China[D]. Shanghai:Shanghai Ocean University.]
周玉法,李代军,刘东燕,刘敬博,姚淑红,蔡玉梅. 2012. 4种常见淡水鱼肠道菌群的分析[J]. 中国畜牧兽医,39(8):220-223. [Zhou Y F,Li D J,Liu D Y,Liu J B,Yao S H,Cai Y M. 2012. The intestinal flora analysis of four types of common freshwater fish[J]. Chinese Animal Husbandry and Veterinary Medicine,39(8):220-223.]
Boolchandani M,D?souza A W,Dantas G. 2019. Sequencing-based methods and resources to study antimicrobial resistance[J]. Nature Reviews. Genetics,20(6):356-370.
Deng Y T,Wu Y L,Tan A P,Huang Y P,Jiang L,Xue H J,Wang W L,Luo L,Zhao F. 2014. Analysis of antimicrobial resistance genes in Aeromonas spp. isolated from cultured freshwater animals in China[J]. Microbial Drug Resistance,20(4):350-356.
Dong B,Deng D,Yi Y,Zhao X,You X,Shi Q. 2018. Gastrointestinal metagenomics of fish:Methods,research advances and applications[J]. International Journal of Agriculture and Biology,20(10):2277-2286.
Hao R Z,Zhao R T,Qiu S F,Wang L G,Song H B. 2015. Antibiotics crisis in China[J]. Science,348(6239):1100-1101.
Kümmerer K. 2009. Antibiotics in the aquatic environment—A review-Part I[J]. Chemosphere,75(4):417-434.
Larsen A M,Mohammed H H,Arias C R. 2014. Characterization of the gut microbiota of three commercially valuable warmwater fish species[J]. Journal of Applied Microbio-logy,116(6):1396-1404.
Lee S W,Wendy W. 2017. Antibiotic and heavy metal resistance of Aeromonas hydrophila and Edwardsiella tarda isolated from red hybrid tilapia(Oreochromis spp.) coinfected with motile aeromonas septicemia and edwardsiellosis[J]. Veterinary World,10(7):803-807.
Li T T,Long M,Gaatesoupe F J,Zhang Q Q,Li A H,Gong X N. 2015. Comparative analysis of the intestinal bacte-rial communities in different species of carp by pyrosequencing[J]. Microbial Ecology,69(1):25-36.
Liu X,Steele J C,Meng X Z. 2017. Usage,residue,and human health risk of antibiotics in Chinese aquaculture:A review[J]. Environmental Pollution,223:161-169.
McEwen S A,Collignon P J. 2018. Antimicrobial resistance:A one health perspective[J]. Microbiology Spectrum,6(2). doi:10.1128/microbiolspec.ARBA-0009-2017.
Poirel L,Madec J Y,Lupo A,Schink A K,Kieffer N,Nordmann P,Schwarz S. 2018. Antimicrobial resistance in Escherichia coli[J]. Microbiology Spectrum,6(4). doi:10.1128/ microbiolspec.ARBA-0026-2017.
Singh A K,Rathore G,Singh V,Mani I,Singh R K,Mishra S K,Mishra B N,Verma O P. 2009. Bacterial resistance to oxytetracycline in different life stages of Indian freshwater carp aquaculture system[J]. International Journal of Microbiology Research,1(1):25-34.
Tomova A,Ivanova L,Buschmann A H,Godfrey H P,Cabello F C. 2018. Plasmid-mediated quinolone resistance(PMQR) genes and class 1 integrons in quinolone-resistant marine bacteria and clinical isolates of Escherichia coli from an aquacultural area[J]. Microbial Ecology,75(1):104-112.
Tsuchiya C,Sakata T,Sugita H. 2008. Novel ecological niche of Cetobacterium somerae,an anaerobic bacterium in the intestinal tracts of freshwater fish[J]. Letters in Applied Microbiology,46(1):43-48.
Wang A R,Ran C,Ringo E,Zhou Z G. 2017. Progress in fish gastrointestinal microbiota research[J]. Reviews in Aquaculture,10(3):626-640.
Yuan L,Wang L,Li Z H,Zhang M Q,Shao W,Sheng G P. 2019. Antibiotic resistance and microbiota in the gut of Chinese four major freshwater carp from retail markets[J]. Environmental Pollution,255(2):113327. doi:10. 1016/j.envpol.2019.113327.
Zhang Q,Lambert G,Liao D,Kim H,Robin K,Tung C K,Pourmand N,Austin R H. 2011. Acceleration of emergence of bacterial antibiotic resistance in connected microenvironments[J]. Science,333(6050):1764-1767.
Zimmermann P,Curtis N. 2019. The effect of antibiotics on the composition of the intestinal microbiota—A systema-tic review[J]. The Journal of Infection,79(6):471-489.
(責任编辑 兰宗宝)

