酵母单杂交文库构建及巨峰葡萄VvFT基因启动子上游调控因子筛选
黄桂媛 张瑛 林玲 韩佳宇 时晓芳 曹雄军 郭荣荣


摘要:【目的】利用酵母单杂交文库筛选巨峰葡萄VvFT基因启动子上游调控因子,挖掘参与调控葡萄开花时间的因子,为揭示花期转变代谢通路和定向改良葡萄品种提供理论参考。【方法】利用PlantCARE分析预测VvFT基因启动子顺式作用元件,并以VvFT基因启动子为诱饵,利用酵母单杂交文库筛选技术,筛选作用在VvFT基因启动子上游的调控因子。【结果】葡萄VvFT基因启动子区域存在13种启动子顺式作用元件,包括A-box、CAAT-box和TATA-box组成型调控元件;光响应调控元件ATC-motif、Box 4、G-Box和GT1-motif;茉莉酸甲酯(MeJA)響应调控元件CGTCA-motif和TGACG-motif;干旱诱导的MYB结合位点元件MBS;玉米蛋白代谢必需的调控元件O2-site;参与生物钟控制的调控元件circadian;厌氧诱导必需调控元件ARE。以VvFT基因启动子为诱饵,筛选获得34条表达序列标签(EST),其中有21条为未知功能,有13条在植物生长、抗逆防御、信号转导、转录调控、蛋白酶等方面均有已知或预测的功能,包括转录抑制因子ft41、GRF1互作因子ft44、NAP1相关蛋白ft64及ft70分子伴侣DnaJ10。酵母单杂交点对点验证结果表明VvDnaJ10和VvFT基因启动子之间有相互作用。【结论】通过酵母单杂交文库筛选获取13条候选EST,虽然大部分EST功能预测分析结果与VvFT调控开花时间无明显的直接关系,但研究结果为进一步探索VvFT转录或表达水平控制葡萄开花时间的分子机制提供侯选基因。
关键词: 葡萄;VvFT基因;启动子;酵母单杂交文库;调控因子;筛选
中图分类号: S663.1 文献标志码: A 文章编号:2095-1191(2020)12-2875-09
Abstract:【Objective】Screening of upstream regulatory factors of VvFT gene promoter in kyoho grape by yeast one-hybrid library and exploring factors that involved in the regulation of flowering time of grape could help to reveal the me-tabolic pathway during flowering and provide a theoretical basis for the directional improvement of grape varieties. 【Me-thod】Potential cis-acting regulatory elements of the VvFT promoter were analyzed online in PlantCARE database. VvFT promoter sequence was used as a bait to search potential regulatory factors acting on VvFT promoter upstream by yeast one-hybrid library screening system in latent buds. 【Result】There were 13 cis-acting elements in the VvFT promoter region of kyoho grape, including constitutive regulatory elements(A-box, CAAT-box and TATA-box), light responsive elements(ATC-motif, Box 4, G-box and GT1-motif), cis-acting regulatory elements involved in the MeJA-responsiveness(CGTCA-motif and TGACG-motif), MYB binding site involved in drought-inducibility, cis-acting regulatory element involved in zein metabolism regulation(O2-site), cis-acting regulatory element involved in circadian control(circadian) and cis-acting regulatory element essential for the anaerobic induction(ARE). Using VvFT promoter as a bait,a total of 34 ESTs were acquired in the yeast one-hybrid library. Functional classification results showed that 21 were unknown functional proteins,and 13 had known or predicted functions including plant growth, stress resistance, signal transduction, transcriptional regulation, proteases. Among them,there were transcriptional suppressor ft41,GRF1 interaction factor ft44, NAP1-related protein ft64 and ft70 molecular chaperone DnaJ10. The results of yeast single hybridization point to point verification showed that there was interaction between VvDnaJ10 and VvFT promoter. 【Conclusion】In this study,13 candidate ESTs are obtained by yeast one-hybrid library screening system. Although most of the results of ESTs function prediction analysis have no obvious direct relationship with VvFT regulating flowering time, the results provide candidate gene resources for further exploration of the molecular mechanism of VvFT transcription or expression level controlling flowering time in grape.
Key words: grape; VvFT gene; promoter; yeast one-hybrid library; regulator; screening
Foundation item: Guangxi Natural Science Foundation(2017GXNSFBA198100,2020GXNSFBA297006);Key Research and Development Plan Project of Guangxi(Guike AB18126005); Basic Research Project of Guangxi Academy of Agricultural Sciences(Guinongke 2021YT127)
0 引言
【研究意义】光周期、春化、环境温度、植物激素和自主开花通路相互关联并协调开花时间,以提高植物适应性和繁殖率(Wickland and Hanzawa,2015) 。自主开花通路下游有2个重要基因,分别为FT(FLOWERING LOCUS T)和TFL1(TERMINAL FLOWER 1),其编码1对与磷脂酰乙醇胺结合蛋白(PEBP)高度同源性的开花调节因子(Wickland and Hanzawa,2015),控制植物开花时间。葡萄(Vitis vinifera L.)是世界上广泛种植的果树之一,我国的鲜食葡萄产量占全球葡萄产量的14%(高世敏等,2018)。挖掘参与葡萄开花时间调控因子,如参与温度、激素和调节自主开花等响应因子,揭示开花时间调控代谢通路,有助于定向改良葡萄品种,优化葡萄植株营养生长与生殖生长的时空关系,以实现葡萄高产优产的目的。【前人研究进展】茎顶端分生组织向花分生组织的分化是有花植物的一个关键发育过程。花期转变主要通过整合环境和内源性刺激来调节,从而形成一个复杂的分级信号网络。FT蛋白是其中的一个重要移动信号,也是成花素的主要成分,在介导开花过程中发挥核心作用,其编码基因转录受正调控因子和负调控因子调控。叶片维管组织中转录调控因子CO(CONSTANS)与FT基因启动子近端区域的一个独特的顺式元件结合并激活FT基因转录,有效地促进花期的转变(An et al.,2004;Tiwari et al.,2010)。除光周期外,环境因素也调节FT基因表达。针对FT基因启动子或非编码区域的温度响应型FT调节因子FLC(FLOWERING LOCUS C)与SVP(SHORT VEGETATIVE PHASE)形成MADS-box蛋白复合物,并直接与第一个内含子和FT启动子区域的CArG位点结合来抑制FT基因转录(Searle et al.,2006;Lee et al.,2007;Li et al.,2008)。与大多数参与发育机制的基因转录本一样,FT基因mRNA也会迅速降解(Seo et al.,2011)。但近年研究表明,FT基因mRNA是由WER(WEREWOLF)的间接作用稳定下来,而WER是只存在于表皮组织的蛋白复合物的一部分(Seo et al.,2011)。此外,已有较多FT基因互作蛋白的相关研究报道(Liu et al.,2012)。如编码分子伴侣DnaJ蛋白的J3基因能调控拟南芥提前开花(Shen et al.,2011),说明DnaJ蛋白对FT基因功能具有潜在调节作用;苹果中VOZ1(Vascular plant one zinc finger protein 1)和TCP(TEOSINTE BRANCHED 1,CYCLOIDEA and PROLIFERATING CELL FACTORs)蛋白均与FT蛋白相互作用控制叶片和果实的发育(Mimida et al.,2011)。【本研究切入点】FT基因的功能在蛋白水平上的调控机制鲜有报道,更多的FT互作蛋白有待被挖掘与研究。与研究葡萄FT基因(VvFT)功能相比,对VvFT基因启动子区域潜在的调控因子挖掘,更有利于从转录水平了解该基因对葡萄开花时间的调控机理,但目前鲜见相关报道。【拟解决的关键问题】利用PlantCARE预测VvFT基因启动子顺式作用元件,并以VvFT基因启动子为诱饵,利用酵母单杂交文库筛选技术筛选作用于VvFT基因启动子上游的调控因子,挖掘潜在参与调控葡萄开花时间的因子,为揭示VvFT基因对花期的调控机制、花期转变代谢通路和定向改良葡萄品种提供理论参考。
1 材料与方法
1. 1 试验材料
供试葡萄品种为6年生巨峰葡萄(V. labrusca×V. vinifera‘Kyoho),种植于广西农业科学院五十亩双季葡萄栽培示范基地,采用简易避雨双十字V型架栽培模式,栽植密度为2.0 m×3.3 m,树势中等,管理水平良好。采集巨峰葡萄一季果冬芽,用于VvFT基因启动子克隆、酵母单杂交文库构建和VvDnaJ10基因克隆。高效植物基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。T4 DNA连接酶,Taq DNA聚合酶、SD/-Ura DO Supplement、SD/Leu DO Supplement、金擔子素A(AbA)、Matchmaker Insert Check PCR Mix 1、CHROMA SPIN TE-400层析柱和Make Your Own “Mate & Plate” Library System试剂盒均购自Clontech公司;腺嘌呤硫酸盐[Adenine Sulfate(Ade)]购自Amresco公司;限制性内切酶和凝胶回收试剂盒均购自Fermentas公司。
1. 2 试验方法
1. 2. 1 VvFT启动子克隆及序列分析 以欧洲葡萄黑比诺中FT基因上游1500 bp左右的序列设计引物pFT-F:5'-CGGGGTACCATGAGTTTTTTTATTTAT TGTTATCTCATA-3'(下划线为Kpn I酶切位点)和pFT-R:5'-CCCAAGCTTAGCTATCCAAACTGTATT GATCTATGGATT-3'(下划线为Hind III酶切位点)。使用高效植物基因组DNA提取试剂盒提取巨峰葡萄冬芽总DNA。以巨峰葡萄冬芽总DNA为模板,PCR扩增VvFT基因启动子序列(pVvFT),PCR反应体系25.0 μL:Premix TaqTM 12.5 μL,10 μmol/L引物pFT-F和pFT-R各1.0 μL,50 ng/μL DNA模板1.0 μL,ddH2O补足至25.0 μL。扩增程序:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min 30 s,进行33个循环;72 ℃ 10 min。将扩增的目的片段连接至pMD18-T载体上,获得重组质粒pMD18-T-pVvFT,送至北京六合华大基因科技股份有限公司测序。利用PlantCARE对VvFT基因启动子序列进行顺式调控元件预测分析。
1. 2. 2 诱饵载体pAbAi-pVvFT构建 用限制性内切酶Kpn I和Hind III对测序正确的重组质粒pMD18-T-pVvFT和pAbAi载体进行双酶切,回收目的片段并进行连接,获得诱饵载体pAbAi-pVvFT,转化大肠杆菌TOP10感受态细胞,取150 μL菌液涂布于含30 ng/mL氨苄青霉素的LB固体培养基上,37 ℃过夜培养。提取阳性克隆单菌落的重组质粒pAbAi-pVvFT进行双酶切鉴定,并送至北京六合华大基因科技股份有限公司测序鉴定。
1. 2. 3 诱饵载体pAbAi-pVvFT转化酵母菌株 分别将限制性内切酶Bstb I线性化的诱饵载体pAbAi-pVvFT和阳性对照质粒pAbAi-p53转化Y1HGold酵母感受态细胞,并各取150 μL菌液涂布于SD/-Ura和SD/-Ura/AbA(500 ng/mL)培养基上,30 ℃培养3 d。挑取SD/-Ura培养基上的单菌落,利用Matchmaker Insert Check PCR Mix 1进行菌落PCR鉴定。分别挑取含诱饵载体pAbAi-pVvFT和阳性对照pAbAi-p53的阳性单菌落,在SD/-Ura/AbA(500 ng/mL)培养基上划线培养3 d,获得Y1H-pAbAi-pVvFT和Y1H-pAbAi-p53酵母菌株。
1. 2. 4 cDNA文库构建 参照TRIzol试剂盒说明提取冬芽总RNA,采用Oligotex mRNA试剂盒分离纯化mRNA。以mRNA为模板,经SMART逆转录合成cDNA第一链,利用长距离PCR(LD-PCR)扩增技术合成双链cDNA,并用1%琼脂糖凝胶电泳进行检测,最后用CHROMA SPIN TE-400层析柱进行纯化,参照Make Your Own “Mate & Plate”Library System试剂盒使用说明构建葡萄冬芽cDNA文库。
1. 2. 5 VvFT基因启动子互作蛋白筛选 通过酵母单杂交技术筛选出与VvFT启动子互作的蛋白,具体操作:将cDNA文库和pGADT7-Rec线性化质粒共转化阳性诱饵菌株Y1H-pAbAi-pVvFT感受态细胞,取150 μL转化菌液涂布于SD/-Leu/AbA(500 ng/mL)培养基上,30 ℃培养3 d,挑选阳性克隆至YPDA液体培养基扩大培养3 d后抽提质粒,并利用猎物质粒pGADT7-T的通用引物(T7:5'-TAATACGACTCAC TATAGGGCGAGCGCCGCCATG-3'和ADR:5'-GTG AACTTGCGGGGTTTTTCAGTATCTACGATT-3')进行PCR鉴定,以pGADT7-T质粒为模板作为阳性对照,以水为模板作为阴性对照。PCR产物用1%琼脂糖凝胶电泳检测,将电泳图谱中500~2000 bp间有条带的质粒送北京六合华大基因科技股份有限公司测序。利用NCBI的BLASTx在线工具对cDNA插入片段进行序列比对,对其进行功能注释,从而筛选出与VvFT基因启动子互作的蛋白(邹禹等,2019)。
1. 2. 6 酵母单杂交点对点验证互作蛋白 根据NCBI数据库中VvDnaJ10基因(GenBank登录号XM_010665750.2)序列设计PCR引物,VvDnaJ10-F:5'-GGAATTCCATATGGTGAAGGAGACAGAATACT ATG-3'(下划线为Nde I酶切位点)和VvDnaJ10-R:5'-CCGCTCGAGTCACTCTCTGCCTGTTGAAG-3'(下划线为Xho I酶切位点)。以巨峰葡萄冬芽总DNA为模板克隆VvDnaJ10基因,连接至pMD18-T上后进行测序鉴定。用限制性内切酶Nde I和Xho I对测序正确的pMD18-T-VvDnaJ10重组质粒和pGADT-7空载体进行双酶切,回收目的片段进行连接,以构建猎物质粒pGADT7-VvDnaJ10,将其转化Y1H-pAbAi-pVvFT菌株感受态细胞,涂布于SD/-Leu和SD/-Leu/AbA(200 ng/mL)培养基,30 ℃培养3 d,观察菌斑生长情况。以阳性质粒pGADT7-p53转化Y1H-pAbAi-p53菌株为阳性对照、猎物空载体pGADT-7转化Y1H-pAbAi-p53菌株為阴性对照。
2 结果与分析
2. 1 VvFT基因启动子序列分析
以巨峰葡萄冬芽总DNA为模板克隆VvFT基因启动子,经测序鉴定该序列长1466 bp。利用PlantCARE数据库在线分析VvFT基因启动子的顺式作用调控元件,结果(表1)显示,共预测到13种顺式作用调控元件,包括A-box、CAAT-box和TATA-box组成型调控元件;光响应调控元件ATC-motif、Box 4、G-Box和GT1-motif;茉莉酸甲酯(MeJA)响应调控元件CGTCA-motif和TGACG-motif;干旱诱导的MYB结合位点元件MBS;玉米蛋白代谢必需的调控元件O2-site;参与生物钟控制的调控元件circadian;厌氧诱导必需调控元件ARE,推测VvFT基因启动子区域具有潜在调节因子结合的结构基础。
2. 2 诱饵菌株Y1H-pAbAi-pVvFT构建
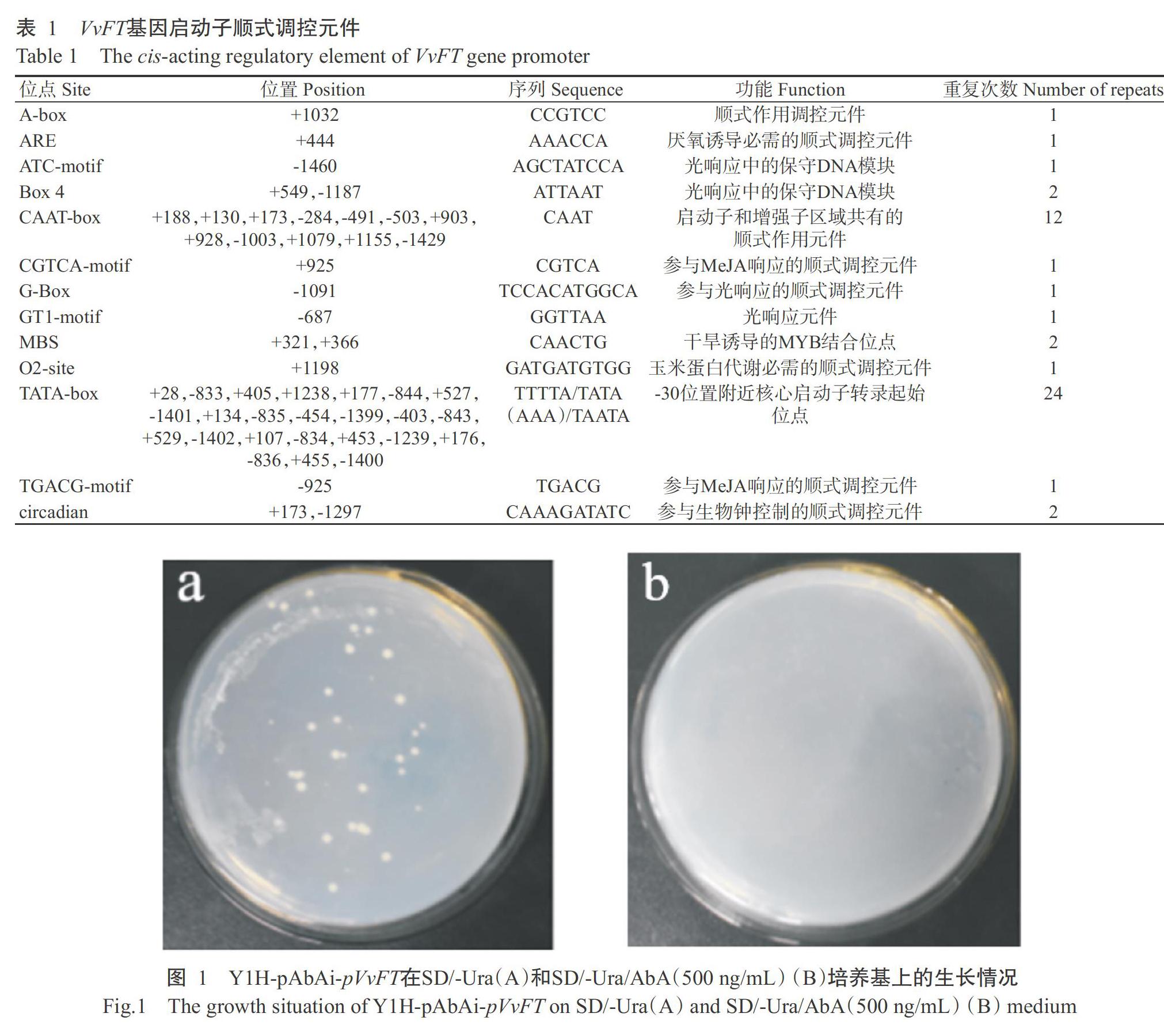
使用T4 DNA连接酶将VvFT基因启动子序列(1466 bp)与pAbAi质粒连接构建诱饵载体pAbAi-pVvFT,用限制性内切酶Bstb I线性化后转化Y1HGold酵母感受态细胞,涂布于SD/-Ura培养基上培养3 d,挑取单菌落进行PCR验证,结果显示成功构建Y1H-pAbAi-pVvFT诱饵菌株。将其涂布于SD/-Ura和SD/-Ura/AbA(500 ng/mL)培养基上培养,结果(图1)显示,当AbA浓度为500 ng/mL时完全抑制酵母单菌落生长,因此确定AbA的工作浓度为500 ng/mL。
2. 3 cDNA文库构建及互作蛋白筛选
提取的葡萄冬芽总RNA电泳检测结果(图2)显示,28S rRNA条带的亮度约是18S rRNA的2倍,说明总RNA的完整性良好;OD260/OD280为1.94,浓度为4799 ng/μL,说明RNA纯度质量好,可用于cDNA文库的构建。以纯化的mRNA为模板,通过逆转录和LD-PCR获得双链cDNA,再利用CHROMA SPIN TE-400层析柱纯化双链 cDNA,用于构建葡萄冬芽cDNA文库。将cDNA文库和线性化pGADT7-Rec质粒共转化Y1H-pAbAi-pVvFT感受态细胞,涂布于SD/-Leu/AbA(500 ng/mL)培养基上,30 ℃培养3 d,提取阳性克隆质粒进行PCR鉴定,PCR产物用琼脂糖凝胶电泳检测,结果如图3所示。cDNA插入片段的大小不一,阳性克隆所含质粒携带基因大小为500~2000 bp。将38个阳性克隆质粒进行测序,结果获得34条表达序列标签(EST)序列,其中100~500 bp序列占7.7%;501~1000 bp序列占76.9%;大于1000 bp序列占15.3%。
2. 4 EST序列的BLASTx分析和功能注释结果
对测序获得34条EST序列进行BLASTx比对搜索,筛选出期望值e-10以下的序列进行同源对比,并对其进行功能注释,结果发现21条EST为未知功能序列,其余13条EST被功能注释(表2)。13条EST序列与同源基因表现出较高的相似性,仅ft64序列与同源基因的相似性为93%,其他EST序列与同源基因的相似性均大于95%,尤其是ft15和ft41序列与同源基因的相似性高达100%。13条EST序列中,38.46%与植物生长、抗逆防御、信号转导及转录调控相关,其中ft49(休眠相关蛋白)与植物休眠相关,ft64(NAP1相关蛋白)和ft44(GRF1互作因子3)与植物器官生长发育相关,ft70(分子伴侣DnaJ10)与高温胁迫和花芽分化相关,ft41(转录抑制因子ILP1)与基因转录调节相关;38.46%的EST被注释为蛋白酶,包括肽蛋氨酸亚砜还原酶B5(ft15)、角鲨烯环氧酶3(ft19)、S-腺苷甲硫氨酸合成酶(ft42)、氧依赖的粪卟啉原-III氧化酶(ft60)和超氧化物歧化酶(ft68)。
2. 5 VvDnaJ10与VvFT基因启动子互作验证结果
采用同源克隆的方法获得VvDnaJ10基因。通过酵母单杂交点对点鉴定VvDnaJ10与VvFT基因启动子间是否存在互作。将猎物质粒pGADT7-VvDnaJ10转化Y1H-pAbAi-pVvFT菌株感受态细胞,取不同稀释倍数(10-1、10-2、10-3和10-4倍)的感受态细胞涂布于SD/-Leu和SD/-Leu/AbA(200 ng/mL)培养基上,结果(图4)显示,转化菌均在SD/-Leu和SD/-Leu/AbA(200 ng/mL)培养基上有菌落生长,而转化猎物空载体pGADT-7的Y1H-pAbAi-pVvFT和Y1H-pAbAi-p53菌株感受态细胞在SD/-Leu/AbA(200 ng/mL)培养基上均不能生长,表明猎物蛋白VvDnaJ10与VvFT基因启动子之间相互作用激活了报告基因AbA的表达,从而证明VvDnaJ10与VvFT基因启动子存在互作。
3 讨论
基因表达调控网络由顺反作用因子构成。葡萄VvFT基因启动子上游存在13种顺式调控元件。CGTCA-motif和TGACG-motif为MeJA响应元件。MeJA参与植物根的生长、逆境胁迫及开花时间的调控(张旺等,2000;Rakwal et al.,2002;闫志强等,2014)。据文献报道,水稻喷施MeJA不仅有效促进花期提前(闫志强等,2014),还可诱导粳稻不育系开颖,提高作物产量(张旺等,2000)。植物转录因子MYB参与花药和花粉的分化发育调控(钱景华等,2016)。VlFT基因启动子上游的MYB结合位点CAACTG是葡萄控制花器官性别分化的结构基础之一。
ILP1是一种转录抑制因子,与GCF(GC-binding factor)的C端结构域同源。GCF也是一种转录抑制因子,可与表皮生长因子受体(Epidermal growth factor receptor,EGFR)、β-actin和钙依赖蛋白酶基因启动子区域的GC-rich序列相结合(Kageyama and Pastan,1989)。核内再复制是细胞周期的一种,从常规的有丝分裂细胞周期进入可能涉及不同的细胞周期相关基因表达。CYCLINA2(CYCA2)家族的所有成员在ILP1过表达系中的表达均降低。拟南芥中CYCA2;1表达的缺失导致多倍体的增加,证明ILP1通过调控CYCA2基因转录来控制核内再复制(Imai et al.,2006)。
转录共激活因子GIF,即GRF相互作用因子(GRF-interacting factor)是细胞增殖的正向调节因子,在植物体侧器官生长发挥重要作用。GIF蛋白家族由GIF1、GIF2和GIF3组成,与生长调节因子GRF形成功能复合体(Kim and Kende,2004;Horiguchi et al.,2005;Lee et al.,2009)。拟南芥中gif1 gif2 gif3三重突變体表现出严重的花药结构和功能缺陷,既不产生小孢子囊,也不产生花粉粒(Lee et al.,2014)。基因序列分析表明,GIF1是人类SYT(Synovial sarcoma translocation)转录共激活子的功能同源物。Kim和Kende(2004)研究发现GIF1蛋白的N端区域参与其与GRF1的相互作用。grf突变体和gif1突变体的叶片和花瓣较野生型窄,且gif1与grf突变组合表现出协同效应。gif1和grf三倍体的窄叶表型是由沿叶宽轴的细胞数量减少引起。因此,GRF1和GIF1分别是转录激活因子和共激活因子,为调控叶子和花瓣生长及形状复合物的一部分。
组蛋白伴侣伴随初生组蛋白从细胞质到细胞核,参与DNA复制、修复和基因转录过程中染色质的动态调控(Ransom et al.,2010;Avvakumov et al.,2011;Zhu et al.,2013)。NAP1属于H2A-H2B组蛋白分子伴侣。在拟南芥中NAP1相关蛋白(NAP1-rela-ted protein,NRP)NRP1和NRP2的双突变体nrp1-1nrp2-1的根尖细胞周期在G2/M时停止,植株表现出短根和异位根毛等异常表型,进一步分析发现根毛形成关键转录因子基因GLABRA2(GL2)表达水平下降;染色质免疫共沉淀(ChIP)检测结果显示,NRP1和NRP2与位于转录活跃的常染色质上的基因相结合(Zhu et al.,2006)。Zhu等(2017)研究证实,NRP1在体内与转录因子WER相互作用,并以WER依赖的方式在GL2基因启动子区域富集,经结晶学分析发现,NRP1通过N-末端的α-螺旋结构形成二聚体,NRP1的突变体中α-螺旋二聚作用被破坏或C末端的酸性尾巴被移除,从而损害其与组蛋白和WER的结合,无法激活GL2基因转录,导致nrp1-1nrp2-1突变表型异常。干细胞生态位(SCN)的完整性对生物体的发育至关重要。H3/H4组蛋白伴侣染色质组装因子1(CAF-1)和H2A/H2B组蛋白伴侣NAP1相关蛋白1/2(NRP1/2)在拟南芥根SCN维持中发挥协同作用;与m56-1双突变体(NRP1和NRP2缺失)和fas2-4突变体(CAF-1缺失)相比,m56-1fas2-4双突变体的短根表型更严重(Ma et al.,2018)。
DnaJ蛋白家族属于热休克蛋白(Heat-shock proteins,HSPs),作为分子伴侣,其单独或与HSP70伴侣相结合,参与植物发育、信号转导和逆境胁迫的生理过程(Shen et al.,2011;Yang et al.,2009,2010;Zhou et al.,2012)。植物中SVP是抑制FT和SOC1(SUPPRESSOR of the OVEREXPRESSION of CO1)表达的关键开花调控因子。Shen等(2011)研究发现拟南芥中的开花启动子DnaJ同源蛋白3(J3)通过与SVP的相互作用介导开花信号的整合;J3在细胞核中直接与SVP相互作用,阻止SVP与SOC1和FT调节序列相结合,上调SOC1和FT基因表达从而实现花期转变,而J3功能的丧失导致出现晚花表型,推测是由于SOC1和FT的表达降低导致。DnaJ蛋白是细胞的压力传感器,其表达受热、强光和低温诱导(Piippo et al.,2006;Scarpeci et al.,2008;Rajan and DSilva,2009)。高温胁迫常引起植物蛋白质的变性。因此,维持蛋白质的功能构象对植物在高温胁迫下的生存尤为重要(Lee and Vierling,2000;Yang et al.,2010)。研究发现,DnaJ蛋白在重建正常蛋白构象和细胞蛋白稳态过程中发挥分子伴侣的作用(Wang et al.,2004);编码拟南芥DnaJ蛋白的TMS1基因在花粉管的耐热性中发挥重要调控作用(Yang et al.,2009);敲除AtDjB1基因会降低拟南芥的耐熱性(Zhou et al.,2012 )。
为了探究调控葡萄开花时间核心基因VvFT的分子调控机制,更多直接或间接参与调节开花时间的调控因子有待挖掘。进一步通过基因遗传转化及表观遗传学分析等技术手段验证候选调控基因的生物学功能,为研究VvFT基因的功能和分子机理提供参考。
4 结论
通过葡萄冬芽cDNA文库构建及酵母单杂交技术筛选出13个与VvFT启动子区域结合的潜在调控因子基因,其在植物生长、抗逆防御、信号转导、转录调控、蛋白酶等方面均有已知或预测功能的候选调控因子基因。虽然大部分基因预测功能与VvFT调控开花时间无明显的直接关系,但研究结果为进一步探索VvFT转录或表达水平控制葡萄开花时间的分子机制提供了候选基因。
参考文献:
高世敏,董阳,王武,陶建敏. 2018. 葡萄赤霉素合成关键基因VvGA20ox2的克隆、亚细胞定位和表达分析[J]. 江苏农业学报,34(6):1331-1338. [Gao S M,Dong Y,Wang W,Tao J M. 2018. Cloning,subcellular localization and expression analysis of the key gene VvGA20ox2 in gibbere-llin synthesis of grapevine[J]. Jiangsu Journal of Agricultural Sciences,34(6):1331-1338.]
钱景华,李增强,廖小芳,汤丹峰,史奇奇,周瑞阳,陈鹏. 2016. 调控植物花发育的MYB类转录因子研究进展[J]. 生物技术通讯,27(2):283-288. [Qian J H,Li Z Q,Liao X F,Tang D F,Shi Q Q,Zhou R Y,Chen P. 2016. Advance on MYB transcription factors in regulating plant flower development[J]. Leteers in Biotechnology,27(2):283-288.]
闫志强,徐海,马作斌,高东昌,徐正进. 2014. 籼稻与粳稻花时对茉莉酸甲酯(MeJA)响应的敏感性差异[J]. 中国农业科学,47(13):2529-2540. [Yan Z Q,Xu H,Ma Z B,Gao D C,Xu Z J. 2014. Differential response of floret opening to exo-methyl jasmonate between subsp.Indica and subsp. Japonica in rice[J]. Scientia Agricultura Sinica,47(13):2529-2540.]
張旺,曾晓春,周燮,沈惠源,吴天赐. 2000. 茉莉酸甲酯在杂交粳稻制种中的应用研究[J]. 杂交水稻,15(3):15-16. [Zhang W,Zeng X C,Zhou X,Shen H Y,Wu T C. 2000. Application of methyl jasmonate(MeJA) in hybrid seed production of japonica rice[J]. Hybrid Rice,15(3):15-16.]
邹禹,刘园园,钱宝云,占新春,郑乐娅,张炜,张培江. 2019. 水稻高盐胁迫下的酵母双杂交文库构建及OsRPK1胞内互作蛋白质的筛选[J]. 江苏农业学报,35(4):753-763. [Zou Y,Liu Y Y,Qian B Y,Zhan X C,Zheng L Y,Zhang W,Zhang P J. 2019. Construction of yeast two-hybrid cDNA library of rice under high salinity stress and screening of intracellular interacting protein of OsRPK1[J]. Jiangsu Journal of Agricultural Sciences,35(4):753-763.]
An H,Roussot C,Suárez-López P,Corbesier L,Vincent C,Pi?eiro M,Hepworth S,Mouradov A,Justin S,Turnbull C,Coupland G. 2004. CONSTANS acts in the phloem to regulate a systemic signal that induces photoperiodic ?owering of Arabidopsis[J]. Development,131(15):3615-3626.
Avvakumov N,Nourani A,Jacques C?té. 2011. Histone chapero-nes:Modulators of chromatin marks[J]. Molecular Cell,41(5):502-514.
Horiguchi G,Kim G T,Tsukaya H. 2005. The transcription factor AtGRF5 and the transcription coactivator AN3 re-gulate cell proliferation in leaf primordia of Arabidopsis thaliana[J]. The Plant Journal,43(1):68-78.
Imai K K,Ohashi Y,Tsuge T,Yoshizumi T,Matsui M,Oka A,Aoyama T. 2006. The A-type cyclin CYCA2;3 is a key regulator of ploidy levels in Arabidopsis endoreduplication[J]. The Plant Cell,18(2):382-396.
Kageyama R,Pastan I. 1989. Molecular cloning and characteri-zation of a human DNA binding factor that represses transcription[J]. Cell,59(5):815-825.
Kim J H,Kende H. 2004. A transcriptional coactivator,AtGIF1,is involved in regulating leaf growth and morpholo-gy in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,101(36):13374-13379.
Lee B H,Ko J H,Lee S,Lee Y,Pak J H,Kim J H. 2009. The Arabidopsis GRF-INTERACTING FACTOR gene family performs an overlapping function in determining organ size as well as multiple developmental properties[J]. Plant Physiology,151(2):655-668.
Lee B H,Wynn A N,Franks R G,Hwang Y S,Lim J,Kim J H. 2014. The Arabidopsis thaliana GRF-INTERACTING FACTOR gene family plays an essential role in control of male and female reproductive development[J]. Develop-mental Biology,386(1):12-24.
Lee G J,Vierling E. 2000. A small heat shock protein coopera-tes with heat shock protein 70 systems to reactivate a heat-denatured protein[J]. Plant Physiology,122(1):189-198.
Lee J H,Yoo S J,Park S H,Hwang I,Lee J S,Ahn J H. 2007. Role of SVP in the control of flowering time by ambient temperature in Arabidopsis[J]. Genes Development,21(4):397-402.
Li D,Liu C,Shen L,Wu Y,Chen H,Robertson M,Helliwell C A,Ito T,Meyerowitz E,Yu H. 2008. A repressor complex governs the integration of ?owering signals in Arabidopsis[J]. Developmental Cell,15(1):110-120.
Liu L,Liu C,Hou X L,Xi W Y,Shen L S,Tao Z,Wang Y,Yu H. 2012. FTIP1 is an essential regulator required for florigen transport[J]. PLoS Biology,10(4):e1001313.
Ma J,Liu Y,Zhou W,Zhu Y,Dong A W,Shen W H. 2018. Histone chaperones play crucial roles in maintenance of stem cell niche during plant root development[J]. Plant Journal,95(1):86-100.
Mimida N,Kidou S I,Iwanami H,Moriya S,Abe K,Voogd C,Varkonyi-Gasic E,Kotoda N. 2011. Apple FLOWERING LOCUS T proteins interact with transcription factors implicated in cell growth and organ development[J]. Tree Physiology,31(5):555-566.
Piippo M,Allahverdiyeva Y,Paakkarinen V,Suoranta U M,Battchikova N,Aro E M. 2006. Chloroplast-mediated re-gulation of nuclear genes in Arabidopsis thaliana in the absence of light stress[J]. Physiological Genomics,25(1):142-152.
Rajan V B,DSilva P. 2009. Arabidopsis thaliana J-class heat shock proteins:Cellular stress sensors[J]. Functional & Integrative Genomics,9(4):433-446.
Rakwal R,Tamogami S,Agrawal G K,Iwahashi H. 2002. Octadecanoid signaling component “burst” in rice(Oryza sativa L.) seedling leaves upon wounding by cut and treatment with fungal elicitor chitosan[J]. Biochemical and Biophysical Research Communications,295(5):1041-1045.
Ransom M,Dennehey B K,Tyler J K. 2010. Chaperoning histones during DNA replication and repair[J]. Cell,140(2):183-195.
Scarpeci T E,Zanor M I,Carrillo N,Mueller-Roeber B,Valle E M. 2008. Generation of superoxide anion in chloroplasts of Arabidopsis thaliana during active photosynthesis:A focus on rapidly induced genes[J]. Plant Molecular Biology,66(4):361-378.
Searle I,He Y,Turck F,Vincent C,Fornara F,Kr?ber S,Amasino R A,Coupland G. 2006. The transcription factor FLC confers a flowering response to vernalization by repressing meristem competence and systemic signaling in Arabidopsis[J]. Genes Development,20(7):898-912.
Seo E,Yu J,Ryu K H,Lee M M,Lee I. 2011. WEREWOLF,a regulator of root hair pattern formation,controls ?owering time through the regulation of FT mRNA stability[J]. Plant Physiology,156(4):1867-1877.
Shen L,Kang Y G,Liu L,Yu H. 2011. The J-domain protein J3 mediates the integration of ?owering signals in Arabidopsis[J]. The Plant Cell,23(2):499-514.
Tiwari S B,Shen Y,Chang H C,Hou Y,Harris A,Ma SF,McPartland M,Hymus G J,Adam L,Marion C,Belachew A,Repetti P P,Reuber T L,Ratcliffe O J. 2010. The ?owering time regulator CONSTANS is recruited to the FLOWERING LOCUS T promoter via a unique cis-element[J]. New Phytologist,187(1):57-66.
Wang W,Vinocur B,Shoseyov O,Altman A. 2004. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J]. Trends Plant in Science,9(5):244-252.
Wickland D,Hanzawa Y. 2015. The FLOWERING LOCUS T/TERMINAL FLOWER 1 gene family:Functional evolution and molecular mechanisms[J]. Molecular Plant,8(7):983-997.
Yang K Z,Xia C,Liu X L,Dou X Y,Wang W,Chen L Q,Zhang X Q,Xie L F,He L,Ma X,Ye D. 2009. A mutation in THERMOSENSITIVE MALE STERILE 1,enco-ding a heat shock protein with DnaJ and PDI domains,leads to thermosensitive gametophytic male sterility in Arabidopsis[J]. The Plant Journal,57(5):870-882.
Yang Y,Qin Y,Xie C,Zhao F,Zhao J,Liu D,Chen S,Fuglsang A T,Palmgren M G,Schumaker K S,Deng X W,Guo Y. 2010. The Arabidopsis chaperone J3 regulates the plasma membrane H+-ATPase through interaction with the PKS5 kinase[J]. The Plant Cell,22(4):1313-1332.
Zhou W,Zhou T,Li M X,Zhao C L,Jia N,Wang X X,Sun Y Z,Li G L,Xu M,Zhou R G,Li B. 2012. The Arabidopsis J-protein AtDjB1 facilitates thermo tolerance by protecting cells against heat-induced oxidative damage[J]. New Phytologist,194(2):364-378.
Zhu Y,Dong A,Meyer D,Pichon O,Renou J P,Cao K,Shen W H. 2006. Arabidopsis NRP1 and NRP2 encode histone chaperones and are required for maintaining postem-bryonic root growth[J]. The Plant Cell,18(11):2879-2892.
Zhu Y,Dong A,Shen W H. 2013. Histone variants and chromatin assembly in plant abiotic stress responses[J]. Biochimica et Biophysica Acta-Gene Regulatory Mechanisms,1819(3-4):343-348.
Zhu Y,Rong L,Luo Q,Wang B H,Zhou N N,Yang Y,Zhang C,Feng H Y,Zheng L N,Shen W H,Ma J B,Dong A W. 2017. The histone chaperone NRP1 interacts with WEREWOLF to activate GLABRA2 in Arabidopsis root hair development[J]. The Plant Cell,29(2):260-276.
(責任编辑 陈 燕)

