江西地区鼠源致病性钩端螺旋体菌的分离纯化与鉴定*
孙 毅 戴宗浩 彭梦华 叶俊华 徐 黎 刘占斌
(1.江西农业大学,南昌 330045)(2.公安部南昌警犬基地,南昌 330100)
钩端螺旋体(Leptospiraspp.简称钩体)是一种极难培养且生长缓慢的需氧型革兰阴性螺旋体原虫[1],种类很多,可分为致病性和非致病性钩端螺旋体两大类。致病性钩端螺旋体能导致人和动物患钩端螺旋体病(Leptospirosis,简称钩体病)。钩体病是在世界各地都广泛流行的一种人畜共患病,中国绝大多数地区都有不同程度的流行,对人畜健康造成很大危害,是中国重点防治的传染病之一。鼠和啮齿动物是其主要传染源,家畜,特别是猪,犬,牛等是钩体非常重要的储存宿主和传染源[2]。动物中, 犬钩端螺旋体的感染率较高,大多呈隐性感染,钩体在肾脏中长期存在,通过尿液持续向外排菌[3]。钩体病在工作犬群中时有发生,影响工作犬的繁殖、训练与使用,经调查,该病的发生与该地带菌鼠关系密切,因此我们在江西某些养犬场通过捕捉褐家鼠(Rattusnorvegicus)来进行钩端螺旋体的分离培养,菌株的纯化,并进行PCR检测以探明感染源。
1 材料与方法
1.1 材料
1.1.1动物来源:钩端螺旋体的储存宿主动物褐家鼠是通过捕鼠笼在江西某些犬场大量捕捉,共捕获约20只;金黄地鼠16只,雌雄各8只,4周龄,体质量在30~40 g,购自北京维通利华实验动物技术有限公司,许可证: SCXK(京)2016-0006)。
1.1.2主要仪器:GenAmp PCR仪购自Applied Biosystems公司;DYY-Ⅲ-12B电泳仪购自北京六一仪器厂;凝胶成像系统购自上海培清科技有限公司;CO2恒温培养箱购自Thermo Fisher公司。
1.1.3主要试剂:核酸提取试剂盒购自天根生化科技(北京)有限公司;Taq DNA酶Mix和500 bp DNA Marker购自TaKaRa公司;琼脂糖和染色剂,磺胺甲恶唑、甲氧苄啶、两性霉素B等药物购自生工生物工程(上海)股份有限公司;EMJH培养基购自吉林大学动物医学院实验室。
1.2 方法
1.2.1病料的采集:本实验采用背部解剖褐家鼠[2]取肾脏的方法,无菌操作摘取双侧肾脏;
1.2.2钩端螺旋体的培养及观察:将上述肾脏组织剪成米粒大小分别接种于3 mL EMJH培养基中培养。将培养管置于28 ℃的恒温培养箱中培养。每周取一次培养物制片(取5 μL培养液置于载玻片上,盖上盖玻片),用暗视野显微镜观察有无钩端螺旋体生长,如有,则接种于新鲜培养基中。如无生长,继续培养观察60 d,仍无菌生长作为阴性处理。
1.2.3钩端螺旋体的纯化:由于钩体生长缓慢,培养时间较长,培养基营养丰富,因此不论是从尿液、血液还是脏器中分离钩体,难免会被污染。若镜检发现暗视野中全是杂菌,并未发现有钩体生长的培养物,我们选择弃之。对于污染轻的培养物,即一个暗视野中能分辨出有钩体生长,可以采用以下方法纯化:
(1)药物纯化:虽然EMJH培养基中添加了5 氟尿嘧啶,还是会有杂菌生长。可以添加以下几种药物,能有效杀死或抑制杂菌生长,而对钩端螺旋体生长无影响,磺胺甲恶唑 400 μg/mL,甲氧苄啶 200 μg/mL,两性霉素B 50 μg/mL[4],使用0.22针头式过滤器过滤,并储存于-20 ℃保存,按1∶10的比例加到EMJH培养基中混匀使用。
(2)生物过滤法[2]:将污染有杂菌的钩端螺旋体培养物1 mL接种于50~80 g金黄地鼠腹腔内,一般在1~2 h内以无菌操作采集心血,2~3滴血液到培养基中,经培养可得到纯的钩端螺旋体。
1.2.4引物设计和DNA提取:通过查阅相关文献[5]得到引物序列详细信息见表1,将该引物序列于NCBI数据库中BLAST进行验证,以确保引物具有高度特异性为目的,将钩端螺旋体基因引物序列由生工生物工程(上海)股份有限公司进行合成。

表1 引物名称、序列及扩增片段Table 1 The names,sequences and amplification fragments of the primers
对纯培养分离菌株、感染钩体死亡的金黄地鼠的肾脏组织分别用细菌基因组DNA提取试剂盒、血液/细胞/组织基因组DNA提取试剂盒按提示抽提基因组DNA。
1.2.5PCR扩增及基因序列鉴定:以纯培养分离菌株和感染钩体死亡的金黄地鼠的肾脏组织染色体DNA为模板, 扩增其钩体外膜脂蛋白LipL32基因片段。
PCR反应体系:DNA 1.5 μL,引物F 1 μL,引物R 1 μL,Taq mix 酶12.5 μL,水9 μL,总体积25 μL。
PCR反应条件:第一个循环包括94 ℃ 3 min,63 ℃ 1.5 min,72 ℃ 2 min,接下来的29个循环包括94 ℃ 1 min,63 ℃ 1.5 min,72 ℃ 2 min,最后72 ℃延伸10 min[6]。
反应结束后,取10 μL扩增产物,用2%琼脂糖凝胶(含0.5 μg/mL EB)电泳检测PCR产物,在紫外灯下观察, 使用数字凝胶成像系统记录实验结果。将PCR阳性的纯培养菌株的扩增产物送生工生物工程(上海)股份有限公司测序。
1.2.6动物感染实验:对28 ℃恒温箱纯培养的菌株,进行平板菌落计数,调整菌液浓度约为107条/mL。分别取菌液腹腔注射8只4周龄,体质量30~40 g的金黄地鼠, 1.5 mL/只, 接种后观察并记录发病死亡情况。无菌操作从死亡的金黄地鼠肝脏、肾脏分离接种菌, 剖解观察病变。对照组金黄地鼠注射同剂量的无菌EMJH培养基。
2 结果
2.1 钩端螺旋体的形态学观察
通过褐家鼠肾脏接种培养及后期菌株的纯化最终从褐家鼠肾脏中纯培养出一株钩端螺旋菌。在暗视野显微镜下观察(见图1),可看到钩体的一端或两端弯曲成钩状为其特点,呈C、S形,钩端螺旋体运动活泼,其运动方式主要是沿着长轴旋转,菌体中央部分较僵直,两端比较柔软,扭曲运动。

图1 400倍暗视野显微镜下观察到的钩端螺旋体Fig.1 Leptospira observed under a ×400dark field microscope
2.2 PCR扩增结果
用钩端螺旋体的特异性引物对纯培养分离菌株和肾脏组织提出的DNA进行PCR扩增,均能等得到331 bp的特异性条带(见图2)。
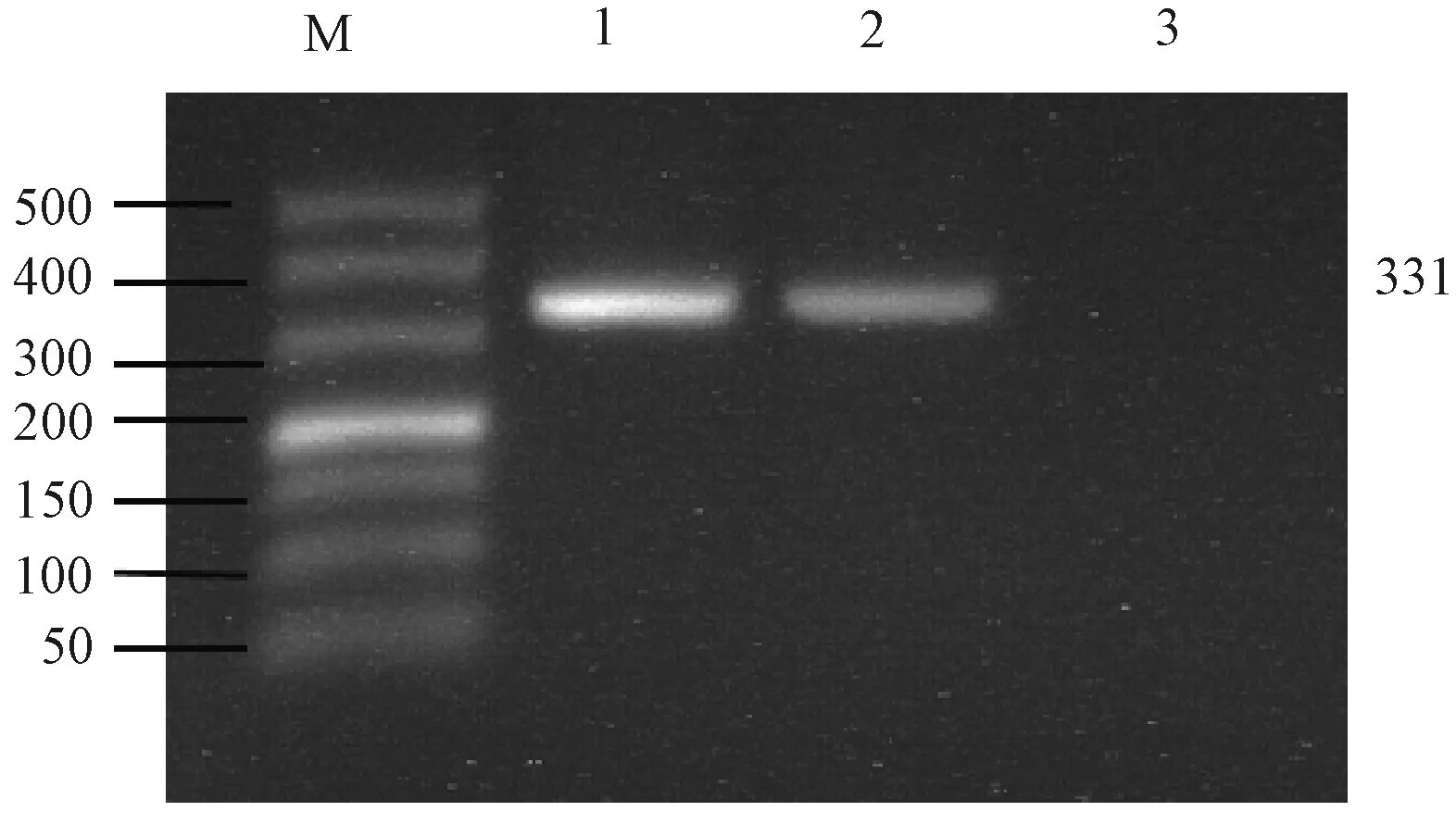
图2 特异性PCR扩增结果注:M:500 bp Marker 1:菌液DNA 2:肾脏组织DNA 3:阴性对照Fig.2 Results of specific PCRNote: M: 500 bp Marker 1: bacterial solution DNA2: kidney tissue DNA 3: negative control
将纯培养分离菌株PCR扩增产物送去生工生物工程(上海)股份有限公司进行基因测序,将测序的结果通过NCBI的BLAST序列比对,经核苷酸序列测定分析证实上述序列与钩端螺旋体菌FDAARGOS_203基因序列 (GenBank登录号:CP020414.2) 同源性为100%,证明所分离到的菌是钩端螺旋体菌。
2.3 动物实验结果
结果显示,金黄地鼠在攻毒3 d后陆续出现发病症状,表现为高热、全身颤抖、精神不振、食欲减退,第4至5天发现金黄地鼠陆续死亡,从死亡金黄地鼠肝脏、肾脏均能分离到接种菌,剖解死亡的金黄地鼠,可见皮肤黄疸(见图3)、肺出血(见图4)、肝脏变性坏死(见图5)、肾肿大,出血(见图6)。对照组金黄地鼠全部健活。
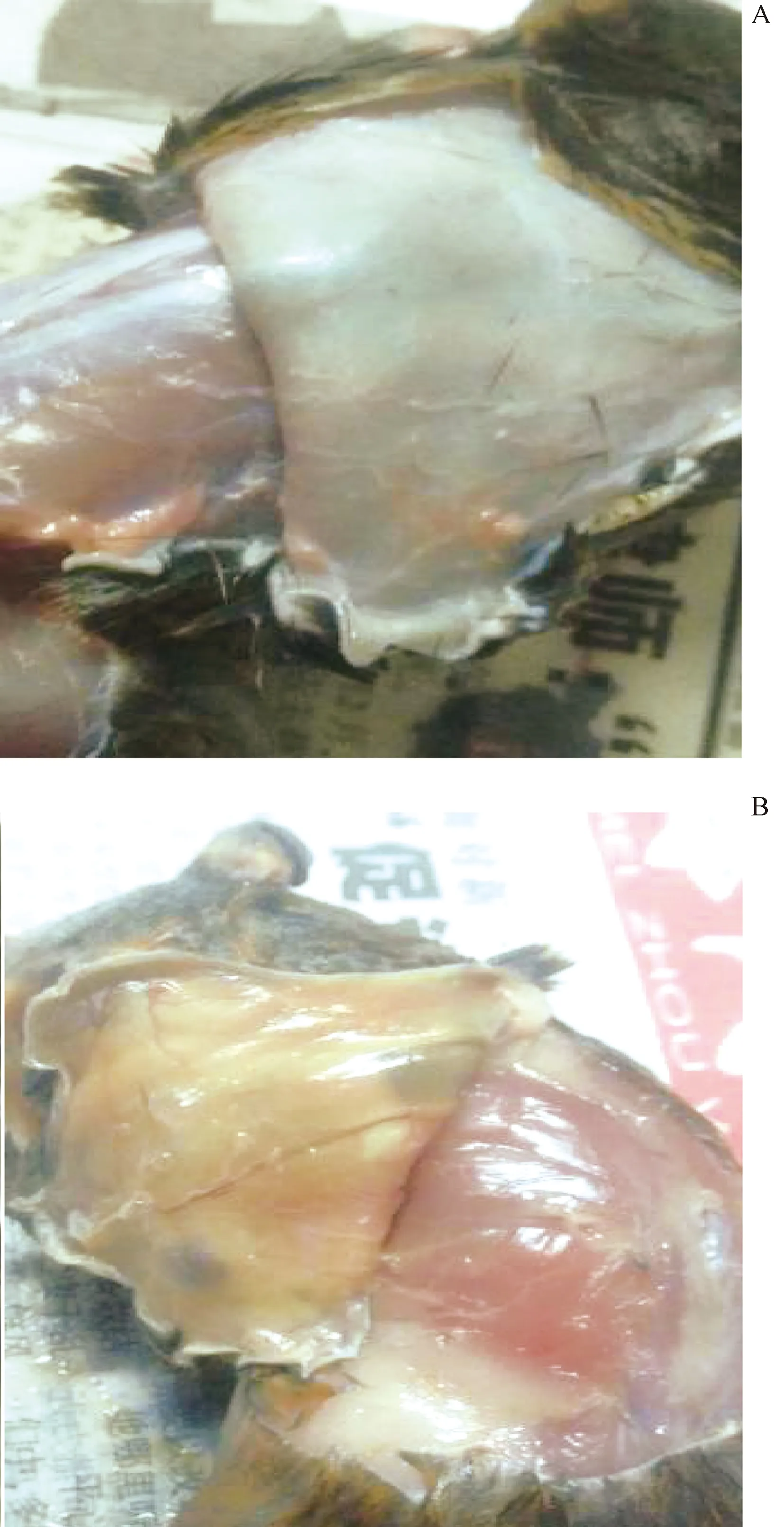
图3 A图为健康鼠皮肤黏膜,B图为感染钩体死亡的鼠皮肤黏膜黄疸症状Fig.3 The picture A is the skin mucosa of healthy rats, and the picture B is the symptoms of jaundice in the skin of rats infected with leptospirosis

图4 肺脏出血Fig.4 Lung bleeding
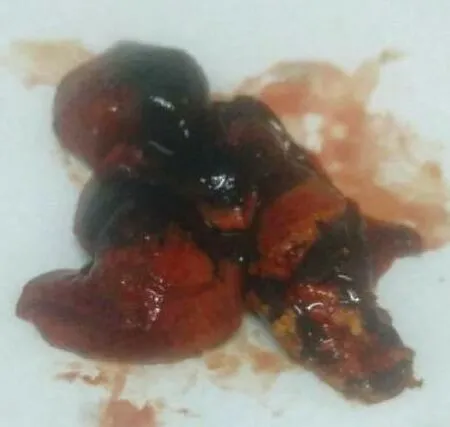
图5 肝脏变性坏死Fig.5 Liver degeneration and necrosis

图6 肾脏肿大、充血Fig.6 Kidney enlargement, congestion
3 讨论
我国钩端螺旋体病疫区分布广泛,主要分布在北纬 25°~35°,东经 100°~129°之间,该区域也是长江流域的一些省份[7],由于该菌菌型复杂,据1986年国际微生物学会统计,全世界已发现的钩体共有 23个血清群,200个血清型,各地流行种类和分布存在极大的差异性,同时由于各型之间缺乏交叉免疫,导致该病的诊断和预防具有一定的区域特异性。江西省作为钩体病的老疫区,每年的钩体病发病率远高于全国平均发病率[6]。污染的水源以及带菌的黑线姬鼠、黄毛鼠、褐家鼠等啮齿类动物等[8]是重要的感染源。金黄地鼠(Golden hamster;Mesocricetusauratus)是钩端螺旋体试验比较理想的敏感动物,特别是对各群(型)致病性钩端螺旋体均具有一定的敏感性。解剖检查亦可见到比较明显的肉眼病变,一般以4~6周龄(20~50 g)的金黄地鼠为佳[2],故本实验研究选择金黄地鼠作为检测钩端螺旋体致病性的易感动物。
本实验我们以分离到江西地区本地钩端螺旋体菌株为出发点,通过对钩端螺旋体菌的储存宿主褐家鼠进行肾脏分离培养,污染菌株的纯化,形态学观察以及PCR基因测序等试验对该病菌进行鉴定,证实我们培养纯化出一株江西地区的钩端螺旋体菌,通过钩端螺旋体的易感动物金黄地鼠进行动物回归实验,结果表明,金黄地鼠出现临床症状,从死亡金黄地鼠肝脏、肾脏均能分离到接种菌,因此我们得出的结论是:从江西地区鼠源中分离到一株钩端螺旋体菌且具有致病性。家鼠感染钩体后发病轻微呈慢性带菌状态,而金黄地鼠作为钩体感染敏感动物表现为急性发病且致死。表明该病原能影响动物健康状况。同时,由于钩体能感染人类,病菌入侵肾脏、肺和心脏可危及生命,是一种要引起大家重视的人畜共患菌,因此,对实验动物进行病原的调查和排除是非常重要和必要的[9]。
钩端螺旋体病对于犬的安全隐患很大,该地区犬场时有犬钩端螺旋体病的发生,分离到的钩体致病力强,表明该犬场中感染鼠作为本病的重要传染源,因此开展灭鼠是预防犬发生本病的重要措施,同时,加强饲养管理,合理调配营养,规划犬舍,适当运动,增强犬的体质,也是重要预防措施。此外,犬舍的建设要干燥、朝阳及消毒,保持犬舍干燥,充分利用阳光、干燥等方式杀灭环境中的钩体,以减少钩端螺旋体生存的条件[10]。
本次研究通过对钩端螺旋体的分离、培养、纯化等方法的掌握,为后期分离野生鼠或患钩体病的犬身上的钩端螺旋体菌株累积了宝贵的经验,也为后期建立江西地区钩端螺旋体菌株的发病模型提供菌源奠定基础。

