免疫调节剂对肺结核合并2型糖尿病患者临床效果的影响
李小月,张艳丽,陈 厦,杨红叶
肺结核是一种慢性呼吸道传染病,主要由结核分枝杆菌引起,全球每年约有300万人死于结核病[1-2]。我国肺结核的发病率较高,且呈逐年上升趋势[3],发病率位居世界第二[4]。然而,2型糖尿病患者肺结核的发病率更高,是非糖尿病患者的4倍[5-6]。2型糖尿病与肺结核相互影响、相互作用,形成恶性循环[7],并且合并上述两种疾病的患者,其抗结核治疗失败、病死及病情复发的风险均较高[8]。有研究显示,预防性应用免疫调节剂能够显著改善肺结核患者的免疫功能[9]。本研究探讨免疫调节剂对肺结核合并2型糖尿病患者临床效果的影响,现将结果报告如下。
1 资料与方法
1.1一般资料 选取2018年1—10月中国人民解放军联勤保障部队第九八〇医院收治的新发肺结核合并2型糖尿病86例作为研究对象,按照治疗方法的不同,分为观察组与对照组,每组各43例。观察组男27例,女16例;年龄45~82(63.77±8.55)岁;肺结核病程3.21~90.80(15.64±3.82)d;糖尿病病程0.46~10.48(4.25±1.25)年。对照组男23例,女20例;年龄47~76(61.70±6.50)岁;肺结核病程4.13~95.27(16.10±4.06)d;糖尿病病程0.50~10.09(3.92±1.07)年。两组一般资料比较无统计学差异(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者及家属知情并自愿参与本研究。
1.2纳入及排除标准 纳入标准:①符合《临床诊疗指南结核病分册》[10]制定的“肺结核诊断标准”,且痰涂片抗酸杆菌阳性;②符合“中国2型糖尿病防治指南(2013年版)”[11]制定的“2型糖尿病诊断标准”;③对本研究所用药物无过敏。排除标准:①合并其他系统严重疾病者;②妊娠期、哺乳期女性;③入院前1年内接受过影响免疫功能治疗者。
1.3治疗方法 对照组口服格列美脲联合2HRZE/4HR(H代表异烟肼,R代表利福平,Z代表吡嗪酰胺,E代表乙胺丁醇)方案治疗,具体方法为早餐时口服格列美脲(江苏万邦生化医药股份有限公司生产,国药准字H20010575,每片2 mg)2 mg/d,同时每日检测血糖,根据血糖检测结果调整药量;强化期口服异烟肼(杭州民生制药有限公司生产,国药准字H33021636,每片0.1 g)0.3 g/d,空腹口服吡嗪酰胺(沈阳红旗制药有限公司生产,国药准字H21022354,每片0.25 g)0.5 g、3/d,口服利福平(沈阳红旗制药有限公司生产,国药准字H21021905,每粒0.15 g)0.45 g/d或0.6 g/d(体重<50 kg用量为0.45 g/d,体重≥50 kg用量为0.6 g/d),口服盐酸乙胺丁醇(杭州民生制药有限公司生产,国药准字H33021602,每片0.25 g)0.75 g/d,连续口服2个月后开始巩固期治疗,即停用吡嗪酰胺、盐酸乙胺丁醇,继续按上述剂量服用异烟肼、利福平,连续口服4个月。观察组在对照组治疗的基础上给予注射用胸腺肽α1(苏州天马医药集团天吉生物制药有限公司生产,国药准字H20103201,每支1.6 mg)1.6 mg/d皮下注射,每周2次,连续治疗6个月。
1.4观察指标
1.4.1临床疗效比较:两组均于治疗6个月时评定临床疗效,按照结核中毒好转程度[12]分为显效、有效及无效,即临床症状(如咳嗽、咳痰、咯血、发热、盗汗、胸闷等)完全消失为显效,临床症状减轻为有效,临床症状无改善甚至恶化为无效。总有效=显效例数+有效例数。
1.4.2痰涂片抗酸杆菌转阴率:两组均于治疗2个月及治疗6个月时进行痰涂片抗酸杆菌检查,结果均为阴性且不再复阳则记为转阴,计算痰涂片抗酸杆菌转阴率。
1.4.3病灶吸收情况:采用胸部X线检查观察两组治疗6个月时病灶吸收情况:①完全吸收:X线显示患者肺部病灶消失;②明显吸收:X线显示患者肺部剩余病灶等于或少于原病灶面积的1/2;③吸收:X线显示患者肺部剩余病灶大于原病灶面积的1/2;④无效:X线显示患者肺部病灶未见吸收,甚至扩大或弥散[13]。总有效=完全吸收例数+明显吸收例数+吸收例数。
1.4.4外周血白细胞介素2受体(soluble interleukin-2 receptor, sIL-2R)、γ-干扰素(interferon γ, IFN-γ)检测:两组均于治疗前、治疗2个月及治疗6个月时空腹抽取外周静脉血5 ml,采用酶联免疫吸附法测定外周血sIL-2R及IFN-γ的水平。
1.4.5血清CD3+、CD4+及CD8+检测:两组均于治疗前、治疗6个月时空腹抽取外周静脉血5 ml,以3000 r/min的速度离心10 min,留取上清液,采用流式细胞仪分析法测定血清CD3+、CD4+及CD8+水平。
1.4.6血糖相关指标检测:两组均于治疗前、治疗6个月时空腹状态及早餐后2 h抽取外周静脉血5 ml,采用贝克曼AU5800全自动生化仪检测空腹血糖(fasting blood glucose, FBG)、餐后2 h血糖(2hPG)及糖化血红蛋白(HbAlc)。
1.4.7不良反应发生情况:观察两组治疗期间胃肠道反应、肝功能受损、皮疹及白细胞降低的发生情况。

2 结果
2.1临床疗效比较 观察组治疗总有效率高于对照组,比较差异有统计学意义(χ2=4.440,P=0.035)。见表1。
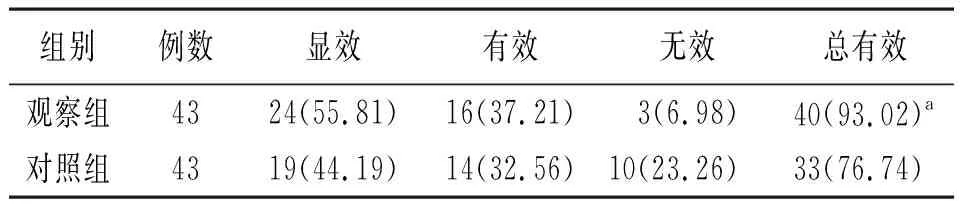
表1 采用不同治疗方法的肺结核合并2型糖尿病两组临床疗效比较[例(%)]
注:观察组予注射用胸腺肽α1、格列美脲联合抗结核治疗,对照组予格列美脲联合抗结核治疗;与对照组比较,aP<0.05
2.2痰涂片抗酸杆菌转阴率比较 观察组、对照组痰涂片抗酸杆菌转阴率分别为90.70%(39/43)、72.09%(31/43),比较差异有统计学意义(χ2=4.914,P=0.027)。
2.3病灶吸收情况比较 观察组病灶吸收总有效率高于对照组,比较差异有统计学意义(χ2=4.962,P=0.026)。见表2。

表2 采用不同治疗方法的肺结核合并2型糖尿病两组病灶吸收情况比较[例(%)]
注:观察组予注射用胸腺肽α1、格列美脲联合抗结核治疗,对照组予格列美脲联合抗结核治疗;与对照组比较,aP<0.05
2.4sIL-2R、IFN-γ水平比较 两组治疗前sIL-2R、IFN-γ水平比较差异无统计学意义(P>0.05);与对照组比较,观察组治疗2个月、治疗6个月时sIL-2R水平降低,IFN-γ水平升高,差异有统计学意义(P<0.05或P<0.01);与本组治疗前比较,两组治疗2个月、治疗6个月时sIL-2R水平降低,IFN-γ水平升高,差异有统计学意义(观察组:t=9.220、P<0.001,t=10.710、P<0.001,t=-4.790、P<0.001,t=-7.190、P<0.001;对照组:t=3.950、P<0.001,t=4.470、P<0.001,t=-2.530、P=0.020,t=-5.330、P<0.001)。见表3。

表3 采用不同治疗方法的肺结核合并2型糖尿病两组sIL-2R、IFN-γ水平比较
注:观察组予注射用胸腺肽α1、格列美脲联合抗结核治疗,对照组予格列美脲联合抗结核治疗;sIL-2R指白细胞介素2受体,IFN-γ指γ-干扰素;与本组治疗前比较,aP<0.05,bP<0.01
2.5CD3+、CD4+及CD8+水平比较 两组治疗前CD3+、CD4+及CD8+水平比较差异无统计学意义(P>0.05);与对照组比较,观察组治疗6个月CD3+、CD4+水平升高,CD8+水平降低,差异有统计学意义(P<0.01);与本组治疗前比较,观察组治疗6个月CD3+、CD4+水平升高,CD8+水平降低,差异有统计学意义(t=-12.860、P<0.001,t=-17.220、P<0.001,t=13.490、P<0.001)。见表4。
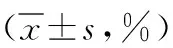
表4 采用不同治疗方法的肺结核合并2型糖尿病两组CD3+、CD4+及CD8+水平比较
注:观察组予注射用胸腺肽α1、格列美脲联合抗结核治疗,对照组予格列美脲联合抗结核治疗;与本组治疗前比较,bP<0.01
2.6血糖相关指标比较 两组治疗前、治疗6个月FBG、2hPG及HbAlc水平比较差异无统计学意义(P>0.05);与本组治疗前比较,两组治疗6个月FBG、2hPG及HbAlc水平下降,差异有统计学意义(观察组:t=7.150、P<0.001,t=14.500、P<0.001,t=7.760、P<0.001;对照组:t=10.660、P<0.001,t=11.550、P<0.001,t=9.350、P<0.001)。见表5。

表5 采用不同治疗方法的肺结核合并2型糖尿病两组血糖相关指标比较
注:观察组予注射用胸腺肽α1、格列美脲联合抗结核治疗,对照组予格列美脲联合抗结核治疗;与本组治疗前比较,bP<0.01
2.7不良反应发生情况比较 两组胃肠道反应、肝功能损伤及不良反应总发生率比较差异有统计学意义(P<0.05或P<0.01)。见表6。
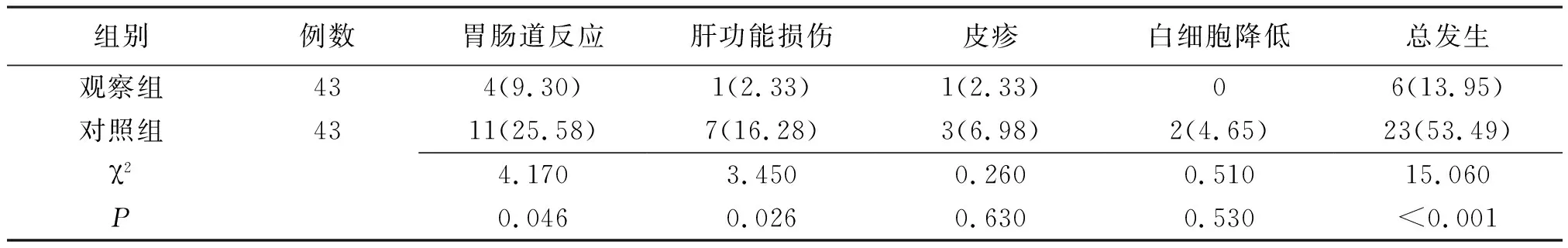
表6 采用不同治疗方法的肺结核合并2型糖尿病两组不良反应发生情况比较[例(%)]
注:观察组予注射用胸腺肽α1、格列美脲联合抗结核治疗,对照组予格列美脲联合抗结核治疗
3 讨论
肺结核与糖尿病均是临床常见病,两种疾病相互影响,具有病程进展快、耐药率高、治疗效果差、患者预后差及易复发等特点[14]。糖尿病是肺结核发生及复发的危险因素,亦给患者的身心健康造成极大影响,同时也加重了我国卫生系统负担。目前研究认为糖尿病患者代谢功能障碍是糖尿病与肺结核关系密切的原因,糖尿病患者神经-内分泌功能紊乱,易并发高胆固醇血症,为结核分枝杆菌提供了生存及增殖的条件,与此同时,糖尿病患者免疫系统功能下降,削弱了机体免疫系统对结核分枝杆菌的杀灭作用,加之血糖控制不佳能够影响肺结核的治疗效果,同时肺结核未及时控制亦能够加重机体糖代谢紊乱[15-16]。
肺结核合并糖尿病患者的免疫反应主要由T淋巴细胞介导,在T淋巴细胞介导的细胞免疫中,参与免疫反应的细胞亚群主要有CD3+、CD4+、CD8+等。CD4+T淋巴细胞可以发挥辅助诱导作用,促进巨噬细胞局限性杀伤结核杆菌[17-18];CD8+T淋巴细胞则引起巨噬细胞溶解,从而致结核杆菌扩散。有研究报道CD8+T淋巴细胞可有效抑制机体细胞免疫反应,其比例相对降低时可间接增加CD4+T淋巴细胞比例,将结核分枝杆菌局限于病灶中[19]。有研究证实,结核感染患者的CD3+、CD4+、CD4+/CD8+水平下降,免疫机能降低[20]。单纯给予常规抗结核治疗无法直接纠正异常免疫功能,故早期提高患者的细胞免疫功能是提高治疗成功率的重要环节[21]。
有研究证实,在肺结核患者的治疗中增加免疫调节剂能够有效改善患者的免疫功能,促进患者恢复[22]。胸腺肽α1由胸腺上皮细胞和胸腺内分泌细胞产生,是胸腺激素中活性最强的成分,具有胸腺肽类第Ⅴ组中所有的免疫活性,能够起到抗肿瘤、抗凋亡、抗感染及免疫调节等作用[22-23]。有研究认为,早期应用胸腺肽α1注射剂可显著增强细胞免疫功能,进而及时控制肺结核患者的病情[24]。刘健春等[25]在常规抗结核和降糖治疗的基础上,应用胸腺肽注射液皮下注射治疗3个月,两组CD3+水平无明显差异,但观察组CD4+、CD4+/CD8+水平明显高于对照组且CD8+水平显著低于对照组,同时两组空洞闭合比例、病灶吸收比例及痰菌阴转比例差异均有统计学意义。
本研究联合应用格列美脲、免疫调节剂及常规抗结核治疗,结果显示,观察组治疗6个月时CD3+及CD4+水平均高于对照组,CD8+水平低于对照组,表明胸腺肽α1能够显著改善患者的免疫功能。由于胸腺肽α1的特殊生物活性,能够靶向调节T淋巴细胞的发育和分化,促进自然杀伤细胞、CD4+、CD3+的产生,诱导树突状细胞成熟分化,进而增强机体细胞免疫的作用。
sIL-2R是一种免疫抑制物质,是活化的淋巴细胞及单核细胞产生的多肽,由细胞膜脱落后进入血液,其水平升高会减弱白细胞介素-2R对人体的保护作用,抑制T淋巴细胞增殖,使活化的淋巴细胞处于衰竭状态[26]。IFN-γ是一种由辅助性T淋巴细胞1分泌的免疫调节因子,能够激活单核细胞,使其聚集在病灶周围,控制感染的扩散,促进结核肉芽肿的形成,同时增强巨噬细胞的杀菌作用[27]。本研究结果显示,观察组治疗2个月及治疗6个月外周血sIL-2R水平均低于对照组,IFN-γ水平均高于对照组,说明联合胸腺肽α1能够显著调节机体的免疫功能,增强辅助性T淋巴细胞活性,从而减少sIL-2R分泌,促进IFN-γ表达。
本研究结果显示,观察组临床治疗总有效率、痰涂片抗酸杆菌转阴率及病灶吸收总有效率均高于对照组,说明联合胸腺肽α1能够有效缓解患者临床症状;两组治疗6个月FBG、2hPG及HbAlc水平均明显低于本组治疗前,但组间比较差异无统计学意义,考虑与两组均采用格列美脲控制血糖有关,故研究结果仅能说明格列美脲的降糖效果显著,能够有效维持患者糖代谢功能稳定;观察组不良反应总发生率明显低于对照组,表明格列美脲联合胸腺肽α1治疗肺结核合并糖尿病患者能显著降低抗结核治疗不良反应发生。
综上所述,格列美脲联合免疫调节剂对肺结核合并糖尿病患者的效果显著,能够显著降低血清sIL-2R水平,提高IFN-γ水平,恢复患者免疫功能,降低血糖及不良反应,促进患者康复。

