高效液相色谱法测定黄酒发酵醪液中生物胺含量
牛天娇,郭永杰,孙二娜,马莺
(1.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨150001;2.蒙牛高科乳制品(北京)有限责任公司,北京101107)
生物胺是一种由有机生物体产生的含氮的小分子碱性有机化合物的总称,适量的生物胺是人体的正常活性成分[1],而过量的生物胺则会引起血管、动脉的扩张,导致生物体出现头疼、心慌、腹泻、腹部抽搐和呼吸紊乱等一系列不良症状,严重时还会危及生命[2]。发酵食品中含有丰富的营养物质,具有大量的蛋白质,在蛋白酶和微生物的共同作用下会产生大量的生物胺,水产发酵制品[3]、肉制品[4]、乳制品[5]、酒中[6]均有生物胺,尤其是黄酒[7]中。
中国黄酒酿造历史悠久,因其独特的风味和高营养价值而深受国人的喜爱。黄酒主要以谷物、稻米等为原料,经过酵母、霉菌和细菌的共同发酵而成[8-10]。丰富的微生物体系产生大量的蛋白酶和氨基酸脱羧酶[11-12],蛋白酶将黄酒发酵过程中的蛋白质分解为氨基酸,在氨基酸脱羧酶的进一步作用下经过脱羧反应形成大量生物胺[13]。而且,黄酒中的酒精会抑制生物胺降解酶-胺氧化酶的活性[14],因此黄酒中存在较高的生物胺风险。为寻找控制黄酒中生物胺的方法,追踪检测整个发酵过程中发酵醪液的生物胺含量变化尤为必要。
根据现有报道,黄酒中生物胺含量的测定方法有很多,如高效液相色谱法、薄层色谱法、气相色谱法、毛细管电泳法、生物传感器法等[15-17]。目前,应用最为广泛的是国标GB/T 5009.208-2016《食品中生物胺含量的测定》中的高效液相色谱法(high performance liquid chromatography,HPLC)法[18]。但是国标中针对酒类中生物胺的检测方法是针对成品酒(液体)制定的,缺少针对黄酒发酵过程中发酵醪液(固液混合物)的生物胺含量测定方法。少数文献中报道了黄酒醪液中生物胺的检测,栾同青[19]采用了改进的高效液相色谱法测定黄酒发酵过程中生物胺含量,但其方法只对组胺、酪胺和腐胺3 种生物胺的分离效果较好。许禄等[20]建立了一种HPLC-MS/MS 的方法测定黄酒发酵过程中生物胺含量,但由于质谱仪检测成本较高,应用受到限制。因此,本研究在酒类中生物胺检测的国标方法基础上,增加了三氯乙酸提取步骤,并简化了流动相,建立了一种简便可靠的针对黄酒发酵醪液中8 种常见生物胺的检测方法并进行了验证。
1 材料与仪器
1.1 材料与试剂
1.1.1 材料
在浙江绍兴某黄酒厂采集不同批次黄酒发酵醪液样品,每组样品3 个平行。
1.1.2 化学试剂
色胺、苯乙胺、酪胺、尸胺、腐胺、组胺、精胺、亚精胺盐酸盐标准品(纯度均>98%)、乙腈(色谱纯)、丹磺酰氯(纯度>99%):美国 Sigma 公司;正丁醇、三氯甲烷、盐酸、三氯乙酸、丙酮、饱和碳酸氢钠、氢氧化钠、谷氨酸钠、氯化钠、无水乙醚(均为分析纯):天津市大陆化学试剂厂。
1.2 仪器与设备
LC-20AT 高效液相色谱仪:日本岛津有限公司;安捷伦C18 柱:上海科晓科学仪器有限公司;DC-12型氮吹仪:上海安谱实验科技股份有限公司;DK-8B型恒温水浴锅:上海精宏实验设备公司;MS2 型涡旋振荡器:德国IKA 公司;Sigma 3K30 型低温高速离心机:德国 Satorious;UF/UVPL5124 超纯水仪:美国 Pall 公司。
1.3 试验方法
1.3.1 取样
浙江绍兴某黄酒厂采集7 个不同批次的黄酒发酵醪液样品,采集样品存放在灭菌瓶子中冷冻运输和保存。
1.3.2 高效液相色谱法测定生物胺含量
1.3.2.1 样品的前处理
取黄酒发酵醪液10.00 g,置于100 mL 具塞锥形瓶中,加入20 mL 5%三氯乙酸溶液并振荡提取30 min,转移至50 mL 具塞离心管中,5 000 r/min 离心10 min,转移上清液至50 mL 容量瓶中。移取上清液15 mL,加入适量的NaCl 使溶液饱和。称取饱和后的样品溶液5 mL,置于10 mL 具塞离心管中,加入0.65 mL2.0 mol/L的氢氧化钠溶液调节pH 值至12.0 左右。加入5 mL 等比例混合的正丁醇和三氯甲烷溶液,涡旋振荡5 min,5 000 r/min 离心5min,转移上层有机相于另一个10 mL具塞离心管中,下层样液再萃取一次,合并萃取液,用等比例混合的正丁醇和三氯甲烷溶液稀释至刻度。取5 mL 萃取液加入 200 μL 盐酸(1 mol/L),混合后 40 ℃水浴下氮气吹干,加入1 mL 盐酸(0.1 mol/L)涡旋振荡,使残留物完全溶解,待衍生[18]。
1.3.2.2 样品的衍生
在待衍生试样中依次加入1 mL 饱和碳酸氢钠溶液、100 μL 氢氧化钠溶液(1 mol/L)、1 mL 丹磺酰氯衍生试剂,涡旋混匀1 min 后置于60 ℃恒温水浴中衍生15 min,取出,加入100 μL 谷氨酸钠溶液,振荡混匀,60 ℃恒温反应15 min。取出冷却至室温25 ℃,于每个离心管中加入1 mL 水,涡旋混合1 min,40 ℃水浴下氮吹除去丙酮(约1 mL),加入0.5 g 氯化钠涡旋振荡至氯化钠完全溶解后加入5 mL 乙醚,涡旋振荡2 min,静置分层后,吸出上层有机相(乙醚层),再萃取一次,合并乙醚萃取液,40 ℃水浴下氮气吹干。加入1 mL 乙腈涡旋振荡使残留物完全溶解,0.22 μm 滤膜针头滤器过滤于进样小瓶,待测定[18]。
1.3.2.3 色谱条件
色谱柱:安捷伦 C18柱(5 μm,150 mm×4.6 mm);柱温:30 ℃;流速:1.0 mL/min;进样 20 μL;紫外检测波长为254 nm;流动相A 为乙腈,流动相B 为超纯水,梯度洗脱程序见表1。标准品谱图和样品谱图见图2 和图3。
1.3.2.4 生物胺标准曲线的绘制
分别吸取1.0 mL 各生物胺标准储备液置于10 mL离心管中,用0.1 mol/L HCl 溶液稀释至5 mL,混匀,得到浓度为200 mg/L 的生物胺标准液。分别吸取0.05、0.30、0.5、1.25、2.5、5、7.5 mL 上述制得的浓度为200 mg/L 的各生物胺标准液于10 mL 离心管中,用0.1 mol/L HCl 溶液稀释至10 mL,混匀,使浓度分别为1、6、10、25、50、100、150 mg/L。取各系列生物胺标准液1.0 mL,柱前衍生后,利用高效液相测定其生物胺含量,以生物胺含量为横坐标,峰面积为纵坐标,绘制8 种生物胺的标准曲线。
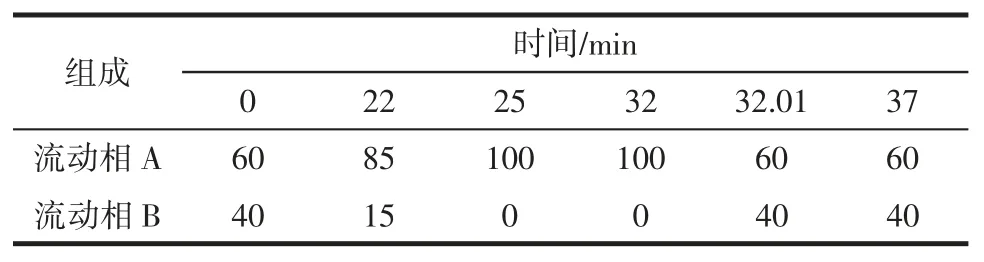
表1 HPLC 梯度洗脱程序Table 1 Gradient elution program of HPLC

图1 生物胺HPLC 标准品谱图Fig.1 HPLC chromatographic profile of a biogenic amines standard solution

图2 生物胺HPLC 样品谱图Fig.2 HPLC chromatographic profile of a biogenic amines sample solution
1.3.2.5 精密度试验
取10 mg/L 的混合标准样品,根据1.3.2.2 方法对其进行衍生,然后在1 d 内和连续3 d 分别进行相同衍生标品的6 次的进样试验,测定8 种生物胺含量,根据结果计算保留时间相对标准偏差和质量浓度相对标准偏差。
1.3.2.6 加标回收率试验
在黄酒样品中加入浓度为10 mg/L 的混合生物胺标准品工作液,平行测定6 次,计算8 种生物胺的加标回收率。
1.3.2.7 数据处理
黄酒样品均以3 个独立的方式制备,每个样品平行测定3 次。采用SPSS19.0 软件计算实验结果的均值和标准偏差,同时进行方差分析,方差分析如无特殊说明均为P<0.05 时具有显著差异。
2 结果与分析
2.1 标准曲线回归方程、检出限和定量限
将浓度为 1、6、10、25、50、100、150 mg/L 的生物胺标准溶液按照次序进样,根据各标准品的峰面积(y)对对应的标准溶液质量浓度(x)作标准曲线,计算标准曲线的回归方程和相关系数,检出限的判断标准为信噪比(S/N)>3,定量限的判断标准为信噪比>10,结果见表2。
由表2 可知,8 种生物胺的线性范围在0.5 mg/L~20 mg/L,线性相关系数R2均≥0.999,说明符合测定的要求。苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺的检出限的范围为0.187 mg/L~0.317 mg/L,定量限的范围是0.323 mg/L~0.887 mg/L,而色胺的检出限为0.35 mg/L,定量限为1.06 mg/L。从结果可以看出该方法对8 种生物胺(色胺除外)灵敏度高,能满足样品测定的要求。
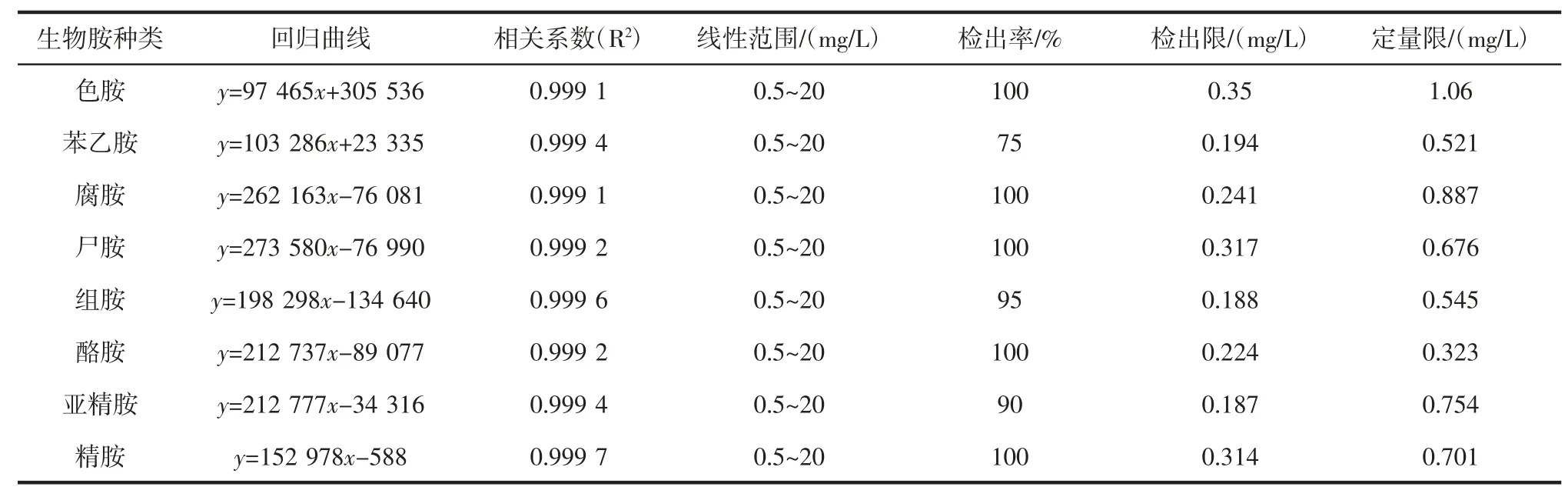
表2 生物胺回归曲线、相关系数、线性范围、检出限和定量限Table 2 Regression equations of the standard curve,correlation index,linearity range,detection limit and quantification limit of biogenic amines derivatives
2.2 精密度试验
精密度试验的保留时间相对标准偏差(relative standard deviation,RSD)和质量浓度相对标准偏差,结果如表3 所示。

表3 精密度试验结果Table 3 Results of precision tests
由表3 可知,保留时间相对标准偏差值均<1%,色胺、苯乙胺、腐胺、组胺、亚精胺和精胺的质量浓度的相对标准偏差值均<5 %,说明精密度符合检测的要求。
2.3 加标回收率试验
8 种生物胺的加标回收率结果见表4。
由表4 可知,8 种生物胺的加标回收率范围为95.31 %~105.22 %,其回收率的RSD 值均<10 %,因此,该方法准确可靠,可用于检测黄酒中生物胺的种类和含量。
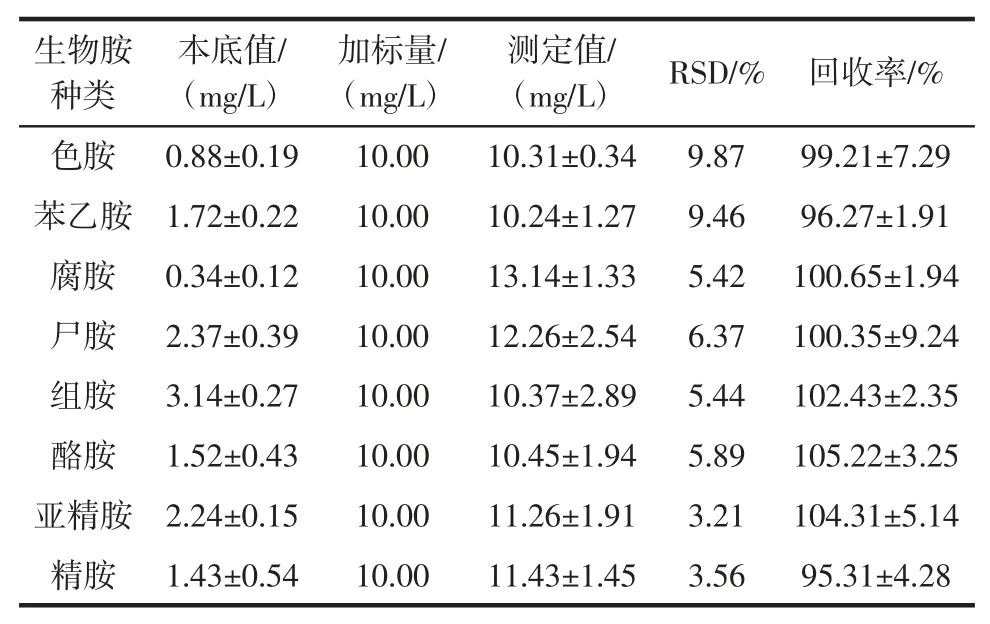
表4 黄酒样品中生物胺的加标回收率试验结果Table 4 Results of recovery rate tests of biogenic amines in Chinese rice wine samples
2.4 黄酒发酵醪液中生物胺分析
在浙江绍兴某黄酒厂采集7 个不同批次的黄酒发酵醪液进行生物胺含量的检测,检测结果如表5 所示。
由表5 可见,在黄酒发酵醪液中,8 种生物胺均能检出,总生物胺的范围是151.02 mg/L~181.48 mg/L,不同样品之间总生物胺含量差异不大。这可能是因为黄酒发酵醪液样品是在同一酒厂的邻近批次采集,由于生产环境和生产工艺较为固定,因此其生物胺总量较为接近。在所检测的8 种生物胺中,黄酒中主要的生物胺为腐胺、酪胺,其中腐胺的含量范围为75.52 mg/L~99.44 mg/L(占总生物胺的49.95%~54.79%),酪胺的含量范围为52.74 mg/L~86.22 mg/L(占总生物胺的34.92%~48.48%),另外6 种生物胺含量较低(ND~7.05 mg/L)。这与食品中常见的微生物脱羧酶主要是酪氨酸脱氢酶和鸟氨酸脱氢酶一致[18],其对应的生物胺分别为酪胺和腐胺。

表5 黄酒发酵醪液中生物胺含量Table 5 Biogenic amine content in fermentated mash of yellow rice wine samples mg/L
3 结论
本文建立了黄酒发酵醪液中固液混合物生物胺的分析方法并测定了绍兴某黄酒厂发酵醪液固液混合物的生物胺含量。8 种生物胺的检出限为0.187 μg/L~0.35 μg/L,定量限为 0.323 μg/L~1.06 μg/L,且在0.5 μg/L~20 μg/L 范围内具有良好的线性关系。8 种生物胺在黄酒发酵醪液样品中的平均回收率为95.31%~105.22%,相对标准偏差在3.21%~9.87%,均小于10%,符合国家标准中残留检测要求。该方法为黄酒发酵醪液(固液混合物)中生物胺的测定提供了简便可靠的方法。在黄酒发酵醪液中,8 种生物胺均能检出,总生物胺的范围是151.02 mg/L~181.48 mg/L。在所检测的8 种生物胺中,黄酒中主要的生物胺为腐胺和酪胺。

