绿球藻多糖分离纯化及抗氧化活性研究
李旭东,孙彦峰,冯佳,吕俊平,刘琪,南芳茹,刘旭东,谢树莲
(山西大学生命科学学院,山西太原030006)
天然多糖具有良好的生物活性和功能,包括抗肿瘤、抗病毒、免疫作用和抗氧化作用等[1-3],在医疗和保健方面所具有的重要潜在应用价值日益显现,具有广泛的前景。近年来,人们发现一些微藻中富含多糖,具有增强机体免疫、抗病毒、抗恶性肿瘤、抗炎症、抗类风湿性关节炎、降血压、降血脂、降血糖、健胃、防早衰、抗辐射等防病治病的辅助作用,如紫球藻、念珠藻、螺旋藻等[4-6]。加上微藻具有生长速度快、适应性强、在人工培养下能够大量繁殖、占地面积小、生产成本低等特性,因此,藻多糖具有较高的商品价值和广阔的市场前景[7]。
绿球藻(Chlorococcum sp.GD)属单细胞绿藻,富含多糖、蛋白质、黄酮类、酚类、β-胡萝卜素等,其藻多糖能有效清除自由基,具有良好的抗氧化性,可用作饲料和食品生产实践[8]。
多种提取方法被报道用于藻类多糖提取。热水浸提法由于提取过程简单、成本较低,是主要的提取方法。该方法可将大部分水溶性多糖提取,但得到的多糖提取液中还含有大量藻体、细胞碎片、蛋白质和其它胶状物质等,这些杂质使提取液黏度增大,影响后续的分离纯化工序,因此需要进一步分离提纯[9-10]。
本文采用热水浸提法对绿球藻(Chlorococcum sp.GD)中的多糖进行提取,并利用纤维素层析和凝胶层析进行分级纯化,进而通过试验考查绿球藻粗多糖及纯化后多糖的抗氧化性,以期为进一步研究绿球藻多糖活性提供试验基础,同时也为绿球藻多糖的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
绿球藻(Chlorococcum sp.GD):采自山西省关帝山。藻种由山西大学藻类学实验室分离、保藏并培养。
葡萄糖、维生素 C(VC)、硫酸、氯仿、氢氧化钠、正丁醇、三氟乙酸、氯仿、磷酸钠、邻苯三酚、氯化钠和无水乙醇:上海生工生物工程有限公司;1,1-二苯基-2-苦基肼(1-dipheny1-2-picryl-hydrazyl,DPPH)、2,2′-连氮-二(3-乙基苯并噻唑啉-6-磺酸)[2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS]、过硫酸钾和菲洛嗪:Sigma 公司;以上试剂均为分析纯。
葡聚糖凝胶(Sephadex G-150):上海江莱生物科技有限公司;二乙胺基乙基(diethylaminoethyl,DEAE)-纤维素:美国Whatman 公司;所用水为超纯水。
1.2 仪器与设备
傅立叶变换红外光谱仪(Nicolet iS50):赛默飞世尔科技有限公司;紫外可见分光光度(TU-1810DAPC):北京普析通用仪器有限公司;电热恒温水浴锅(HH-2):常州国华电器有限公司;高速冷冻离心(HC-2518R):安徽中科中佳科学仪器有限公司;冷冻干燥器(SCIENTZ-18ND):宁波新芝冻干设备股份有限公司;全功能酶标仪(Synergy H1):美国BioTek Instruments,Inc.;旋转蒸发仪(RF-02):上海普渡生化科技有限公司。
1.3 绿球藻多糖的制备及纯化
1.3.1 绿球藻粗多糖(crude Chlorococcum polysaccharide,CCP)的制备
将一定量的绿球藻粉末与蒸馏水按质量比1 ∶25混合,在95 ℃热水提取2 h,经真空抽滤后收集滤液,残渣再次热水提取1 h,合并两次滤液并用旋转蒸发仪80 ℃下浓缩至原体积的1/3,按3 ∶1 体积比加入氯仿-正丁醇溶液(4/1,体积比),沉淀蛋白2 次[11]。然后将水相与氯仿相分开,得到粗多糖溶液。提取液经再次浓缩至原体积1/3 后,按体积比1 ∶3 加入85%乙醇溶液沉淀多糖,4 ℃过夜。离心后将沉淀冷冻干燥,得绿球藻粗多糖CCP。
1.3.2 绿球藻粗多糖的纯化
称取绿球藻粗多糖0.2 g,用最少量的蒸馏水溶解。上 DEAE-52 纤维素层析柱(50 cm×2.6 cm),先用蒸馏水洗至无糖检出,依次用0、0.1、0.3、0.5 mol/L NaCl 洗脱,洗脱速度为1 mL/min,分管收集,每管5 mL,收集液用硫酸-苯酚法测定A490nm值,以管号为横坐标,A490nm
值为纵坐标绘制洗脱曲线[12],并收集各洗脱峰部分,浓缩、透析、冷冻干燥。
取上述洗脱峰部分最多的多糖2 mg,溶于1 mL蒸馏水,上 Sephadex G-150 层析柱(100 cm×1.5 cm),用蒸馏水以0.2 mL/min 速度洗脱,按每管5 mL 接洗脱液,隔管用苯酚-硫酸法在波长490 nm 处检测吸光度,绘制洗脱曲线。
1.3.3 粗多糖含量的测定
准确称取标准葡萄糖20 mg 于500 mL 容量瓶中,加水至刻度,分别吸取 0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL,各以蒸馏水补至2.0 mL,然后加入6%苯酚1.0 mL 及浓硫酸5.0mL,摇匀冷却,沸水浴显色15min以后于490 nm 测吸光度,以2.0 mL 水按同样显色操作为空白,横坐标为糖含量,纵坐标为吸光值,绘制标准曲线[13]。
绿球藻粗多糖含量的测定采用苯酚-硫酸法,以葡萄糖为标准品,建立了标准曲线。采用干重法,测定绿球藻粗多糖提取液中多糖含量。
多糖提取率/%=(测定液中多糖浓度×测定液总体积)/绿球藻多糖总质量×100
1.3.4 纯化多糖的紫外可见光谱扫描
收集纯化绿球藻多糖溶液,制成约1 mg/mL 溶液,用紫外-可见用紫外-可见分光光度计在紫外-可见区200 nm~500 nm 内进行扫描,得紫外-可见吸收光谱,观察其光谱特征及在波长260 nm 和280 nm 处紫外吸收特征,检测是否有核酸和蛋白质存在。
1.3.5 纯化多糖的傅立叶变换红外光谱扫描(fourier transform infrared spectrum,FTIR)
纯化多糖的红外光谱采用傅立叶变换红外光谱仪(Nicolet iS50)以衰减全反射模式进行扫描,扫描波数范围为 3 500 cm-1~650 cm-1,分辨率为 0.1 cm-1。
1.4 绿球藻多糖的抗氧化活性
1.4.1 对DPPH 自由基的清除作用
参照冯学珍等[14]的方法,略作修改。分别取500 μL不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的绿球藻多糖水溶液,加入500 μL 浓度为0.04 mg/mL 的DPPH溶液,混匀后室温25 ℃避光反应30 min,在波长517 nm处测定吸光度(A)值。对照组用500 μL 无水乙醇溶液代替DPPH 溶液,空白组用500 μL 去离子水代替多糖溶液,不同浓度的VC替代多糖样品作为阳性对照。每个样品重复3 次。

式中:A0为样品的吸光值;Aa为对照 (用500 μL无水乙醇溶液代替DPPH 溶液)吸光值;Ab为空白(用500 μL 去离子水代替多糖溶液)吸光值。
1.4.2 对羟基自由基的清除作用
参照程超等[15]的方法,略作修改。取1 mL 不同质量浓度的绿球藻多糖溶液 (0.2、0.4、0.6、0.8、1.0 mg/mL)于试管中,向各管中加入2 mL 硫酸亚铁(FeSO4)溶液(3 mmol/L)和 1.5 mL 水杨酸溶液(1.8 mmol/L)。混匀后,加入0.03%双氧水0.1 mL 启动反应,混匀。37 ℃水浴30 min,在波长510 nm 下测定A 值。以去离子水代替多糖溶液做空白,不同浓度的VC替代多糖样品作为阳性对照。每个样品重复3 次。

式中:A0为空白(用去离子水代替多糖溶液)吸光值;Aa为样品的吸光值。
1.4.3 对超氧阴离子自由基的清除作用
参照陈玫等[16]和韩少华等[17]的方法,略作修改。向各管中加入900 μL 磷酸盐缓冲液(50 mmol/L,pH 8.2),25 ℃水浴 20 min,向各试管中加入 200 μL 不同质量浓度的多糖溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)。其中空白以去离子水代替多糖溶液,然后加入25 mmol/L的邻苯三酚溶液80 μL,混匀后于25 ℃水浴中反应5 min,加入 80 mmol/L HCl 200 μL 终止反应,并摇匀,反应3 min,5 000 r/min 离心。酶标仪波长420 nm 处测定吸光值。以去离子水代替多糖溶液作为空白,对照用磷酸盐缓冲液代替样品液。不同浓度的VC替代多糖样品作为阳性对照。每个样品重复3 次。
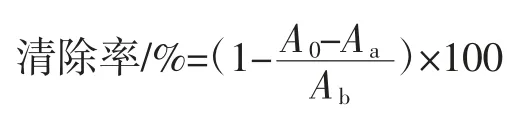
式中:A0为样品的吸光值;Aa为对照(磷酸盐缓冲液代替样品液)吸光值;Ab为空白(用去离子水代替多糖溶液)吸光值。
1.4.4 ABTS+自由基清除能力测定
参照有关文献的方法[18],将ABTS 溶液(7 mmol/L,5 mL)和过硫酸钾溶液(140 mmol/L,88 μL)混合,室温25 ℃避光反应12 h~16 h,制备ABTS+自由基储备液。使用磷酸盐缓冲液(10 mmol/L,pH7.4)将储备液稀释至其在734 nm 处吸光值为0.70±0.02,备用。取不同浓度多糖溶液各1 mL,加3 mL ABTS+自由基溶液,于暗处反应1 h,记录其在734 nm 处的吸光度。以1 mL 纯水代替样品作为空白,相同操作。每个样品重复3 次。

式中:Ax为样品的吸光值;A0为空白的吸光值。
1.4.5 还原能力的测定
参照有关文献的方法[19],准确量取1.0 mL 不同质量浓度的多糖样品(0.2、0.4、0.6、0.8、1.0 mg/mL)。样品液移至10 mL 具塞试管中,加入1.0 mL 磷酸钠缓冲溶液(1.0 moL/L,pH 6.6)和 2.5 mL K3[Fe(CN)6](1 %),50 ℃恒温水浴20 min,取出冷却后加入2.0 mL 10%三氯乙酸溶液,混匀,5 000 r/min 离心 5 min,取 2.5mL 上清液,加2.5 mL 蒸馏水和0.5 mL 1%FeCl3溶液,混匀。以蒸馏水为空白,于波长700 nm 处测定其吸光值,以VC作为对照[20]。每个样品重复3 次。
2 结果与分析
2.1 绿球藻多糖的特性
2.1.1 绿球藻粗多糖含量测定结果
绘制的标准曲线见图1,得到回归方程为Y =0.008 2X+0.090 6,相关系数R2=0.995 6。代入公式,计算出绿球藻粗多糖提取率为6.07%。
2.1.2 绿球藻粗多糖纯化分析
绿球藻粗多糖DEAE-52 纤维素柱层析洗脱曲线见图2。

图1 葡萄糖含量标准曲线Fig.1 Standard curve of of glucose content
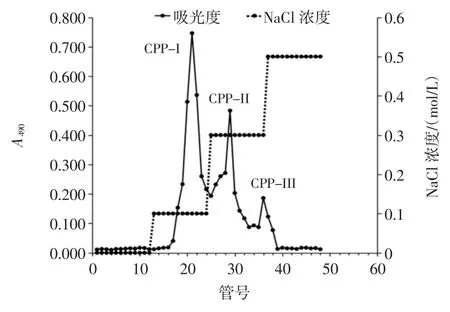
图2 绿球藻粗多糖DEAE-52 纤维素柱层析洗脱曲线Fig.2 Elution curves of crude Chlorococcum sp.GD polysaccharides by DEAE-52cellulose column chromatography
由图2 可知,绿球藻粗多糖CCP 经DEAE-52 纤维素柱层析分离后获得3 个组分,分别命名为CPP-Ⅰ、CPP-Ⅱ和CPP-Ⅲ。将含量最高的组分CPP-Ⅰ进一步采用Sephadex G-150 凝胶层析柱纯化,得到组分CPP-Ⅳ,洗脱峰为单一峰(见图3),且峰形对称,表明CPP-Ⅳ为单一组分。

图3 绿球藻多糖CPP-ⅠSephadex G-150 柱层析洗脱曲线Fig.3 Elution curves of Chlorococcum sp.GD polysaccharides CPP-Ⅰby Sephadex G-150 column chromatography
2.1.3 绿球藻纯化多糖紫外光谱分析
绿球藻纯化多糖的紫外光谱见图4。

图4 绿球藻纯化多糖的紫外光谱Fig.4 Ultraviolet spectrum of polysaccharides from Chlorococcum sp.GD
由图4 可知,绿球藻纯化多糖在紫外区波长247 nm 处有最大吸收峰。由于核酸和蛋白质吸收峰为260 nm 和280 nm,而图中 260 nm 和 280 nm 处无吸收峰,表明绿球藻纯化多糖中核酸和蛋白质等杂质已清除,具有较高的纯度。
2.1.4 绿球藻纯化多糖红外光谱分析
绿球藻纯化多糖的红外光谱见图5。
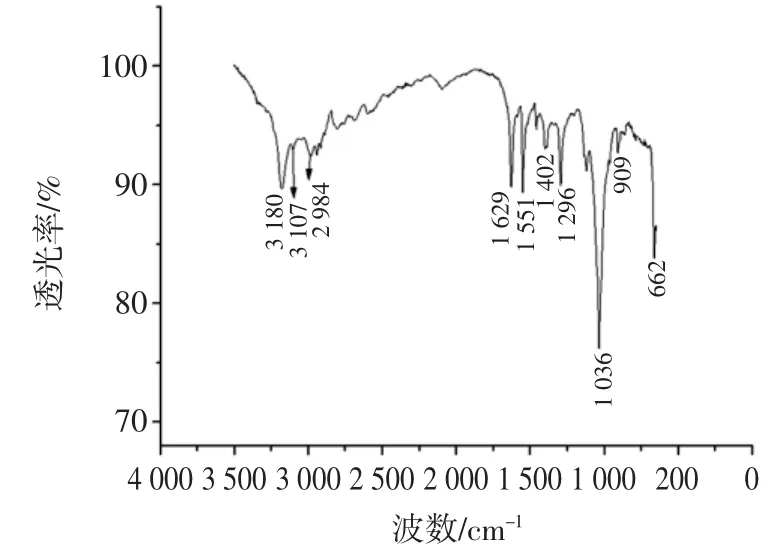
图5 绿球藻纯化多糖的红外光谱图Fig.5 Infrared spectra of Chlorococcum sp.GD polysaccharides
从光谱特征看,CPP-Ⅳ在 3 180、2 984、1 629 cm-1及1 036 cm-1具有较强吸收,为典型的多糖特征吸收[21]。在波数 3 400 cm-1~3 180 cm-1的吸收峰主要为糖类的O-H 及 N-H 的伸缩振动,2 984 cm-1处的吸收峰为-CH3-键伸缩振动,2 943 cm-1处的吸收峰为-CH2-键伸缩振动,1 629 cm-1附近的吸收峰可能是酰胺基中C=O 伸缩振动,1 551 cm-1吸收峰为-NO2-伸缩振动,1 400 cm-1~1 200 cm-1内的吸收主要为C-H 变角振动引,1 295 cm-1可能是硫酸基吸收峰[22],1 036 cm-1的强吸收是C-O-C 或C-O-H 中的C-O 键的弯曲振动,为葡萄糖的特征吸收[23-24],909 cm-1处为C-H 变形振动,662 cm-1处为O-H 面外弯曲。由红外图谱可知CPP-Ⅳ具有明显的糖类化合物的特征。
2.2 绿球藻多糖的抗氧化活性分析
2.2.1 绿球藻多糖对DPPH 自由基的清除能力
图6 为绿球藻多糖对DPPH 自由基的清除能力。

图6 绿球藻多糖的DPPH 自由基清除率Fig.6 DPPH radical removal rate of Chlorococcum sp.GD polysaccharide
由图6 可以看出,随着浓度的增加,绿球藻纯化多糖对DPPH 自由基的清除率逐渐增强。相比粗多糖,纯化多糖CPP-Ⅳ对DPPH 自由基的清除率明显更高。当粗多糖和CPP-Ⅳ的浓度达到0.6 mg/mL 时,DPPH自由基清除率基本稳定,超过90%。当CPP-Ⅳ的浓度达到1 mg/mL 时,DPPH 自由基清除率达到96.13%,与阳性对照VC基本相同。此前,有报道其他藻类多糖也具有较好的自由基清除能力,如紫球藻(Porphyridium cruentum)多糖在浓度为0.5 mg/mL 时清除率趋于稳定,达到84 %,娄翠等[25]海带(Laminaria japonica)岩藻多糖PFS-2 在浓度为1 mg/mL 时,清除率接近55%。相比之下,绿球藻多糖CPP-Ⅳ具有更好的DPPH 自由基清除能力。
2.2.2 绿球藻多糖对羟基自由基的清除能力
图7 为绿球藻多糖的羟基自由基清除率。

图7 绿球藻多糖的羟基自由基清除率Fig.7 Hydroxyl radical removal rate of Chlorococcum sp.GD polysaccharide
由图7 可知,随着浓度的增加,绿球藻多糖对羟基自由基的清除率逐渐增强。纯化多糖CPP-Ⅳ对羟基自由基的清除率略高于粗多糖。当CPP-Ⅳ的浓度达到0.6 mg/mL 时,羟基自由基清除率基本稳定,超过70%。当CPP-Ⅳ的浓度为1 mg/mL 时,羟基自由基的清除率为70.6%,虽然效果不及VC(88.22%),但与有的藻类相比,效果明显更好。如地皮菜(Nostoc commune)多糖CCB 和CB-2-1 组分在1 mg/mL 时,羟基自由基清除率分别为35.2%和49.5%[26]。
2.2.3 绿球藻多糖对超氧阴离子的清除能力
图8 为绿球藻多糖的超氧阴离子清除率。
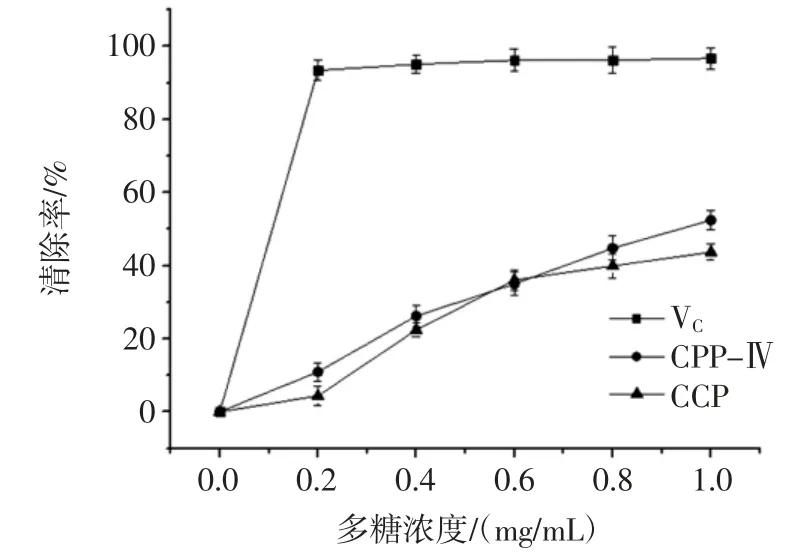
图8 绿球藻多糖的超氧阴离子清除率Fig.8 Superoxide anion radical removal rate of Chlorococcum sp.GD polysaccharide
从图8 可以看出,随着浓度的增加,绿球藻多糖对超氧阴离子的清除率逐渐增强。粗多糖与纯化多糖CPP-Ⅳ对超氧阴离子的清除率基本相同。当CPP-Ⅳ和粗多糖的浓度达到1 mg/mL 时,超氧阴离子清除率分别达到52.46%和43.72%。虽然明显不及VC(96.13%)的清除能力,但仍然表明绿球藻多糖具有一定的抗氧化作用。
2.2.4 ABTS+自由基清除能力
绿球藻多糖的ABTS+自由基清除率见图9。

图9 绿球藻多糖的ABTS自由基清除率Fig.9 ABTS free radical removal rate of Chlorococcum sp.GD polysaccharide
从图9 可以看出,随着浓度的增加,绿球藻多糖对ABTS+自由基的清除率逐渐增强。纯化多糖CPP-Ⅳ效果略优于粗多糖。当CPP-Ⅳ的浓度达到1 mg/mL 时,ABTS+自由基清除率可达27.07%。虽然明显不及VC(约90%)的清除能力,但仍然表明绿球藻多糖具有一定的抗氧化作用。也有文献报道,泡叶藻(Ascophyllum nodosum)和铜藻(Sargassum horneri)多糖相同浓度下,ABTS清除率分别可达约40%和90%[27-28]。
2.2.5 还原力测定
绿球藻多糖的还原力见图10。

图10绿球藻多糖的还原力Fig.10 Reducing power of Chlorococcum sp.GD polysaccharid
从图10可以看出,随着浓度的增加,绿球藻多糖的还原力逐渐增强。纯化多糖CPP-Ⅳ效果优于粗多糖。当CPP-Ⅳ的浓度达到1 mg/mL时,OD700nm为0.404,虽然明显不及VC(1.223)的还原力(吸光度越大表示还原能力越强),但仍然表明绿球藻多糖具有一定的抗氧化作用。据有关文献[28-32],在相同多糖浓度下,铜藻多糖(tongzao polysaccharide,TZP)组分OD700nm为0.8,月见草叶中提取的多糖OD700nm为0.6,枸杞多糖组分LBP2的OD700nm为0.521,米酒多糖OD700nm为0.494,紫薯多糖OD700nm为0.49。相比其他植物源多糖,绿球藻多糖也具有一定的还原力。
3 结论
采用传统热水浸提方法对绿球藻粗多糖进行分离纯化,多糖提取率为6.07%。通过DEAE-52纤维素柱层析和Scphadex G-150葡聚糖凝胶柱将绿球藻粗多糖组分进行分级纯化,得到4个组分CPP-Ⅰ、CPP-Ⅱ、CPP-Ⅲ和CPP-Ⅳ,且纯度较高。绿球藻多糖对DPPH自由基和羟基自由基具有明显的清除效果,清除率分别超过90%和70%,且纯化多糖CPP-Ⅳ的效果优于粗多糖CCP。绿球藻多糖对超氧阴离子和羟基自由基也具有一定的清除效果,虽然不及VC,但仍然表明纯化多糖具有很好的抗氧化活性,并且清除率随多糖的浓度增大而增加。

