艾迪注射液对兔舌VX-2鳞癌模型化疗外周血中Th1/Th2平衡的影响
王明雪, 殷杰, 张霓霓, 易杰, 黄桂林
(遵义医科大学附属口腔医院,贵州遵义 563000)
世界范围内头颈部鳞状细胞癌(以下简称鳞癌)每年约有50万新发病例,口腔鳞癌是头颈部区域最常见的肿瘤,占口腔肿瘤的90%,而其中舌部鳞癌新发病例为16万[1]。由于口腔癌发生部位的特殊性,因此治疗此类癌症要注意2个要素,即完整切除肿瘤和对功能的保护。口腔癌一般采用综合性的治疗,除了外科手术治疗,还采用放疗、化疗、免疫治疗等。艾迪注射液以斑蝥、人参、黄芪、刺五加为主要成分,已经是一种临床上较为常用的治疗肿瘤性疾病的中药制剂,具有扶正祛邪、免疫调节以及抗肿瘤的作用[2-4]。本研究拟进一步观察艾迪注射液单独使用或联合化疗药物对兔舌VX-2鳞癌肿瘤模型外周血中免疫因子的影响,从而为临床辅助治疗舌鳞癌提供理论依据,现将研究结果报道如下。
1 材料与方法
1.1动物兔VX-2 肿瘤细胞株购于中山大学实验动物中心细胞库。新西兰大白兔84 只,2~3 月龄,体质量1.5~2.0 kg,雌雄不限,购于中山大学实验动物中心,许可证号:SCXK(粤)2014-0023。均饲养于遵义医学院实验动物中心,饲养环境:兔舍温度为(20 ± 3)℃,相对湿度为(50 ±10)%,适量光照,青绿色颗粒饲料、清洁饮用水。新西兰大白兔在上述环境条件下适应性喂养1 周,再进行建模及给药。本实验所有对实验动物的操作均通过遵义医学院动物实验伦理委员会伦理审查同意后实施。
1.2药物艾迪注射液,10 mL/支,贵州益佰制药股份有限公司,国药准字Z52020236;紫杉醇注射液(Paclitaxel Injection),30 mg/支,哈药集团有限公司,国药准字H20059962。
1.3试剂与仪器兔干扰素γ(IFN-γ)酶联免疫吸附分析(ELISA)试剂盒、兔肿瘤坏死因子α(TNF-α)ELISA 试剂盒购于北京诚林生物科技有限公司;兔白细胞介素(IL)-2 ELISA 试剂盒、兔IL-6 ELISA试剂盒、兔IL-10 ELISA试剂盒购于康宝生物公司。酶标仪(美国Thermo公司)。
1.4兔舌VX-2鳞癌模型的建立对60 只新西兰大白兔行瘤粒植入术,30 mg/kg戊巴比妥钠经兔耳缘静脉注射,约10 min 后麻醉生效,兔结膜反射消失。将兔子固定在手术台上,用绷带牵拉兔子的上下前牙,使兔子呈大开口状态,完全暴露口腔。在无菌条件下,用无齿镊将兔舌牵拉出口外倾向一侧,在兔右侧舌缘的前中1/3交界处,沿舌体长轴方向做长3~4 mm 的切口,深约5 mm,切开黏膜及舌肌,用眼科镊将瘤粒4~5 枚放入切口内,植入舌肌中。严密缝合切口(从肿瘤组织切取出到植入瘤粒完成,时间控制在2 h 内)。实验兔术后连续3 d给予青霉素钠(3万U·kg-1·d-1)肌肉注射,预防创口感染。各兔单独笼养,正常清洁饲养。
1.5分组与给药在建模成功的56 只荷瘤兔中,选取舌部肿瘤直径为1.0 cm 左右的荷瘤兔48 只,随机分成4 组,每组12 只。再选择24 只健康兔,随机分成2 组,每组12 只。综上,本实验共分6组:A、B、C、D、E、F 组(A、B 组为健康兔;C、D、E、F 组为荷瘤兔)。采用经兔耳缘静脉注射的给药方式。具体分组及用药方式:A 组(健康兔+ 生理盐水),经兔耳缘静脉推注生理盐水20 mL,连续2 周;B 组(健康兔+ 艾迪注射液),经兔耳缘静脉推注艾迪注射液(生理盐水稀释到20 mL),连续2周;C组(荷瘤兔+生理盐水),经兔耳缘静脉推注生理盐水20 mL,连续2 周;D 组(荷瘤兔+紫杉醇注射液),给药第1天给予荷瘤兔紫杉醇注射液(将紫杉醇注射液用生理盐水稀释到20 mL 后,用微量注射泵经兔耳缘静脉输液给药,6.67 mL/h),第1周剩余6 d及第2周均经兔耳缘静脉推注生理盐水20 mL;E 组(荷瘤兔+ 艾迪注射液),经兔耳缘静脉推注艾迪注射液(生理盐水稀释到20 mL),连续2周;F组(荷瘤兔+紫杉醇注射液+艾迪注射液),给药第1 天给予紫杉醇注射液(将紫杉醇注射液用生理盐水稀释到20 mL 后,用微量注射泵经兔耳缘静脉输液给药,6.67 mL/h),第1 周剩余6 d 及第2 周均经兔耳缘静脉推注艾迪注射液(将生理盐水稀释到20 mL)。
1.6药物剂量的折算及实验兔给药剂量本实验设定人的体质量为60 kg,实验兔的体质量为1.5 ~2.0 kg,平均体质量为1.8 kg,实验兔体表面积的计 算 公 式[5]:A=K×。A:兔体表面积(cm2);K= 10.1,为常数;W:兔体质量(g)。即体质量1.8 kg 兔的体表面积为0.149 5 m2。中国人体表面积的计算用Stevenson 公式[6]:A1=0.006 1×H+ 0.012 8 ×W1- 0.152 9。A1:体表面积(cm2);H:身高(cm);W1:体质量(kg)。即人的体表面积为1.621 6 m2。实验兔给药剂量的折算公式[5,7]:D=D1×A/W。D:实验兔的给药剂量(mg/kg);D1:人的给药剂量(mg/kg)。根据人化疗药物的使用剂量折算实验兔药物的使用剂量(详见表1)。课题小组前期的实验[8]发现,经过动脉灌注化疗给予荷瘤兔全剂量的紫杉醇注射液时,荷瘤兔的死亡率相对较高,因此,为了避免实验过程中的动物死亡,使荷瘤兔能够耐受紫杉醇注射液的化疗,本次实验给予紫杉醇注射液的安全剂量是荷瘤兔最大剂量的一半,即将紫杉醇注射液用生理盐水稀释到20 mL,用微量注射泵经荷瘤兔耳缘静脉给药,速度为6.67 mL/h。艾迪注射液人的用法为每次50~100 mL,每日1次,用生理盐水稀释到500 mL后静脉滴注。拟定人的体质量为60 kg,换算为人给药量为0.83~1.66 mL/kg,折算后实验兔的给药量为2.55~5.10 mL/kg。本实验是按照艾迪注射液最大剂量5.10 mL/kg 给药,用生理盐水稀释到20 mL 后经兔耳缘静脉推注,每日1 次。紫杉醇注射液使用前30 min 用地塞米松磷酸钠注射液肌肉注射,预防紫杉醇注射液过敏。
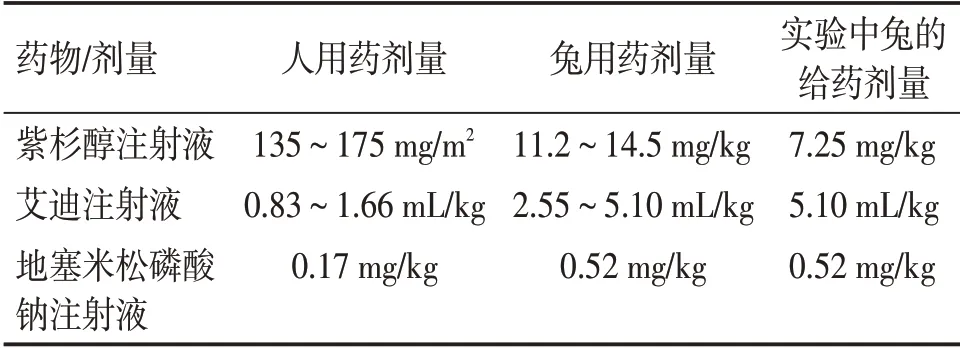
表1 药物使用剂量表Table 1 Dosage given comparison
1. 7 ELISA检测分别在给药前1 d,给药第7、14 天,采用ELISA 法检测实验兔外周血中IL-2、IL-6、IL-10、IFN-γ、TNF-α 水平的变化。具体步骤按照试剂盒说明书。
1.8脾脏指数在给药第7、14 天,各组分别处死6只实验兔,先称量实验兔的体质量,并按标号记录。将实验兔麻醉后,对兔子进行解剖。先给实验兔腹部备皮,予以碘伏消毒铺巾,在实验兔腹部行纵向切口,打开腹腔,解剖分离,取出其脾脏,做好标记,统一置于冰盒中。待送回实验室后,脾脏置于滤纸上1 h,再称量脾脏的质量(m/mg)、兔子的体质量(m/g),计算脾脏指数(splenic index,SI)。公式:脾脏指数=脾脏质量/体质量×10。
1. 9统计方法采用SPSS 21.0 软件进行数据分析,实验数据均以均数± 标准差(±s)表示,多组比较采用单因素ANOVA检验。当方差齐时各组间数据的两两比较采用Tukey检验,当方差不齐时各组间数据的两两比较采用Dunnett’s T3检验。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1兔舌VX-2鳞癌模型建立情况建模成功后,可见模型兔右侧舌缘隆起,表面黏膜较完整,未见明显破溃,呈浸润性生长,扪及包块质韧,活动度较差,与周围组织边界不清,与舌肌轻度粘连,见图1-A。镜下可见舌部瘤体组织形态结构混乱,见有丝分裂象,未见病理性核分裂象,细胞异型性明显,未见角化,如图1-B所示。
2.2各组荷瘤兔舌部瘤体变化随着给药时间的增加,F 组舌部瘤体明显缩小,破溃皮损部分愈合,荷瘤兔的精神及饮食状态较好;E组荷瘤兔的状态较D 组荷瘤兔好,但舌瘤体的大小改变不明显;D组舌瘤体缩小,破溃明显,荷瘤兔的精神及饮食较差;C组荷瘤兔精神及饮食较差,舌瘤体组织不仅无明显缩小,且有增大趋势,破溃糜烂明显。
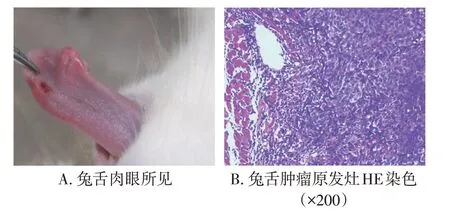
图1 兔舌VX-2鳞癌模型建立情况Figure 1 Establishment of rabbit tongue squamous VX-2 cell carcinoma
2.3各组兔外周血中TNF-α、IFN-γ、IL-2、IL-6、IL-10的水平表2 ~6 结果显示:给药前1 d 各组荷瘤兔之间及健康兔与荷瘤兔之间TNF-α、IFN-γ、IL-2、IL-6、IL-10 水平比较,差异均无统计学意义(P>0.05)。表明给药前各组之间的免疫因子水平无明显差异。
治疗第7、14 天,作为对照的A、B、C 组间TNF-α、IFN-γ、IL-2、IL-6、IL-10 水平比较,差异亦均无统计学意义(P>0.05)。表明VX-2 肿瘤细胞移植在实验成瘤的28 d 内尚不足以使兔体内免疫因子水平发生改变。
表2 各组兔外周血TNF-α水平比较Table 2 Comparison of TNF-α level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
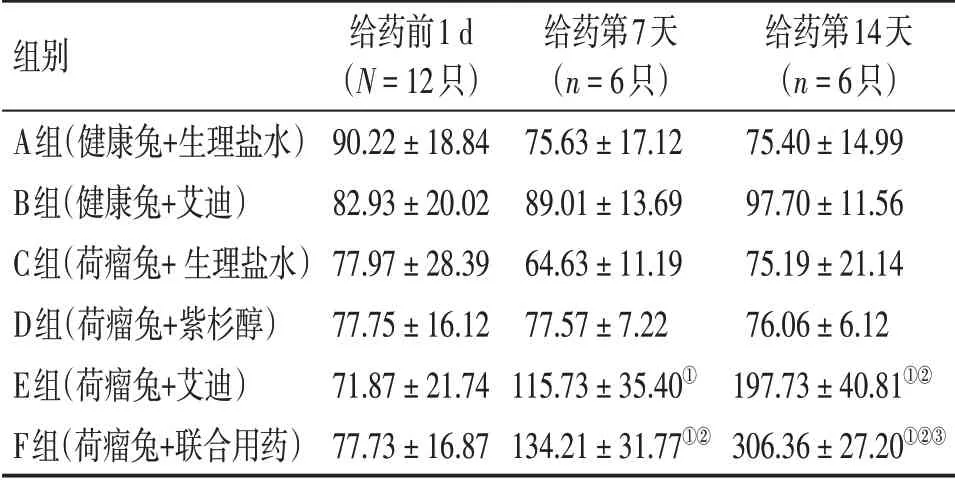
表2 各组兔外周血TNF-α水平比较Table 2 Comparison of TNF-α level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
①P <0.05,与C 组比较;②P <0.05,与D 组比较;③P <0.05,与E组比较
组别A组(健康兔+生理盐水)B组(健康兔+艾迪)C组(荷瘤兔+生理盐水)D组(荷瘤兔+紫杉醇)E组(荷瘤兔+艾迪)F组(荷瘤兔+联合用药)给药前1 d(N=12只)90.22±18.84 82.93±20.02 77.97±28.39 77.75±16.12 71.87±21.74 77.73±16.87给药第7天(n=6只)75.63±17.12 89.01±13.69 64.63±11.19 77.57±7.22 115.73±35.40①134.21±31.77①②给药第14天(n=6只)75.40±14.99 97.70±11.56 75.19±21.14 76.06±6.12 197.73±40.81①②306.36±27.20①②③
2. 3. 1 Th1 型免疫因子 治疗第7 天,E、F 组TNF-α 水平高于C 组(P<0.05),且F 组TNF-α 水平明显高于D组(P<0.05)。治疗第14天,E、F组TNF-α 水平均高于C、D 组(P<0.05),且F 组TNF-α 水平显著高于E 组(P<0.05)。而D 组治疗第7、14天TNF-α水平与C组比较,差异无统计学意义(P>0.05)。
表3 各组外周血IFN-γ水平比较Table 3 Comparison of IFN-γ level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
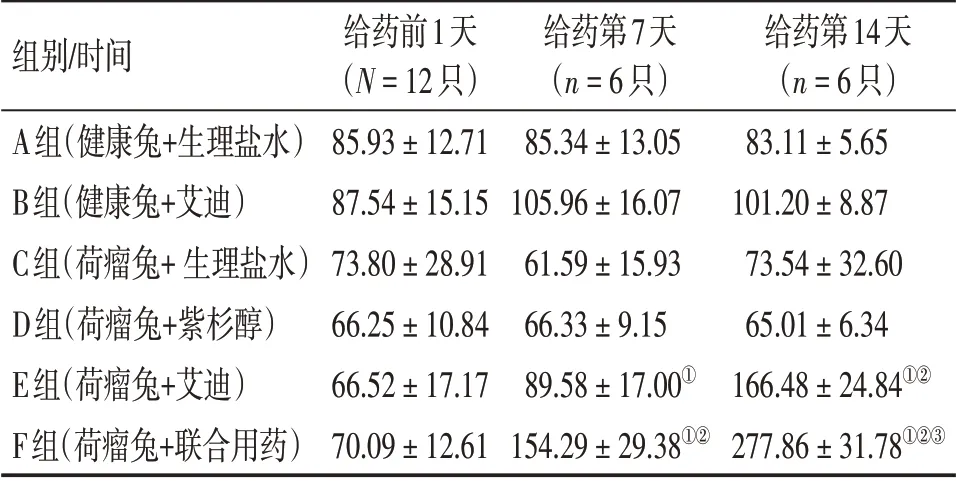
表3 各组外周血IFN-γ水平比较Table 3 Comparison of IFN-γ level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
①P <0.05,与C 组比较;②P <0.05,与D 组比较;③P <0.05,与E组比较
组别/时间A组(健康兔+生理盐水)B组(健康兔+艾迪)C组(荷瘤兔+生理盐水)D组(荷瘤兔+紫杉醇)E组(荷瘤兔+艾迪)F组(荷瘤兔+联合用药)给药前1天(N=12只)85.93±12.71 87.54±15.15 73.80±28.91 66.25±10.84 66.52±17.17 70.09±12.61给药第7天(n=6只)85.34±13.05 105.96±16.07 61.59±15.93 66.33±9.15 89.58±17.00①154.29±29.38①②给药第14天(n=6只)83.11±5.65 101.20±8.87 73.54±32.60 65.01±6.34 166.48±24.84①②277.86±31.78①②③
表4 各组外周血IL-2水平比较Table 4 Comparison of IL-2 level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
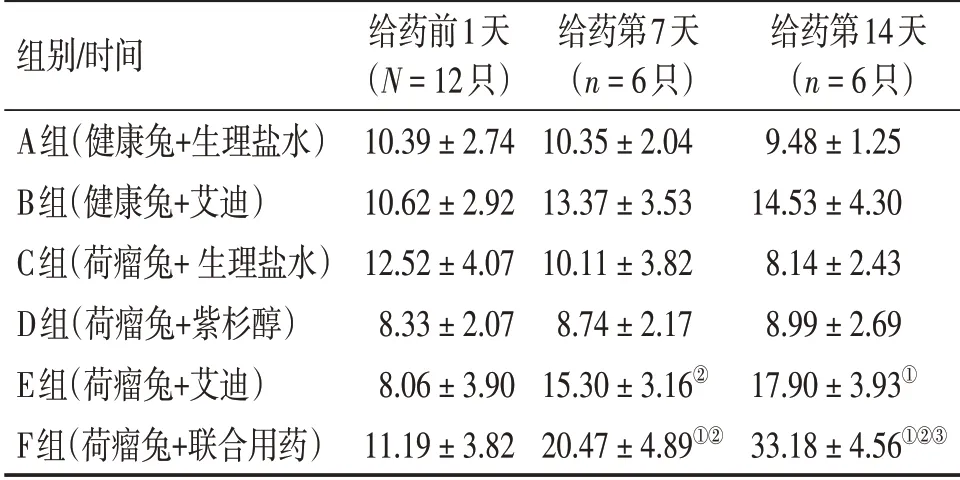
表4 各组外周血IL-2水平比较Table 4 Comparison of IL-2 level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
①P <0.05,与C 组比较;②P <0.05,与D 组比较;③P <0.05,与E组比较
组别/时间A组(健康兔+生理盐水)B组(健康兔+艾迪)C组(荷瘤兔+生理盐水)D组(荷瘤兔+紫杉醇)E组(荷瘤兔+艾迪)F组(荷瘤兔+联合用药)给药前1天(N=12只)10.39±2.74 10.62±2.92 12.52±4.07 8.33±2.07 8.06±3.90 11.19±3.82给药第7天(n=6只)10.35±2.04 13.37±3.53 10.11±3.82 8.74±2.17 15.30±3.16②20.47±4.89①②给药第14天(n=6只)9.48±1.25 14.53±4.30 8.14±2.43 8.99±2.69 17.90±3.93①33.18±4.56①②③
表5 各组外周血IL-6水平比较Table 5 Comparison of IL-6 level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
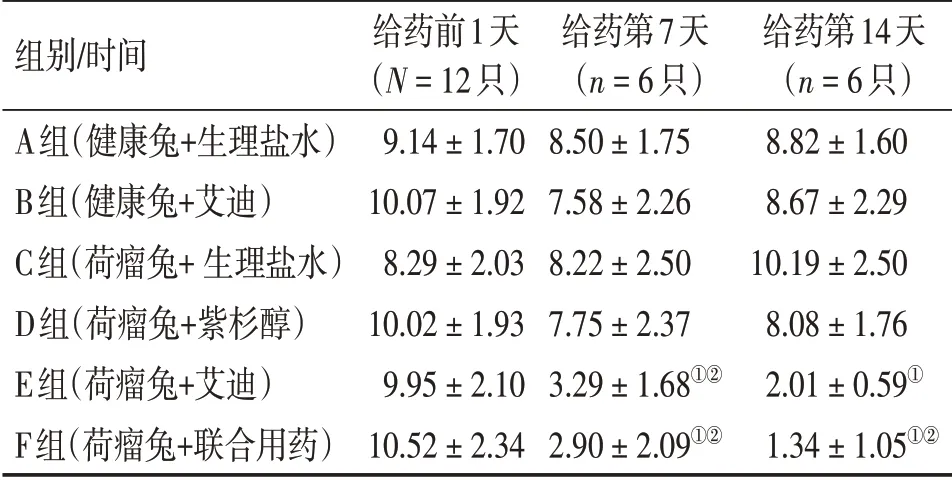
表5 各组外周血IL-6水平比较Table 5 Comparison of IL-6 level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
①P <0.05,与C组比较;②P <0.05,与D组比较
组别/时间A组(健康兔+生理盐水)B组(健康兔+艾迪)C组(荷瘤兔+生理盐水)D组(荷瘤兔+紫杉醇)E组(荷瘤兔+艾迪)F组(荷瘤兔+联合用药)给药前1天(N=12只)9.14±1.70 10.07±1.92 8.29±2.03 10.02±1.93 9.95±2.10 10.52±2.34给药第7天(n=6只)8.50±1.75 7.58±2.26 8.22±2.50 7.75±2.37 3.29±1.68①②2.90±2.09①②给药第14天(n=6只)8.82±1.60 8.67±2.29 10.19±2.50 8.08±1.76 2.01±0.59①1.34±1.05①②
表6 各组外周血IL-10水平Table 6 Comparison of IL-10 level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
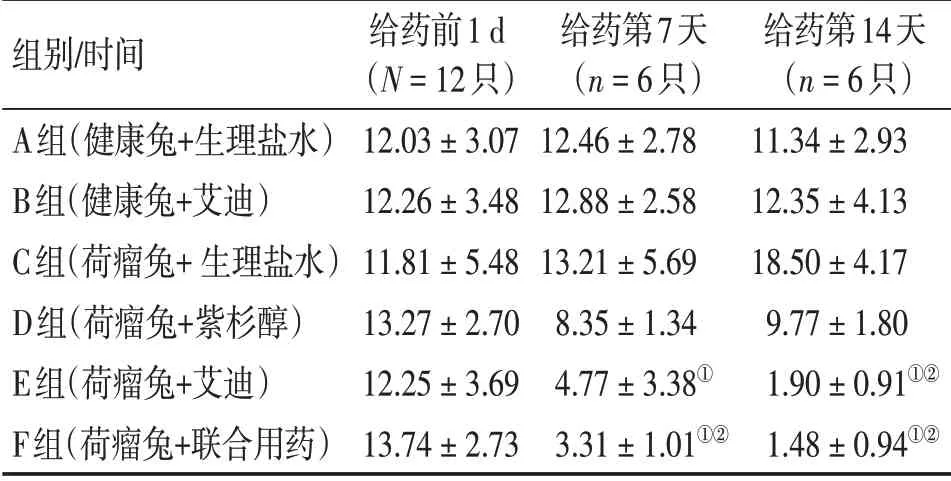
表6 各组外周血IL-10水平Table 6 Comparison of IL-10 level in peripheral blood of various groups [±s,ρ/(ng·L-1)]
①P <0.05,与C组比较;②P <0.05,与D组比较
组别/时间A组(健康兔+生理盐水)B组(健康兔+艾迪)C组(荷瘤兔+生理盐水)D组(荷瘤兔+紫杉醇)E组(荷瘤兔+艾迪)F组(荷瘤兔+联合用药)给药前1 d(N=12只)12.03±3.07 12.26±3.48 11.81±5.48 13.27±2.70 12.25±3.69 13.74±2.73给药第7天(n=6只)12.46±2.78 12.88±2.58 13.21±5.69 8.35±1.34 4.77±3.38①3.31±1.01①②给药第14天(n=6只)11.34±2.93 12.35±4.13 18.50±4.17 9.77±1.80 1.90±0.91①②1.48±0.94①②
治疗第7、14天,各组间IFN-γ水平比较结果同TNF-α。
而在IL-2水平上,治疗第7天,F组IL-2水平高于C 组(P<0.05),E、F 组IL-2 水平高于D 组(P<0.05);治疗第14天,E、F组IL-2水平高于C组,且F 组IL-2 水平显著高于D、E 组(P<0.05)。而D组治疗第7、14天IL-2水平与C组比较,差异无统计学意义(P>0.05)。
结果表明,在荷瘤兔治疗方式对比中,使用艾迪注射液后Th1型免疫因子整体呈上升趋势,且艾迪注射液联合化疗后其上升趋势更加明显。
2.3.2 Th2型免疫因子 治疗第7天,E、F组IL-6水平低于C、D组(P<0.05)。治疗第14天,E、F组IL-6 水平低于C 组(P<0.05),F 组IL-6 水平低于D组(P<0.05)。且治疗第7、14 天,E 组、F 组IL-6 水平比较,差异均无统计学意义(P>0.05)。而D组治疗第7、14天IL-6水平与C组比较,差异无统计学意义(P>0.05)。
治疗第7天,E、F组IL-10水平低于C组(P<0.05),F组IL-10水平低于D组(P<0.05)。治疗第14 天, E、F 组IL-10 水平均低于C、D 组(P<0.05)。且治疗第7、14 天,E 组、F 组IL-10 水平比较,差异均无统计学意义(P>0.05)。而D 组治疗第7、14 天IL-10 水平与C 组比较,差异无统计学意义(P>0.05)。
结果表明,艾迪注射液单独或与化疗药物联合使用可下调舌鳞癌兔Th2 型免疫因子IL-6、IL-10。
2. 4各组脾脏指数比较给药第7、14 天,C 组脾脏指数与A、B 组比较,差异均无统计学意义(P>0.05),E、F 组脾脏指数均高于C、D 组,差异均有统计学意义(P<0.05),且E、F组脾脏指数之间比较,差异均无统计学意义(P>0.05)。见表7。表明艾迪注射液单独或与化疗药物的联合使用可提高舌鳞癌兔的免疫功能,优于单纯紫杉醇化疗。
表7 各组脾脏指数比较Table 7 Comparison of spleen index of various groups (±s)
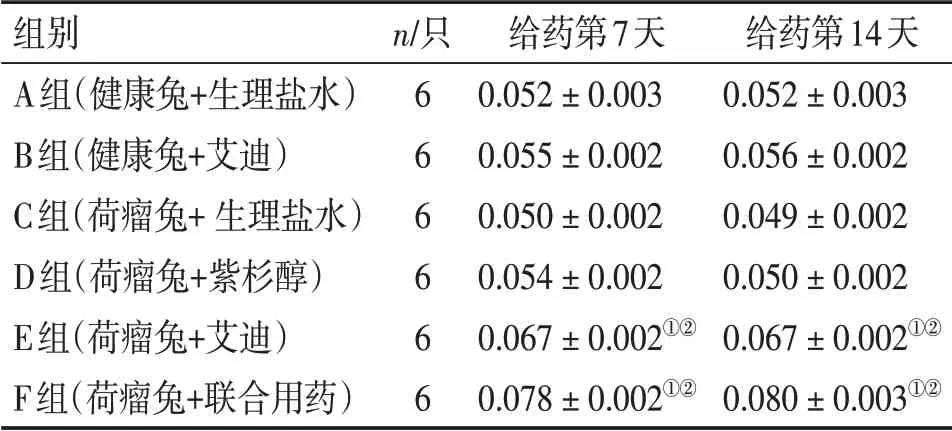
表7 各组脾脏指数比较Table 7 Comparison of spleen index of various groups (±s)
①P <0.05,与C组比较;②P <0.05,与D组比较
组别A组(健康兔+生理盐水)B组(健康兔+艾迪)C组(荷瘤兔+生理盐水)D组(荷瘤兔+紫杉醇)E组(荷瘤兔+艾迪)F组(荷瘤兔+联合用药)n/只6 6 6 6 6 6给药第7天0.052±0.003 0.055±0.002 0.050±0.002 0.054±0.002 0.067±0.002①②0.078±0.002①②给药第14天0.052±0.003 0.056±0.002 0.049±0.002 0.050±0.002 0.067±0.002①②0.080±0.003①②
3 讨论
目前,舌鳞癌主要的治疗方法是以手术治疗为主,同时辅以放疗和化疗,再联合中医药物的治疗、免疫疗法以及生物治疗等[9]。放疗、化疗是治疗舌鳞癌首选的辅助治疗方式之一,但随着放疗、化疗次数的增加,患者可能出现免疫功能下降的情况,如消化不良、骨髓抑制等不良反应等。因此,寻找化疗期间可提升免疫功能的中医药制剂正是目前舌鳞癌治疗需进一步探讨及研究的项目。
艾迪注射液是临床中常用的治疗各种恶性肿瘤中药静脉制剂,可以抑制和杀伤肿瘤细胞。其抑制和杀伤的机制主要为:(1)注射液中的斑蝥素可以阻滞肿瘤细胞的有丝分裂或使有丝分裂纺锤体发生异常;(2)人参皂苷通过激活蛋白激酶抑制剂,影响肿瘤细胞G1 期的时程,诱导细胞凋亡,抑制mRNA 的表达,使肿瘤细胞的增殖受到限制,从而达到抑制肿瘤细胞的生长。艾迪注射液因能改善肿瘤患者在放化疗过程中的不良反应,提高肿瘤患者的生存质量,故可作为癌症患者化疗的辅助用药。在临床上广泛应用于原发性肝癌[10-11]、肺癌[12-14]、妇科肿瘤[15]、消化道恶性肿瘤[16]等多种恶性肿瘤的治疗,其不仅能增强机体的特异性免疫功能,还可提高非特异性免疫功能和应激能力[17]。
近年来,Th1/Th2细胞亚群的状态是肿瘤免疫治疗研究中的一个热点[18]。伴随肿瘤免疫治疗的不断发展,因天然产物的药物毒副作用较小,同时还对免疫功能具有一定的调节作用等优点,也在肿瘤的免疫研究中备受青睐[19]。大量的研究发现,艾迪注射液能够调节肿瘤的免疫机制,对Th1/Th2型细胞因子产生影响。早在1986 年,Mosmann 等根据小鼠分泌细胞因子的不同将Th 细胞分为2 个功能亚型(Th1、Th2)[20]。随后,在人类和其他物种中发现了Th1和Th2亚型。机体在正常的生理条件,Th1/Th2是处在一个相对平衡的状态下,而在这个动态的平衡中,机体是通过调节Th1/Th2细胞的比例来调节体液免疫或细胞免疫[21-22]。但是当机体功能处于异常状态的时候,细胞因子平衡的网络就会遭到破坏,一般会伴随着Th1/Th2平衡的失调,这种现象被称为“Th1/Th2 平衡漂移”,此状态会对机体的免疫调节功能造成紊乱,致使机体趋向病态[19]。Th1 细胞主要分泌IL-2、IFN-γ、TNF-α 等,介导细胞免疫反应和迟发型过敏反应,主要在针对外源性病原体以及肿瘤的免疫防御中发挥作用。Th2 细胞分泌IL-6、IL-10 等,刺激细胞增殖和抗体产生,介导体液免疫,此类细胞因子可能介导机体的免疫抑制和肿瘤免疫逃逸[23-24]。
脾脏是机体重要的免疫器官之一,它既是外周免疫器官,也是机体免疫的第三道防线,具有丰富的淋巴细胞和巨噬细胞,但B淋巴细胞比例较大,因此与体液免疫关系更为密切。脾脏指数的高低决定了其中淋巴细胞增殖的程度,可以在一定程度上反映机体免疫功能的强弱。通常免疫器官质量的增加表示免疫能力的增强,免疫器官指数越大表明动物的免疫能力越强[25]。
本实验结果表明,单纯艾迪注射液可能促进Th1型细胞因子的分泌,抑制Th2型细胞因子的分泌,使Th1/Th2 平衡向Th1 占优势的状态漂移,且艾迪注射液联合紫杉醇注射液较单纯艾迪注射液对Th1型细胞因子的促进作用及Th2型细胞因子的抑制作用更为显著,使Th1/Th2 平衡向Th1 方向漂移,可升高脾脏指数。由于本实验中对荷瘤兔模型各项指标的观察受限于生存期,单纯艾迪注射液、艾迪注射液和紫杉醇注射液联合使用是否能够持续使Th1/Th2 的平衡向Th1 方向漂移,是否可以改善荷瘤兔的生存质量,延长生存期,改善荷瘤兔的免疫微环境还有待进一步的研究。
综上所述,本研究工作旨在探索艾迪注射液在舌鳞癌治疗中发挥的免疫调节作用,结果发现,艾迪注射液通过调节机体内Th1/Th2型细胞因子的平衡来达到治疗舌鳞癌的目的,进而起到改善机体的综合免疫状态的功效,为艾迪注射液在舌鳞癌治疗中进一步研究其作用机理和临床联合化疗的应用提供了一定的理论依据。

