宫颈癌患者新辅助化疗前后TK1、ID-1 水平变化与疗效的关系
张晓英
(咸阳市中心医院妇科,陕西 咸阳 712000)
宫颈癌是临床上常见的恶性肿瘤,发病率较高且呈逐年升高的趋势,我国每年新增宫颈癌患者13.2万例,占全世界新增病例的28%,新辅助化疗是其有效的治疗方法之一,但有部分患者对化疗不敏感而导致疗效不佳[1]。胸苷激酶1(thymidine kinase-1,TK1)是衡量细胞增殖活性的重要指标之一,细胞分化抑制因子-1(inhibitor-1 of cell differentiation,ID-1)是一种具有调节细胞分裂与增殖作用的因子。有研究结果显示,TK1、ID-1与癌症发生及预后有关[2-3]。目前,关于TK1、ID-1在评估宫颈癌新辅助化疗疗效中的作用的报道较少。为此,本研究拟通过检测宫颈癌患者新辅助化疗前后TK1、ID-1水平,分析二者与化疗疗效的关系。
1 材料和方法
1.1 研究对象
选取2015年3月—2018年3月咸阳市中心医院宫颈癌患者200例,年龄(54.42±6.72)岁,体质量指数为(23.76±3.04)kg/m2,按国际妇产科联盟分期标准分为Ⅲ期98例、Ⅳ期102例。本研究经咸阳市中心医院伦理委员会批准,患者均知情同意。
1.2 纳入标准和排除标准
纳入标准:(1)经病理学检查确诊且为晚期宫颈癌;(2)女性、年龄>18岁、无精神病病史;(3)入院前未进行过其他抗肿瘤治疗;(4)知情同意。
排除标准:(1)有本次治疗药物过敏史;(2)有手术或放疗等治疗史;(3)处于妊娠期或哺乳期;(4)患有心、肝、肾等脏器的严重疾病;(5)患有免疫、血液、神经等系统的严重疾病。
1.3 方法
1.3.1 化疗方案 所有患者均给予新辅助化疗治疗。化疗方案:采用紫杉醇+顺铂方案,先静脉滴注紫杉醇[135 mg/m2,华北制药股份有限公司(国药准字H20084439,5 mL:30 mg)],3 h后静脉滴注顺铂[60 mg/m2,云南生物谷药业股份有限公司(国药准字H20043888,6 mL:30 mg),每次连用5 d,1次/周,3~4周为1疗程,疗程间隔时间21 d。
1.3.2 TK1、ID-1水平检测 采集所有宫颈癌患者化疗前及化疗2个疗程后的外周静脉血6 mL,860×g离心12 min,分离血清,采用酶联免疫吸附试验检测TK1、ID-1水平,TK1试剂盒[最低检测限≤1.0 pmol/L、线性范围1~20 pmol/L、批间变异系数(coefficient of variation,CV)<15%、批内CV<15%、标准曲线r≥0.990]和ID-1试剂盒(最低检测限≤5.0 μg/L、线性范围5~160 μg/L、批间CV<11%、批内CV<9%、标准曲线r≥0.990)购自上海信裕生物科技有限公司。
1.4 疗效评定
化疗疗效标准参照世界卫生组织实体瘤评价标准[4]:(1)完全缓解(complete remission,CR):肿瘤完全消失且无新病灶出现,持续≥1个月;(2)部分缓解(partial remission,PR):肿瘤最大直径与最大垂直直径的乘积(D)缩小≥50%并持续≥1个月,其他病变无进行性加重;(3)疾病稳定(stabilization of disease,SD):D缩小<50%或增大≤25%;(4)疾病进展(progression of disease,PD):D增大>25%。以CR、PR为化疗有效,SD、PD为化疗无效。
1.5 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用独立样本t检验。计数资料以率表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各项指标判断宫颈癌化疗有效性的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌患者化疗的预后情况
200例宫颈癌患者经化疗后,CR 18例(9.00%)、PR 94例(47.00%)、SD 48例(24.00%)、PD 40例(20.00%),化疗有效率为56.00%。
2.2 化疗有效组和化疗无效组血清TK1、ID-1水平的比较
化疗无效组化疗后血清TK1、ID-1水平明显高于化疗前(P<0.05)。化疗有效组化疗后血清TK1、ID-1水平明显低于化疗前(P<0.05)。化疗有效组化疗后血清TK1、ID-1水平明显低于化疗无效组(P<0.001),且化疗后TK1、ID-1水平下降比明显高于化疗无效组(P<0.001)。见表1。
表1 化疗有效组和化疗无效组血清TK1、ID-1水平的比较 ±s
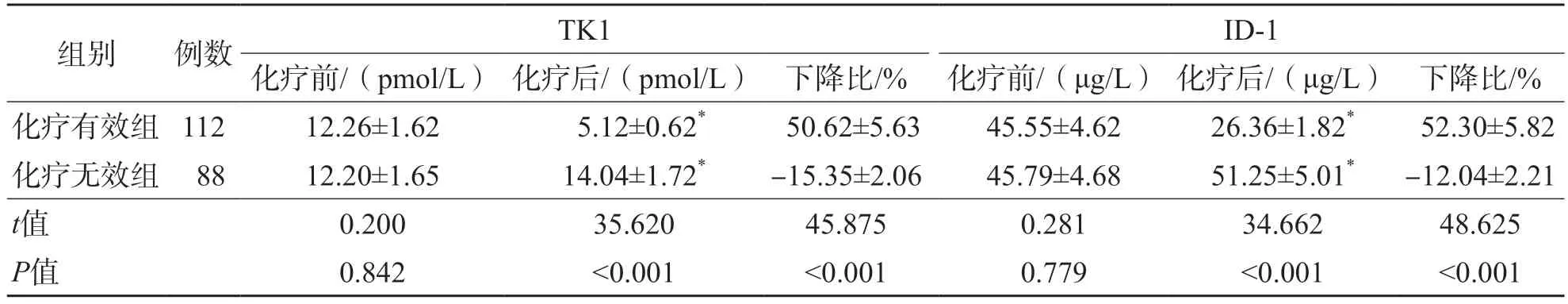
表1 化疗有效组和化疗无效组血清TK1、ID-1水平的比较 ±s
注:与同组化疗前比较,*P<0.05
2.3 各项指标判断宫颈癌化疗有效的效能
ROC曲线分析结果显示,TK1下降比判断宫颈癌化疗有效的最佳临界值为>24.0%,曲线下面积(area under curve,AUC)为0.756,ID-1下降比判断宫颈癌化疗有效的临界值为>36.0%,AUC为0.738,二者联合检测的AUC为0.902。见表2、图1。

表2 各项指标判断宫颈癌化疗有效的效能
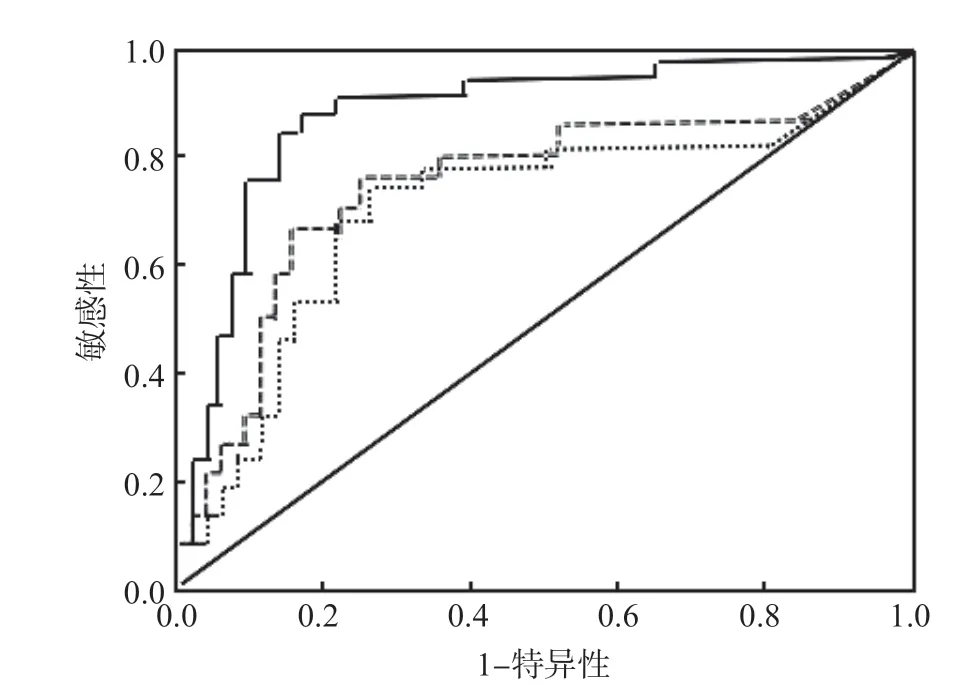
图1 各项指标判断宫颈癌化疗有效的ROC曲线
3 讨论
宫颈癌是女性常见的恶性肿瘤之一,可导致不规则阴道出血、尿频、水肿等症状,但因其症状与宫颈炎、宫颈上皮瘤变等良性宫颈疾病相似,故多数患者被诊断时已处于中晚期阶段,失去了最佳的手术治疗时机[5]。目前,化疗是宫颈癌患者常用的治疗手段之一,其中紫杉醇+顺铂方案的新辅助化疗可有效降低患者的肿瘤分期,延长生命,其临床疗效已逐渐被认可[6]。
有研究结果显示,约有30%的宫颈癌患者对化疗不敏感,因此如何早期评估患者的化疗疗效有重要意义,以避免延误治疗和盲目化疗,增加不良预后的风险[7]。本研究结果显示,宫颈癌患者化疗有效率为56.00%,表明有部分宫颈癌患者对化疗不敏感。本研究的化疗有效率略低于赵艳芳等[8]、LAPRESA等[9]的研究结果,这可能是由于本研究入选的患者均处于Ⅲ、Ⅳ期,其病情较为危重,故更易导致疗效欠佳,也可能与本研究纳入例数较少有关。宫颈癌化疗疗效的监测和评估主要依靠实验室和影像学等检查,但影像学检查易受医师个人经验、费用等因素的影响;穿刺活检操作复杂、取材困难、检查时间长,不适用于早期评估化疗疗效[9-10],而肿瘤标志物检测具有操作简单、成本较低、取材简便等优势,可作为评估患者疾病转归的重要指标[11-12]。
本研究结果显示,化疗无效组化疗后血清TK1、ID-1水平明显高于化疗前(P<0.05),化疗有效组化疗后血清TK1、ID-1水平明显低于化疗前(P<0.05),化疗有效组化疗后血清TK1、ID-1水平明显低于化疗无效组(P<0.001),且化疗后TK1、ID-1水平下降比明显高于化疗无效组(P<0.001),表明TK1、ID-1与宫颈癌新辅助化疗疗效有关。TK1是衡量细胞增殖活性的重要指标,是嘧啶代谢循环中的关键酶之一,可催化胸腺嘧啶脱氧核苷与磷酸脱氧核苷之间的转化。TK1在正常机体中的含量较低,当细胞发生癌变时可被大量合成并释放至血中,因此可作为宫颈癌诊治的重要标志物之一[13-14]。ID-1是一种螺旋-环-螺旋蛋白,其表达与肿瘤的发生进展、浸润及预后密切相关。ID-1高表达可钝化肿瘤抑制因子、对促细胞分化的碱性转录因子产生负调节作用,从而促使癌细胞分裂和增殖[15-16]。因此,化疗有效者对紫杉醇、顺铂等化疗药物敏感,癌细胞被有效抑制或杀死,导致TK1、ID-1水平降低;而化疗无效者对化疗药物不敏感,癌细胞难以被有效抑制,病情持续恶化,导致TK1、ID-1水平升高。ROC曲线分析结果显示,TK1下降比和ID-1下降比判断宫颈癌化疗有效的AUC分别为0.756、0.738,最佳临界值分别为>24.0%、>36.0%,敏感性为82.14%、85.71%,特异性为77.27%、81.82%,二者联合检测的AUC、敏感性和特异性分别为0.902、96.43%、95.45%,均明显高于单项检测。表明TK1、ID-1可作为评估宫颈癌化疗疗效的重要指标,且二者联合检测的效能更高。其原因可能是TK1、ID-1单项检测时易受多种因素影响,导致判断效能欠佳,而二者联合检测能避免单项评估的不足而提高了评估效能。若化疗后TK1或ID-1下降比较低时(ID-1≤36.0%、TK1≤24.0%),应警惕化疗无效并寻求其他有效的治疗方法,以预防病情恶化。
综上所述,TK1、ID-1水平与宫颈癌化疗疗效有关,可作为评估化疗疗效的指标,且二者联合检测评估化疗有效性的效能更高。

