HE和免疫组化染色观察人体结肠系膜淋巴管构筑
赵学影,肖 慧,胡子豪,陈云帆,王黎源,隋东莉
(蚌埠医学院 1.人体解剖学教研室;2.临床医学院,安徽 蚌埠 233030)
近年来有关肠道黏膜免疫的研究已成为很多学者关注的研究领域[1-2],肠系膜淋巴系统是构成黏膜免疫的重要组成部分。其中肠系膜淋巴管具有重要的生理功能,此外还具有重要的临床意义,如与肠系膜淋巴结炎、腹腔淋巴管瘤等疾病关系密切[3]。然而,有关人体结肠系膜淋巴管的分布与结构的研究,由于实验方法的局限性仍有很多不明之处。本文采用免疫组织化学方法探讨了人体结肠系膜淋巴管的组织学特征,为进一步研究肠系膜物质转运机制提供必要的形态学资料,有助于对临床炎症扩散及癌细胞转移等机制的分析。
1 材料和方法
1.1材料结肠系膜标本16例由某院病理科提供,经病理检查,这些标本均未发现肿瘤病灶转移及浸润;Leica DM400B生物显微镜,石蜡包埋机和切片机,购自德国Leica公司;试剂:多聚甲醛,酒精,二甲苯,苏木素,伊红,PBS等。
抗体来源:即用型鼠抗人单克隆抗体D2-40,即用型非生物素免疫组化ElivionTM plus/HRP检测试剂盒及DAB显色试剂盒均购自福州迈新生物技术开发有限公司。
1.2方法
1.2.1取材,石蜡切片,HE染色结肠系膜经PBS清洗后,移入4 ℃中性多聚甲醛中固定24 h。梯度乙醇脱水,透明,石蜡包埋,4 μm连续切片,行常规HE染色,显微镜下观察其微结构,重点观察其脉管系统的构筑特点。
1.2.2免疫组化染色组织标本以4%多聚甲醛中固定24 h。标本梯度脱水、透明,石蜡包埋、连续切片。将组织切片脱蜡至水,于0.01 mol·L-1柠檬酸钠缓冲液(pH 6.0)中微波抗原修复20 min,室温下冷却,然后以0.01 mol·L-1磷酸盐缓冲液(PBS,pH 7.4)冲洗;滴加3% H2O2溶液抑制内源性过氧化物酶,室温下孵育10 min,PBS冲洗;10%山羊血清湿盒内孵育10 min,滴加D2-40单克隆抗体,室温下孵育60 min;滴加Elivision Super免疫组化检测试剂于湿盒内室温下孵育30 min,PBS冲洗3次,每次3~5 min,滴加二氨基苯胺(DAB)显色溶液5min,苏木素复染,中性树胶封片。光学显微镜下观察阳性细胞并拍照。
2 结 果
2.1HE染色切片的光镜观察HE染色中清晰可见大量的脂肪细胞、血管、淋巴组织(图1A-B)。少数管腔内可见红细胞,管壁结构符合血管壁的一般特点,可确认是血管。从形态上看,小动脉管壁较厚,外绕一肌层,形态较为规则,小静脉管壁较薄;淋巴管管壁相对较薄,管腔较大,有时可见到腔内有均匀一致的絮状物(图1A-B)。此外,在组织切片中可见大部分管腔样结构透明,因无特征性不同,难以定论为血管或淋巴管或组织间隙(图1-B)。

图1 结肠系膜组织苏木精-伊红染色观察
A: 示大血管周围的小血管、淋巴管(L);B: 示小血管、淋巴管(L)以及大量管腔样结构,其中淋巴管管壁较薄,管腔较大,有时可见到腔内有均匀一致的絮状物(A、B×200)。
2.2免疫组织化学染色切片的光镜观察观察免疫组织化学染色的组织切片,发现单抗D2-40在淋巴管内皮细胞得以标记,淋巴管的管壁呈现连续的棕色,而血管淡染或不显色,两者区分明显。从组织形态上看,淋巴管配布在血管周围,形状不规则,呈条索状或椭圆状,管壁较薄,由单层内皮细胞构成,无肌层,有较多皱褶;部分淋巴管壁呈开放状态;管径变化较大,约20~200 μm。血管淡染或不染色(图2)。
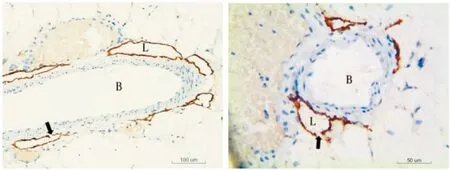
图2 结肠系膜组织免疫组织化学染色观察
结肠系膜组织内D2-40的表达,可见淋巴管(L)呈棕色,形状不规则,管壁有较多皱褶;血管(B)淡染或不着色; ↑表示淋巴管开放处(左图×200,右图×400)。
3 讨 论
传统形态学观念认为,淋巴管分为毛细淋巴管、淋巴管(收集淋巴管)和淋巴导管,毛细淋巴管作为淋巴管道的起始部分,具有调节体液平衡、吸收组织间隙蛋白质等功能,而系膜内的淋巴管主要来自肠管壁内淋巴管及系膜内毛细淋巴管,然后进入收集淋巴管[4]。长期以来,由于缺乏特异性的淋巴管研究方法与标记技术,关于人体肠系膜淋巴管的形态学研究报道较少。随着许多特异性表达于淋巴管内皮细胞的标记物被逐渐发现,如D2-40、血管内皮生长因子受体3(VEGFR-3)、淋巴管内皮透明质酸受体1(LYVE-1),免疫组织化学染色法才在淋巴管形态学研究中被广泛应用[5-7],该法具有较强特异性和敏感性,不仅能观察淋巴管的分布,还能显示其结构特征,是目前淋巴管形态学研究的首选方法。
D2-40是一种抗M2A癌胚膜抗原的单克隆抗体,可识别一种分子量为40 kDa 的唾液酸糖蛋白,该糖蛋白特异性表达于淋巴管内皮细胞,较其它内皮细胞标志物,如VEGFR-3、LYVE-1等,D2-40特异性最为显著[8-11]。本研究采用D2-40作为淋巴管标志物进行检测,将免疫组织化学染色法应用于淋巴管特异性标记的研究中,以区别血管。实验结果显示D2-40特异定位于结肠系膜组织的毛细淋巴管内皮细胞,D2-40 标记的淋巴管染色清晰,其形状不规则,呈椭圆状或条索状,可能与正常生理状态下,组织内仅有部分毛细淋巴管参与淋巴液的形成和运输,大部分毛细淋巴管作为潜在的功能储备而处于塌陷状态有关[12]。
本实验观察淋巴管内径约20~200 μm,血管淡染或未被染色。一般认为毛细淋巴管内径较毛细血管大,在10~200 μm之间,约是毛细血管宽的5~8倍[13],张学锋等观察的微淋巴管一般比伴行的微血管宽2~6倍[4];也有文献报道毛细淋巴管口径大约30~80 μm,由单层内皮细胞构成[14],壁薄腔大,有的可见微瓣膜,其中内皮细胞可产生多种血管活性因子,如:前列腺素类、血栓素等,不仅对血管具有调节作用,亦能作用于微淋巴管上的同型受体,对淋巴管自律收缩运动具有强烈的调节作用[15]。而微淋巴管的自律运动作为重要的驱动力,在促使淋巴液回流,以维持组织间隙的内环境稳定和生物体免疫功能方面有重要作用[4,16]。但也有作者认为瓣膜结构对维持淋巴管的外形、淋巴引流的通畅以及防止淋巴液逆流等起到了重要作用,毛细淋巴管周围无平滑肌纤维,具有瓣膜的集合淋巴管平滑肌层通常也不连续,因此淋巴管固有收缩性较低,淋巴引流可能主要靠毗邻器官间的相互作用来调节,并认为淋巴管瓣膜阻止了器官间淋巴管的直接物质交换,这种物质交换主要靠血液循环补偿[17]。Michailova[18]认为脏层腹膜的物质转运途径主要靠丰富的血管,壁层腹膜则以淋巴管为主。本实验观察到结肠系膜血管周围存在大量的淋巴管,可能是物质转运至血液循环的一种潜在性途径或相邻血管间的通路[19]。可见,淋巴系统在进化过程中,与血液和组织液共同构成复杂、完善的管道网络,维持细胞稳态的同时,作为免疫系统重要的组成部分,完成防御功能[20],而器官内淋巴及血液的鉴别分析将对探讨局部组织细胞的调节因素与机制起重要作用。
结肠系膜具有相对移动性,其淋巴管缺乏膈腹膜淋巴引流的结构特征,可能在清除颗粒物质方面具有某些局限性,淋巴管有时起于乳斑和毛细血管周围,起于乳斑的系膜淋巴管与间皮细胞之间的结缔组织无明显基底膜[17]。HE染色在光镜下只能观察到有腔的淋巴管与毛细淋巴管,不能观察到塌陷的毛细淋巴管,实验结果显示在光镜下毛细淋巴管与毛细血管及其相似,HE染色很难将两者区分开来;较常规HE染色,D2-40免疫组化染色能更敏感和特异地标记淋巴管,背景清晰,能很好地显示周围的组织结构,并且在预测淋巴结微转移方面有更高的可靠性,具有良好的临床病理应用价值,建议在常规病理诊断中使用,特别是HE染色未见淋巴结转移的病例[21]。完整的毛细淋巴管壁基膜在维持淋巴管正常形态和功能上均有重要作用,淋巴管基膜不完整或缺如,大大削弱了淋巴管管壁的屏障功能[22]。本实验观察到部分淋巴管处于开放状态,Casly-Smith[23]认为由于淋巴管缺乏基膜、内皮细胞间缺乏粘着装置、管外锚丝的牵拉等作用,当组织水肿或轻度损伤时,淋巴管内皮间连接可达50%的开放率。而肿瘤细胞释放的胶原酶IV、透明质酸酶以及一些使内皮细胞回缩致连接复合体损害的活性物质也会使淋巴管壁受到破坏[24],这些改变也为癌细胞进入淋巴管道提供有利条件。

