CCAAT 增强子结合蛋白δ 在前列腺癌进展及预后中的作用
凌济忠张玉婷习明万颂华伟江敏耀万跃平
(1.广州市花都区花山镇卫生院外科,广东 广州510880; 2.广州医科大学南山学院南山班,广东 广州511436; 3.南方医科大学花都区人民医院泌尿外科,广东 广州510800)
前列腺癌是全球46 个国家男性癌症死亡的主要原因[1]。 2019 年美国预计将新增174 650 例前列腺癌患者,位居男性癌症发病率第1 位,同时预计新增31 620 例前列腺癌死亡患者,位居男性癌症死亡率第2 位[2]。 为了防止过度诊断和过度治疗,前列腺特异性抗原筛查在逐年减少,从而使前列腺癌发病率逐年下降,但是晚期诊断同时在逐年增加。 目前正面临着缺乏在早期诊断中高危、致死性前列腺癌的手段,又能防止过度诊断和过度治疗的严峻挑战。 CCAAT /增强子结合蛋白δ(CEBPD)是一种转录因子,涉及一系列的生理过程,如细胞分化、代谢、炎症、生长停滞和细胞死亡[3]。 近年来,有许多研究表明CEBPD 与癌症的进展相关,如白血病[4]、肝细胞 癌[5]、乳 腺 肿 瘤[6]、尿 路 上 皮 癌 等[7]。 然 而,CEBPD 在前列腺癌中的表达情况及CEBPD 在前列腺癌进展和预后方面的作用的报道较少。 本研究使用免疫组织化学检测CEBPD 在前列腺癌组织中的表达情况,结合Taylor 数据库分析CEBPD 表达水平与患者临床病理特征和生存期的关系,探讨CEBPD在前列腺癌进展和预后中所起的作用。
1 材料与方法
1.1 样本来源
前列腺癌及正常组织组微阵列芯片购买自西安艾丽娜生物科技有限公司(Cat No:PR807a),包含正常组织3 例,边缘组织7 例,腺癌组织50 例,增生组织20 例。 研究生存曲线的数据来源于Taylor 数据库,包含150 例前列腺癌和29 例癌旁组织(https:/ /www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc =GSE21032)。
1.2 实验方法
免疫组织化学实验: 按照迈新生物技术UltraSensitiveTMSP IHC 试剂盒(Cat. No:KIT-0305)说明进行免疫组化染色,55 ℃烘烤组织芯片1 ,二甲苯、酒精梯度脱蜡,封闭内源性过氧化物酶,枸橼酸盐抗原修复,血清封闭,一抗CEBPD(1 ∶40;博奥森,Cat No:bs-13821R)4 ℃孵育过夜,二抗室温孵育30 min,三抗室温孵育15 min,DAB 试剂盒显色,苏木素盐酸复染细胞核。 芯片染色结果根据强度和范围进行评估,染色强度分为0、1、2、3 共4 个等级,染色范围分为0(0 ~5%)、1(6% ~25%)、2(26% ~50%)、3(51%~75%)、4(76%~100%)5 个等级,最终得分为染色强度与染色范围之和。
1.3 统计方法
采用SPSS 20.0 统计软件进行统计学处理。 计量资料以±s表示,数据比较采用独立样本t检验,生存分析采用Kaplan-Meier 检验,P<0.05 表明差异有统计学意义。
2 结果
2.1 前列腺癌组织芯片中CEBPD 表达的检测
在前列腺癌组织芯片中,利用免疫组织化学实验检测CEBPD 蛋白的表达水平,结果可见前列腺癌组织中CEBPD 蛋白染色主要位于细胞质中,染色强度为弱阳性或阳性。 染色强度定量分析结果显示,正常前列腺组织和前列腺癌组织中CEBPD 染色评分分别为2.96±1.72 和3.70±1.40,其差异无统计学意义(P=0.056)(见表1)。 但是在前列腺癌患者中,Gleason 评分<8 的癌组织中的CEBPD 染色评分高于Gleason 评分≥8 的癌组织(P=0.032)(见图1)。

图1 前列腺癌组织芯片中CEBPD 的检测结果Figure 1 Detection results of CEBPD in prostate cancer tissue microarray
2.2 CEBPD 表达与前列腺癌患者临床病理特征的关系
通过前列癌组织芯片的临床数据资料,探索CEBPD 蛋白表达水平与临床病理特征的关系,结果显示CEBPD 表达与Gleason 评分(P<0.032)相关,同时结合Taylor 公共数据库分析,发现CEBPD 表达与患者的年龄(P=0.041)、Gleason 评分(P<0.01)、临床分期(P=0.018)、是否转移(P<0.01)、是否死亡(P=0.029)、是否生化复发(P<0.01)呈负相关(见表1)。
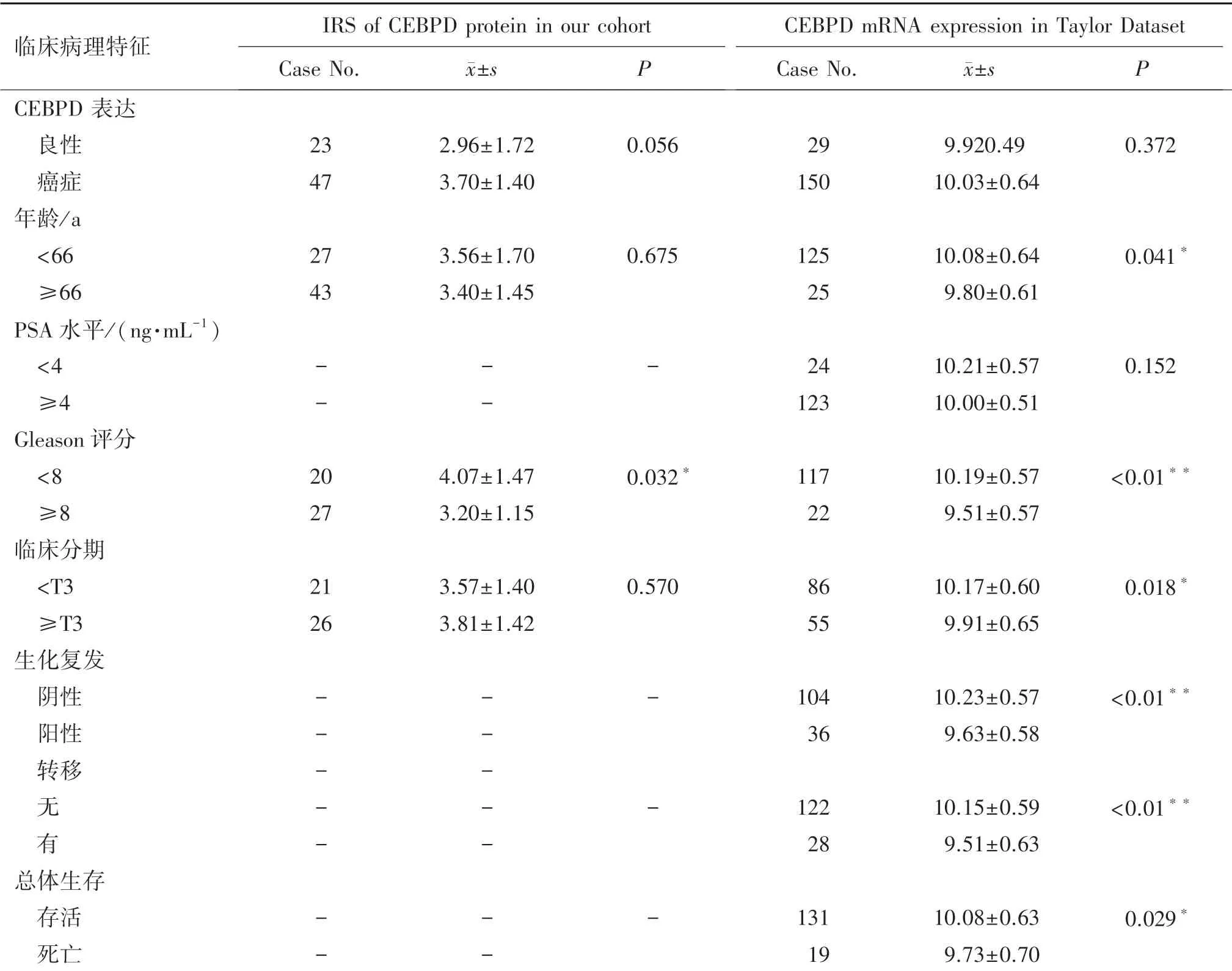
表1 前列腺癌患者CS 表达与临床病理特征的关系Table 1 Relationship between CS expression and clinicopathological features of prostate cancer patients
2.3 CEBPD 在Taylor 数据库中的生存曲线统计
通过Taylor 公共数据库探索CEBPD 的表达与前列腺癌病人的生存期的关系,以CEBPD基因表达量的中位数为界线分为高表达组和低表达组,CEBPD 低表达病人的无生化复发生存率比CEBPD高表达病人的生存率低(P<0.01),总体生存率两组差异无统计学意义(P=0.227)(见图2)。
2.4 CEBPD 在Taylor 数据库中的COX 回归分析统计
基于CEBPD 在Taylor 数据库中的无生化复发生存曲线有统计学差异的基础上,进一步建立COX回归模型,分析单因素和多因素的条件下,CEBPD与无生化复发生存率的相关性。 结果显示,在单因素分析和多因素COX 回归生存分析中,CEBPD 高表达与前列腺癌患者的生化复发呈负相关(单因素:P<0.01;多因素:P=0.032)(见表2)。
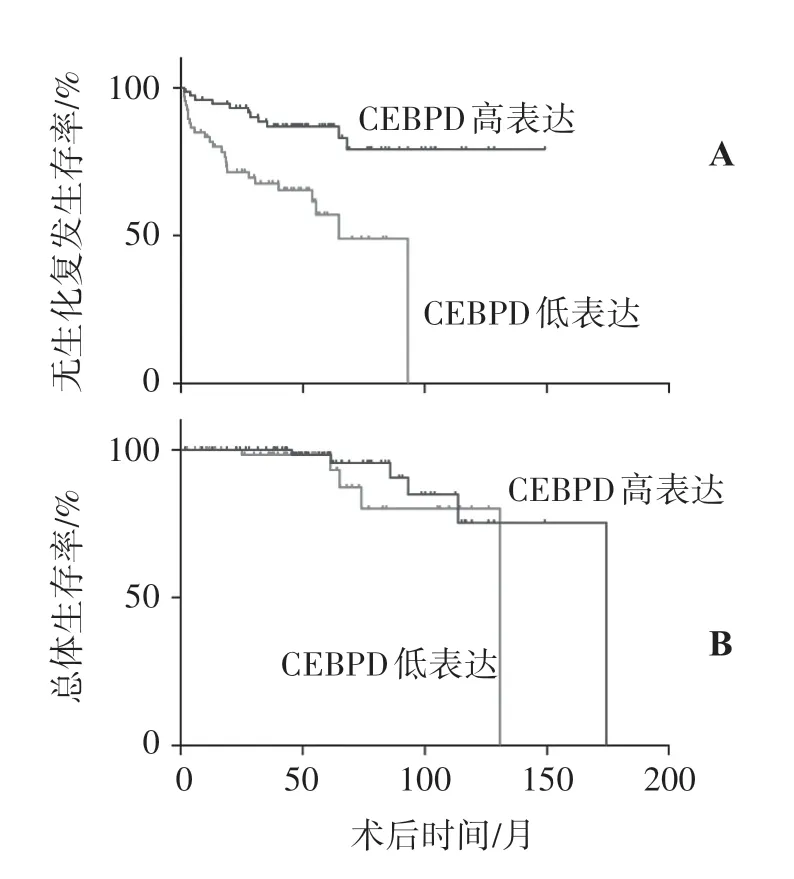
图2 Taylor 数据库中CEBPD 的生存曲线分析Figure 2 Survival curve of CEBPD in Taylor database
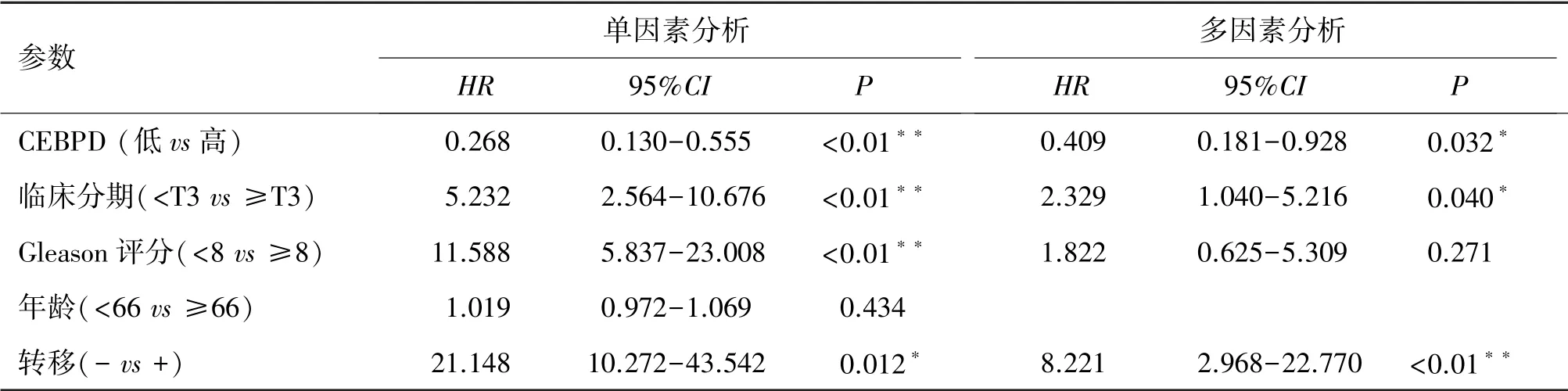
表2 前列腺癌患者的无生化复发COX 回归分析与临床病理特征的关系Table 2 Relationship between non-BCR COX regression and clinicopathological features in patients with prostate cancer
3 讨论
CEBPD 属于CCAAT /增强子结合蛋白家族,与其余4 个家族成员一起作为转录因子起调节细胞生物过程的作用,包括细胞分化、运动、生长停滞、增殖和死亡。 CEBPD 在正常生理条件下以相对低的水平表达,并且被多种细胞外刺激上调,例如白细胞介素-6,脂多糖,白细胞介素-1β,肿瘤坏死因子α,干扰素-α和干扰素-γ。 CEBPD 的过表达可诱导癌细胞生长停滞和凋亡[5]。 此外,在Cebpd-/-/HER2/neu小鼠中观察到乳腺肿瘤多样性的增加[6]。 这些结果表明CEBPD 可能是肿瘤抑制因子。 与炎症反应转录因子NF-κB 和STAT3 不同,它们在肿瘤发生后一直被激活,CEBPD 的失活已经在许多癌症中被观察 到,包 括 肝 癌,乳 腺 癌 和 白 血 病[5,8-10]。 但 是CEBPD 作为抑癌基因的作用并不普遍,对于尿路上皮癌CEBPD 拷贝数扩增和过表达可能与预后不良和促进肿瘤转移有关[11]。 基于上述看似矛盾的研究发现,根据肿瘤的类型或者细胞的来源,CEBPD可能与更好或更差的预后相关联,但要证实其在特定类型癌症中的真正作用还需要进一步的研究。
本研究通过免疫组化染色前列腺癌组织芯片发现,在该芯片中CEBPD 在前列腺良性组织和前列腺癌组织中的表达没有显著差异,有可能是因为良性组织例数过少,存在抽样误差。 但是在前列腺癌患者中,Gleason 评分<8 的癌组织中的CEBPD 表达水平高于Gleason 评分≥8 的癌组织,说明在前列腺癌中CEBPD 可能作为抑癌基因发挥作用。 其次,在Taylor 公共数据库的分析中,发现CEBPD 表达与患者的年龄、Gleason 评分、临床分期、是否转移、是否死亡、是否生化复发呈负相关,同时CEBPD 高表达的前列腺癌患者的无生化复发生存率增高。 结合COX 回归模型,单因素分析提示提示CEBPD、病理分期、Gleason 评分和是否转移是前列腺癌患者无生化复发生存率的预后因子,而进一步的多因素分析则提示CEBPD、病理分期和是否转移是前列腺癌患者无生化复发生存率的独立预后因子,CEBPD 表达高的患者生化复发的风险较小。 上述结果说明,CEBPD 的表达与前列腺癌的进展和预后密切相关。
本研究结果提示CEBPD 表达可能对前列腺癌的临床预后有预测作用,可以通过检测CEBPD 表达水平,联合PSA 检测、Gleason 评分、病理分期等其他临床技术,更好地分析和评估癌症进展的风险和预后,有希望成为一种新的生物标记物。 同时,CEBPD 参与调节细胞生物运动的复杂网络,CEBPD如何在人前列腺癌中发挥抑癌因子的调控作用还有待进一步的实验研究。

