肝靶向肽-人肿瘤坏死因子融合基因的克隆、可溶性表达及鉴定
佟陈昀颢郭平马艳
(广东药科大学1.公共卫生学院; 2.生命科学与生物制药学院,广东 广州510006)
人肿瘤坏死因子(human tumor necrosis factor α,TNFα)是一种可直接杀伤肿瘤细胞的细胞因子[1]。 TNFα 在体内单独应用具有抗肿瘤作用,与IFN、抗癌药物、高温疗法等联合应用治疗肝癌可增强疗效,然而TNFα 生物学功能的复杂性又使其在临床应用时表现出明显的毒副作用[2],如促炎症效应、高热、寒战、严重低血压等,并且即使全身用药时在人的耐受剂量范围内,肿瘤内部达不到治疗需要的有效浓度,因此严重限制了其在肿瘤治疗中的进一步应用,所以降低TNFα 的毒副作用或增加其在肿瘤局部的浓度是应用TNFα 抗肿瘤的关键。 目前认为TNFα 局部靶向性应用可以在不引起严重毒副反应的情况下,将TNFα 在肿瘤组织中富集作用于肿瘤细胞[3],取得较好的效果,大幅度地降低了TNFα 的用量和毒副作用。
环子孢子蛋白(circumsporozoite protein,CSP)是覆盖于疟原虫子孢子表面的一种锚定蛋白[4],其N端I-plus 片段能与肝细胞表面硫酸乙酰肝素蛋白聚糖( heparan sulfate proteoglycan,HSPG)发生特异性结合而靶向肝脏[5]。 本课题组前期已成功构建CSP I-plus 修饰的干扰素和内皮抑制素,结果显示均具有良好的靶向性与生物活性[6-8]。 本实验通过基因重组技术SOEing PCR 扩增CSP-TNFα融合基因,并构建原核表达载体CSP-TNFα/pET21b 对其进行大肠杆菌原核表达,以期获得肝靶向肽-人肿瘤坏死因子CSP-NFα 融合蛋白,为下一步研究其生物学活性奠定基础。
1 材料与方法
1.1 材料与试剂
HepG2 细胞、E. coliDH5α、E. coliBL21(DE3)和质粒pET21b 均为本实验室保存,TaqDNA 聚合酶、内切酶NdeⅠ和XhoⅠ、T4 DNA 连接酶、pMD20-T 购自TaKaRa 公司;第一链合成试剂盒购自Invitrogen 公司,总RNA 提取试剂盒、DNA 纯化回收试剂盒和质粒小量提取试剂盒购自Tiangen 公司;Imidazole(咪唑)、TEMED 购自BioRad 公司;酵母提取物和胰蛋白胨购自Oxoid 公司、Anti-6×His 鼠多克隆抗体、山羊抗小鼠IgG HRP 标记二抗购自Santa cruz 公司;HisTrap Kit 亲和层析填料、XK 16/20 层析空柱购自GE healthcare 公司。
1.2 引物的设计
根据NCBI Genbank 公布的TNFα 和CSP I-plus基因序列,用Primer Premier 5.0 生物软件设计特异性引物P1 ~P4,如表1 所示。 P1、P2 引物扩增TNFα基因,约702 bp,引物P3、P4、P2 扩增CSPTNFα融合基因,不含编码TNFα 信号肽基因序列,约543 bp。 引物P2 含有无终止子TNFα C 端互补序列和XhoⅠ限制性内切酶位点引物,P3 含有NdeⅠ限制性内切酶位点和编码CSP I-plus 19 个氨基酸的部分序列,引物P4 含有与P3 相同序列、编码CSP I-plus 19 个氨基酸的其余部分序列和编码无信号肽TNFα N 端序列。 引物由Invintrogen 公司合成。
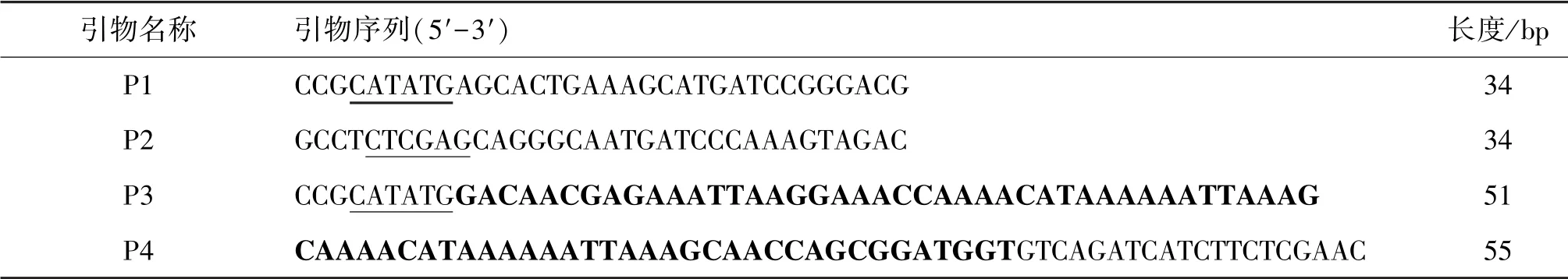
表1 引物序列Table 1 Primer sequences
1.3 方法
1.3.1 扩增CSP-TNFα 融合基因提取人肝癌细胞HepG2 总RNA,以P1 和P2 为引物,RT-PCR 扩增TNFα基因,再以TNFα基因序列为模板,以P3、P4、P2 为引物,SOEing PCR 扩增CSP-TNFα融合基因。1%凝脂糖凝胶电泳检测PCR 结果。
1.3.2 构建重组质粒CSP-TNFα/pMD20-T纯化回收CSP-TNFα融合基因的PCR 产物,与pMD20-T 载体连接,并转化至E.coliDH5α 感受态中进行蓝白斑筛选。 挑取白色单菌落进行PCR 鉴定,对PCR鉴定阳性菌株摇菌抽提质粒进行酶切鉴定,将酶切鉴定为阳性菌株送上海Invitrogen 公司进行测序。
1.3.3 构建表达载体CSP-TNFα/pET21bCSPTNFα/pMD20-T 和pET21b 经过双酶切后胶回收,将获得的CSP-TNFα 片段和线性化pET21b 连接,并转化至E.coliDH5α 感受态中进行抗性筛选,挑取单菌落摇菌抽提质粒进行酶切鉴定,将鉴定为阳性菌株送上海Invitrogen 公司进行测序鉴定。
1.3.4 CSP-TNFα 的生物信息学分析利用Prot Param(https:/ /web.expasy.org/protparam/)分析表达载体中CSP-TNFα 开放阅读框编码蛋白的基本参数,包括:氨基酸组成、分子量、理论等电点,在大肠杆菌、哺乳动物和酵母中的半衰期,脂溶性指数及不稳定指数等。
1.3.5 CSP-TNFα 的可溶性表达及鉴定将表达载体CSP-TNFα/pET21b 转化到E.coilBL21 感受态中,获得CSP-TNFα/pET21b-T/BL21 重组菌株,按参考文献[8]方法,挑取单菌落培养过夜后分别于37 ℃、20 ℃下诱导表达4 h、20 h。 收集菌体超声裂解,将裂解上清和沉淀进行SDS-PAGE 和Westernblot 鉴定。
1.3.6 CSP-TNFα 纯化将可溶性表达获得的菌体裂解上清进行Ni-NTA 亲和层析纯化,方法参照文献[8]。 CSP-TNFα 融合蛋白C 端有6×His 标签,可与Ni2+离子发生特异性结合,吸附在Ni 柱上。 用0%~100%咪唑洗脱,收集洗脱液SDS-PAGE 分析。
2 结果与分析
2.1 CSP-TNFα 融合基因的扩增及鉴定
以HepG2 cDNA 为模板,以P1 和P2 为引物RT-PCR 扩增全长TNFα基因,结果如图1 所示,在702 bp 处有清晰的目的条带,与预期大小相符。 以扩增的全长TNFα基因产物为模板,通过引物P3、P4、P2,SOEing PCR 扩增大小为543 bp 的不含编码TNFα 信号肽序列和终止密码子的CSP-TNFα融合基因。 琼脂糖凝胶电泳结果显示:在约543 bp 处有大小相符的目的条带,初步判定CSP-TNFα融合基因扩增成功(图2)。
2.2 重组质粒CSP-TNFα/pMD18-T 鉴定
SOEing PCR 产物纯化后进行TA 克隆,对蓝白斑筛选结果为白色单菌落进行PCR 鉴定,结果如图3,在约543 bp 处有特异性条带。 酶切鉴定发现,与菌落PCR 结果一致,初步判定约543 bp 处条带为融合基因,在2 000~4 000 bp 之间条带为pMD20-T载体(图4)。 测序结果:融合基因含有编码CSP Iplus 序列、无信号肽和终止密码子的TNFα 序列,其中TNFα 序列与NCBI:NM_000594.3 一致,无突变,说明CSP-TNFα融合基因扩增成功。
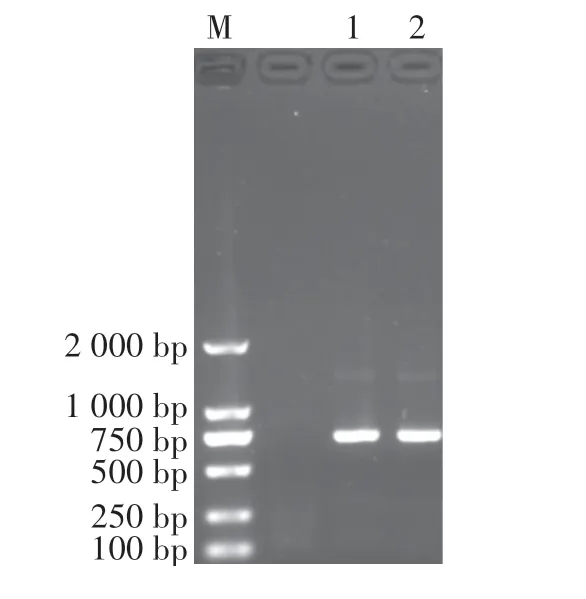
图1 RT-PCR 扩增TNFα 基因Figure 1 Amplification of TNFα by RT-PCR
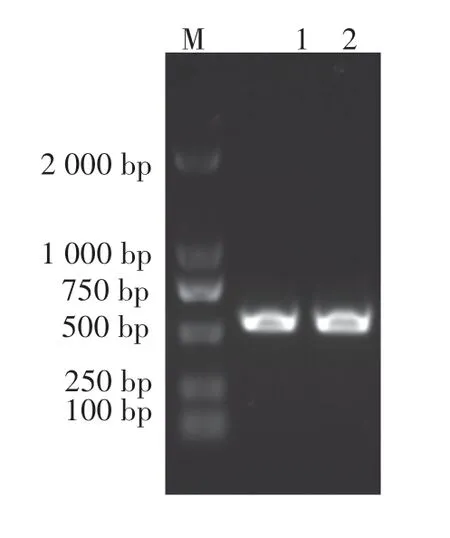
图2 SOEing PCR 扩增CSP-TNFα 融合基因Figure 2 Amplification of CSP-TNFα by SOEing PCR
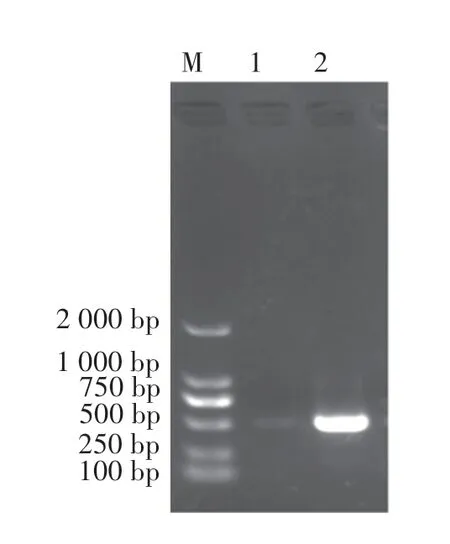
图3 PCR 鉴定CSP-TNFα/pMD20-TFigure 3 Identification of CSP-TNFα/pMD20-T by PCR
2.3 表达载体CSP-TNFα/pET21b 的鉴定
将构建的重组表达载体CSP-TNFα/pET21b 用NdeⅠ和XhoⅠ酶切,得到大小2 个片段,大片段约5 400 bp为pET21b,小片段约543 bp 为CSP-TNFα目的基因(图5)。 测序结果表明目的基因和表达载体连接方向正确,无基因突变,表明重组表达载体CSP-TNFα/pET21b 构建成功。
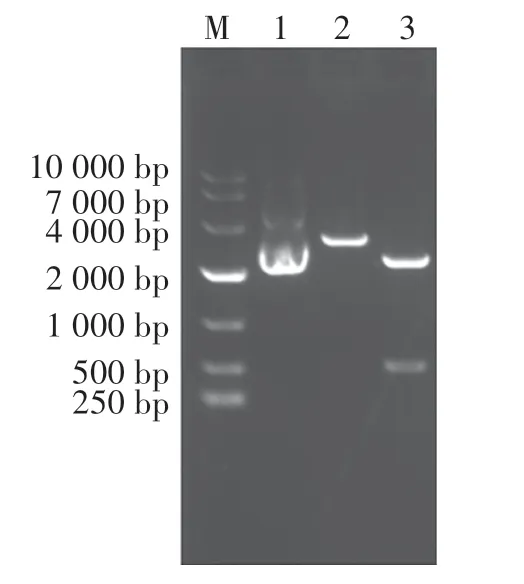
图4 酶切鉴定CSP-TNFα/pMD20-TFigure 4 Identification of CSP-TNFα/pMD20-T by enzyme digestion
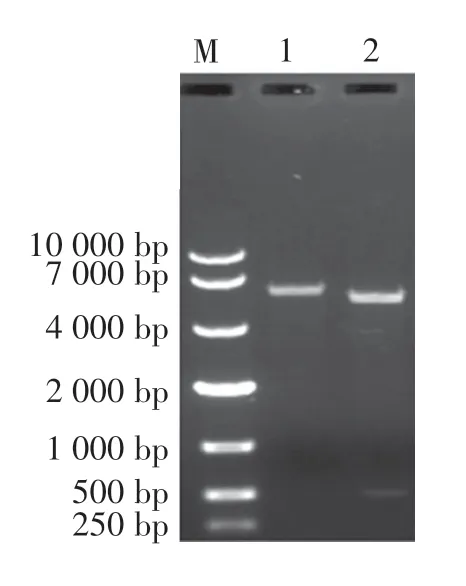
图5 表达载体CSP-TNFα/pET21b 的酶切鉴定Figure 5 Enzymatic identification of CSP-TNFα/pET21b
2.4 融合蛋白CSP-TNFα 的生物信息学分析
如图6 所示,CSP-TNFα/pET21b 中开放阅读框编码含有187 个氨基酸的融合蛋白CSP-TNFα,含有肝靶向肽CSP Ⅰ-plus-人肿瘤坏死因子TNFα-纯化标签6∗His,相对分子质量为21 003.89,在大肠杆菌体内的半衰期>10 h,脂溶性指数为73.13,不稳定指数为32.45,表明CSP-TNFα 稳定好,有利于基因工程表达;两亲指数GRAVY 为-0.494,表明此CSP-TNFα 具有疏水性,有利于分离纯化。
2.5 CSP-TNFα 的诱导表达及鉴定
SDS-PAGE 表明,CSP-TNFα/pET21b/BL21 重组菌株37 ℃诱导表达4 h、20 ℃诱导表达20 h 均获得大小约21 000 蛋白条带,初步推断目的蛋白表达成功,其中37 ℃裂解上清中目的蛋白含量少,20 ℃裂解上清中目的蛋白含量较高;Western-blot 鉴定结果:在相对分子质量约21 000 处有特异性蛋白条带,表明融合蛋白CSP-TNFα 在大肠杆菌表达系统中可溶性表达成功(图7)。 后续选择20 ℃诱导20 h进行目的蛋白可溶性表达。

图6 融合蛋白CSP-TNFα 的氨基酸序列Figure 6 Amino acid sequence of CSP-TNFα
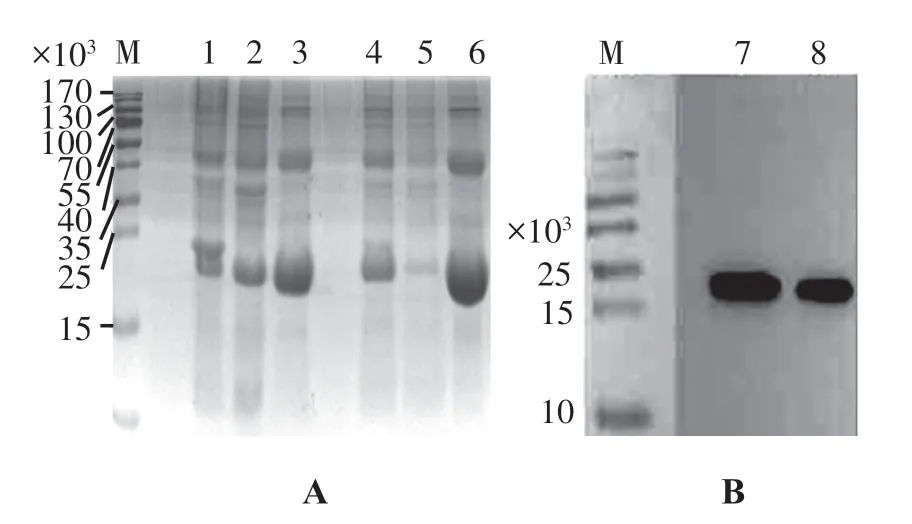
图7 CSP-TNFα/pET21b-T/BL21 诱导表达后SDS-PAGE 分析和Western-blot 鉴定Figure 7 Identification of CSP-TNFα/pET21b-T/BL21 by SDSPAGE and Western-blot
2.6 可溶性CSP-TNFα 的表达纯化
CSP-TNFα 可溶性表达产物进行Ni 柱纯化,用咪唑洗脱后进行SDS-PAGE,图8 为融合蛋白纯化洗脱峰,图9 为纯化洗脱峰收集液SDS-PAGE,可见在洗脱峰一和洗脱峰二都含有相对分子质量约21 000 特异性蛋白,为目的洗脱峰,并且条带灰度扫描得出蛋白纯度约为97%,说明Ni 柱纯化后获得较纯的CSP-TNFα 融合蛋白,下一步可进行生物学活性测定。
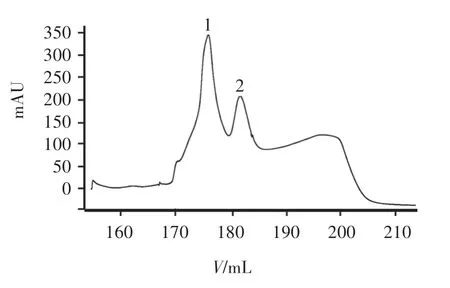
图8 CSP- TNFα 的纯化洗脱峰图Figure 8 Elution peaks of CSP-TNFα

图9 CSP-TNFα 纯化洗脱液SDS-PAGE 分析Figure 9 SDS-PAGE analysis of CSP-TNFα purified eluent
3 讨论
疟原虫环子孢子蛋白CSP 分布于整个疟原虫子孢子表面[12],研究表明CSPⅠ-plus N 端保守Ⅰ区是疟原虫子孢子吸附与入侵肝细胞的关键,可与肝细胞表面的HSPG 发生特异性结合[13],不仅干扰其受体功能,抑制血管形成与细胞增殖[14],还具有高效而特异的肝细胞靶向性,可作为药物载体靶向肝脏[15]。 本实验室通过基因工程技术已成功构建肝靶向肽修饰的人干扰素和重组人内皮抑制素,研究结果显示其在体内和体外都能较好地靶向肝细胞,并对其生物活性和靶向机制进行了初步研究。 人肿瘤坏死因子是迄今为止人们发现抗肿瘤活性最强的细胞因子[9],但其较强的毒副作用以及难以在肿瘤细胞局部形成高浓度TNFα 发挥抗癌作用,限制了在临床上的应用。 据文献报道靶向性多肽作为导向分子构建融合蛋白,可以克服以上缺点[10-11]。 本文通过TNFα 与肝细胞靶向肽CSPⅠ-plus 相结合,获得肝靶向肽-人肿瘤坏死因子融合蛋白CSP-TNFα,以期提高TNFα 靶向性、达到肝细胞聚集高浓度TNFα 的效果、降低用量和毒副作用,为后期检测其生物学活性奠定基础。
本研究以反转录PCR 克隆TNFα cDNA 为基础,利用重叠延伸PCR(SOEing PCR)技术成功构建融合基因CSP-TNFα,该方法操作简单,因无需设计内切酶位点而引入不必要的氨基酸残基,使融合蛋白更接近天然多肽。 生物信息学分析得出,融合蛋白CSP-TNFα 含187 个氨基酸,相对分子质量约为21 000,能够在大肠杆菌系统中稳定表达,且具有良好的疏水性便于分离制备;另外,CSP-TNFα 融合蛋白具有TNFα 和CSP 100%同源保守功能域和6×His纯化结构域。 大肠杆菌表达系统因培养周期短、目标基因表达水平高、遗传背景清楚,是目前应用最为广泛的蛋白表达体系[16-17],但表达的目的蛋白易形成无活性的包涵体。 据文献报道,降低诱导温度可降低包涵体形成[18]。 6×His 标签相对分子质量小、低免疫原性、亲水性,是被公认使用的融合蛋白标签,用于一系列目的蛋白纯化。 为保证6×His 标签融合蛋白CSP-TNFα 表达产物的正确结构和生物活性,行使蛋白功能,本文将原核表达载体CSPTNFα/pET21b 转入感受态大肠杆菌进行低温诱导表达,尽量避免进行包涵体表达,提高可溶性表达。经实验发现:在诱导温度为37 ℃时,融合蛋白CSPTNFα 几乎全部形成包涵体;在诱导温度为20 ℃时,大部分融合蛋白CSP-TNFα 以可溶性形式表达,获得较多可溶性融合蛋白CSP-TNFα,这可能与低温状态下蛋白表达速度缓慢并促进其正确折叠有关[18],因此后续实验选择诱导条件为20 ℃,20 h 进行低温可溶性表达并进行蛋白Ni 柱纯化。
本实验成功构建CSP-TNFα/pET21b-T/BL21 原核表达系统并进行可溶性表达及鉴定和纯化,成功制备一种可能对肝癌细胞具有靶向性的CSP-TNFα 融合蛋白,为下一步研究其生物学活性奠定了基础。

