油橄榄叶多酚的酶法提取及稳定性研究
清源 ,赵燕 ,张万明*
(1.西昌学院 农业科学学院,四川 西昌 615013;2.德昌鸿源农林科技发展有限公司,四川 德昌 615500)
油橄榄(Oleaeuropaea)又名齐墩果,是世界著名的木本油料树种,现已广泛种植于我国四川、甘肃等地[1]。叶片是油橄榄产业发展过程中的主要副产物,一般被废弃,但因其富含多酚类物质,可被功能食品、现代医药和保健行业所利用[2-4]。现有研究如芒果皮多酚用于食品保鲜,香蕉皮多酚用于食品辅色、调味、酒水的澄清,迷迭香多酚抑制食源性致病菌李斯特菌,甘蔗皮原花青素的提取及抗氧化活性研究等,均展示出植物多酚的重要应用价值[5-8]。因此,开展以橄榄叶为原料提取多酚的研究并应用于食品、化妆品等行业,不仅能有效减少橄榄叶的环境污染问题,还能延长油橄榄产业发展的链条,更好地创造经济效益。
目前,多酚提取工艺主要有溶剂提取法、微波和超声波辅助法等,而利用生物酶提取多酚的方法具有成本低、使用方便、反应条件温和、绿色环保等优点,非常适合于工业化生产[9]。目前关于橄榄叶多酚的酶法提取研究还较少,值得探讨。此外,目前关于油橄榄叶中多酚类物质稳定性的研究报道也较少,而多酚稳定性是人们在加工利用过程中必须考虑的问题,因此本文还探讨了食品添加剂对油橄榄叶多酚的加工稳定性。
1 材料与方法
1.1 材料与试剂
油橄榄叶(品种为“配多灵”), 2018年3月采自德昌鸿源农林科技发展有限公司橄榄基地,粉碎后过80目筛备用;ULUP-IV-10T型优普系列超纯水。
果胶酶(40 U/mg)、纤维素酶(3 U/mg)、中性蛋白酶(60 U/mg)、木瓜蛋白酶(100 U/mg):北京索莱宝科技有限公司;没食子酸、碳酸钠、福林-酚试剂等:均为分析纯;葡萄糖、蔗糖、阿斯巴甜、木糖醇、苯甲酸钠、山梨酸钾、亚硫酸钠和过氧化氢:均为食品级。
1.2 仪器与设备
PHS-3C 型pH计 上海精密仪器仪表有限公司;ME204 型分析天平 瑞士梅特勒-托利多仪器(中国)有限公司;TU-1810 型紫外可见分光光度计 北京普析通用仪器有限责任公司;HW.SY21-K4C 型水浴恒温振荡器 北京市长凤仪器仪表公司;纯水机。
1.3 方法
1.3.1 多酚提取工艺
油橄榄叶粉→加蒸馏水→调pH→酶解→沸水灭酶→冷却→真空抽滤→滤液→沉淀物二次提取→合并两次滤液→定容→粗多酚提取液→多酚得率测定。
1.3.2 酶复配比例的筛选
精密称取4份油橄榄叶粉2.0 g,置于100 mL三角瓶中,分别加入4.0%(按橄榄叶粉质量)的纤维素酶、果胶酶、中性蛋白酶的复配酶,在酶解温度为45 ℃、料液比1∶40(g/mL)、pH 6.0条件下,酶解30 min,以粗多酚得率为指标,以不加酶的样品作为对照,优选最佳的酶配比进行后续试验。
1.3.3 单因素试验设计
1.3.3.1 酶解时间对多酚得率的影响
设定复配酶用量为4.0%,酶解温度45 ℃,酶解 pH 值 6.0,料液比 1∶40(g/mL),探讨酶解时间分别为30,40,50,60,70 min时对油橄榄叶粗多酚得率的影响。
1.3.3.2 酶解温度对多酚得率的影响
设定复配酶用量为4.0%,酶解时间40 min,酶解 pH 值 6.0,料液比 1∶40(g/mL),探讨酶解温度分别为 40,45,50,55,60 ℃时对油橄榄叶粗多酚得率的影响。
1.3.3.3 酶解pH值对多酚得率的影响
设定复配酶用量为4.0%,酶解时间40 min,酶解温度 50 ℃,料液比 1∶40(g/mL),探讨酶解 pH 值分别为 3.0,4.0,5.0,6.0,7.0时对油橄榄叶粗多酚得率的影响。
1.3.3.4 酶用量对多酚得率的影响
设定酶解时间为40 min,酶解温度50 ℃,酶解 pH 值 6.0,料液比 1∶40(g/mL),探讨复配酶用量分别为 1.0%、3.0%、5.0%、7.0%、9.0%时对油橄榄叶粗多酚得率的影响。
1.3.3.5 料液比对多酚得率的影响
设定复配酶用量为5.0%,酶解时间40min,酶解温度 50 ℃,酶解 pH值6.0,探讨料液比1∶40、1∶50、1∶60、1∶70、1∶80(g/mL)时对油橄榄叶粗多酚得率的影响。
1.3.4 均匀试验设计
根据单因素试验结果,按照 U10(108)进行均匀设计试验,得出油橄榄叶粗多酚的最佳酶解工艺。
1.3.5 油橄榄叶粗多酚得率的计算
采用福林酚法测定总酚。
1.3.5.1 没食子酸标准曲线的绘制
以标准没食子酸溶液浓度(mg/mL)为横坐标X,吸光值Y为纵坐标,绘制标准曲线,得到回归方程为Y=11.418X+0.0233,R2=0.9966。
1.3.5.2 粗多酚得率的计算
式中:B为油橄榄叶粗多酚得率,%;Y为多酚提取液浓度,mg/mL;V为多酚提取液体积,mL;n为稀释倍数;M为橄榄叶质量,g。
1.3.6 食品添加剂对油橄榄叶粗多酚加工稳定性的影响
1.3.6.1 甜味剂
在最佳提取条件下,用油橄榄叶粗多酚提取液将葡萄糖、蔗糖、木糖醇和阿斯巴甜配成浓度为0,2.5,5,10,20,50 mg/mL的溶液,摇匀,静置后测定粗多酚含量。
1.3.6.2 防腐剂
在最佳提取条件下,用油橄榄叶粗多酚提取液将山梨酸钾和苯甲酸钠配成浓度为0,0.5,1,5,10,15 mg/mL的溶液,摇匀,静置后测定粗多酚含量。
1.3.6.3 还原剂
在最佳提取条件下,用油橄榄叶粗多酚提取液将Na2SO3配成浓度为0,5,10,15,20 mg/mL的溶液,摇匀,静置后测定粗多酚含量。
1.3.6.4 氧化剂
在最佳提取条件下,用油橄榄叶粗多酚提取液将H2O2配成浓度为0,7.5,15,22.5 mg/mL的溶液,摇匀,静置后测定粗多酚含量。
1.3.7 试验结果统计与分析
运用Excel和DPS软件对试验结果进行分析处理。
2 结果与分析
2.1 酶的复配比例筛选结果

图1 酶复配比例的筛选结果Fig.1 Screening results for compoundingproportions of enzymes
由图1可知,与无酶处理(对照)相比,4种酶配比均有不同程度提高橄榄叶多酚得率的作用。其中,纤维素酶∶果胶酶∶中性蛋白酶为1∶1∶2时多酚得率为1.58%且效果较其他3种更优,故选择该复配比例作为油橄榄叶粗多酚的后续提取。
2.2 单因素试验结果
2.2.1 酶解时间对粗多酚得率的影响

图2 酶解时间对多酚得率的影响Fig.2 Effect of enzymolysis time on the yield of polyphenols
由图2可知,30~40 min内油橄榄叶多酚的得率随着时间的延长迅速增大,可能是因为开始时底物浓度相对较高,酶解破坏细胞结构,有利于传质过程的发生[10]。40 min时得率达最大值,随时间延长,提取得率反而略有下降,长的处理时间易引起多酚物质的氧化分解,使提取量降低。
2.2.2 酶解温度对粗多酚得率的影响
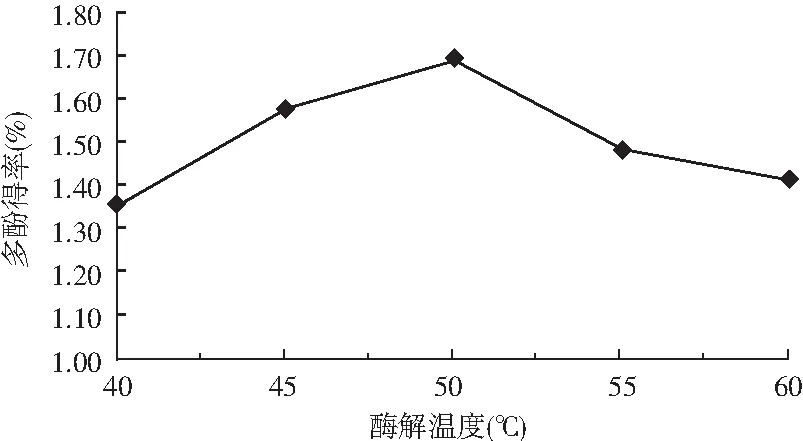
图3 酶解温度对多酚得率的影响Fig.3 Effect of enzymolysis temperature on theyield of polyphenols
由图3可知,40~50 ℃ 时,油橄榄叶多酚得率随着温度的升高而增加,在 50 ℃处达到最大。之后即使升高温度,提取效率也不再增加,反而下降。当温度较低时,无法达到反应所需的活化能,因而反应速度较慢,多酚得率也较低;但是,当温度较高时,酶活性逐渐丧失,反应速率减慢,多酚得率也降低[11]。
2.2.3 酶解pH值对粗多酚得率的影响

图4 酶解pH值对多酚得率的影响Fig.4 Effect of enzymolysis pH on the yield of polyphenols
由图4可知,油橄榄叶多酚得率随 pH 的增大而增加,当 pH 值为 6.0 时多酚得率达到最高,之后开始降低。当pH 较低时,中性蛋白酶的活性受到抑制;当 pH>6.0 时,纤维素酶、果胶酶的活性受到抑制[12]。而且多酚类物质在碱性条件下不稳定,也是导致多酚含量下降的原因之一。因此,最适 pH 值为 6.0,中性蛋白酶、纤维素酶、果胶酶的活性均达到最大。
2.2.4 酶用量对粗多酚得率的影响

图5 酶用量对多酚得率的影响Fig.5 Effect of enzyme dosage on the yield of polyphenols
由图5 可知,油橄榄叶多酚的得率随酶用量的增加而增加,纤维素酶和果胶酶协同作用能有效破坏植物细胞壁与细胞间质,使胞内的物质快速溶出;中性蛋白酶能较好地破坏蛋白质等大分子物质,促进多酚更好地溶出[13]。当酶用量为5.0%时,油橄榄叶多酚得率达到最大。
2.2.5 料液比对粗多酚得率的影响

图6 料液比对多酚得率的影响Fig.6 Effect of solid-liquid ratio on the yield of polyphenols
由图6可知,油橄榄叶多酚的得率随料液比的增加呈上升的趋势,在 1∶60(g/mL)处达到最大值。当料液比较小时,不利于传质,短时间内多酚的浸出受到抑制,所以得率较低;而料液比较大时,水分的增加又使酶的浓度降低,酶与底物的接触几率下降,多酚得率也会降低[14]。
2.3 均匀试验结果
2.3.1 均匀设计
根据单因素试验结果,选择酶解时间、酶解温度、pH 值、酶用量和料液比 5个因素的较优水平,按照 U10(108)设计进行均匀试验,因素与水平表见表1。

表1 均匀试验设计因素与水平表Table 1 Factors and levels of uniform experimental design
2.3.2 均匀试验结果与分析
按照优化之后的方法,每次提取油橄榄叶粉2.0 g,根据选定的均匀设计表,得出试验结果,见表2。

表2 均匀试验结果Table 2 The results of uniform experiment
运用DPS软件进行二次多项式回归分析,得到回归方程为:Y=3.6685-0.9478X4+0.0102X5+0.0004X22+0.0873X42-0.0014X2X3-0.0019X2X4-0.0020X3X5+0.0016X4X5。对建立的模型进行检验可知,P=0.0057<0.01,说明结果极显著。负相关系数 R=0.99997,说明该模型与实际试验拟合度高,能很好地拟合复合酶法提取橄榄叶多酚的工艺条件,方程有意义。
对相关系数进行检验,结果见表 3。其中,X22的交互项系数达到极显著水平(P<0.01),X4、X5的回归系数和X42、X2X3、X2X4、X3X5、X4X5的交互项系数均达到了显著水平(P<0.05),具有显著的统计学意义。表明油橄榄叶多酚得率与各因素间并非简单的线性关系,而是存在交互作用。由P值的大小可知,对油橄榄叶多酚得率影响的大小顺序为:X22>X42>X4>X3X5>X2X3>X4X5>X5>X2X4。
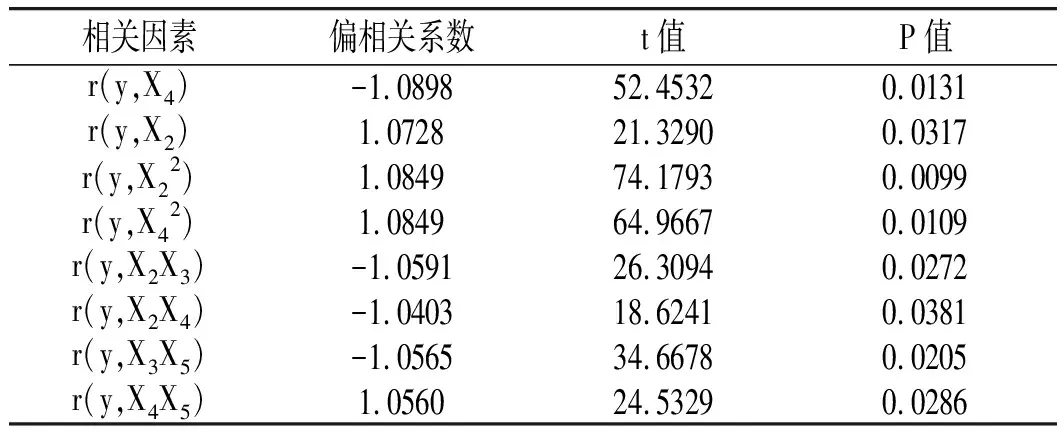
表3 相关系数及检验结果 Table 3 Correlation coefficients and test results
分析得到复合酶法提取油橄榄叶粗多酚的理论得率是2.67%,最优提取条件为:酶解时间39.96 min,酶解温度 71.96 ℃,pH 值4.23,酶用量7.06%,料液比 1∶52.21(g/mL)。
2.3.3 最佳工艺的确定及验证
为操作方便,设置最佳提取工艺条件为:酶解时间40 min,酶解温度 72 ℃,pH 值4.2,酶用量7.1%,料液比 1∶52(g/mL)。经验证,优化条件下提取的油橄榄叶粗多酚得率为2.54%,比均匀试验中的 10 组试验结果都高,说明优化结果具有指导意义。但是与回归模型的预测值 2.67%有一定的误差,相对误差为 4.87%。该提取方法条件温和,提取效率高。
2.4 食品添加剂对橄榄叶粗多酚加工稳定性的影响
2.4.1 甜味剂

图7 甜味剂浓度对油橄榄叶多酚稳定性的影响Fig.7 Effect of sweetener concentration on the stability of polyphenols from olive leaves
由图7可知,不同浓度的甜味剂对油橄榄叶多酚物质的稳定性影响不同,在葡萄糖、蔗糖、阿斯巴甜和木糖醇溶液中的多酚稳定性依次降低。当甜味剂溶液浓度在2.5~5.0 mg/mL时,多酚稳定性在葡萄糖和蔗糖中的变化不大,但是随着浓度的增加,多酚稳定性在各种甜味剂中均降低。
2.4.2 防腐剂

图8 防腐剂浓度对油橄榄叶多酚稳定性的影响Fig.8 Effect of preservative concentration on the stability of polyphenols from olive leaves
由图8可知,在苯甲酸钠和山梨酸钾浓度均低于0.5 mg/mL时,多酚相对比较稳定。当两种防腐剂浓度高于1.0 mg/mL时,多酚稳定性均变差。但是,苯甲酸钠对油橄榄叶多酚稳定性的整体表现不如山梨酸钾。
2.4.3 还原剂

图9 还原剂浓度对油橄榄叶多酚稳定性的影响Fig.9 Effect of reductant concentration on the stability of polyphenols from olive leaves
由图9可知,随着还原剂浓度的增加,多酚稳定性逐渐降低。当还原剂浓度大于10 mg/mL时,对多酚稳定性有较大影响。
2.4.4 氧化剂

图10 氧化剂浓度对油橄榄叶多酚稳定性的影响Fig.10 Effect of oxidant concentration on the stability of polyphenols from olive leaves
由图10可知,随着氧化剂浓度的增加,多酚稳定性逐渐降低。当氧化剂浓度大于15 mg/mL时,对油橄榄叶多酚稳定性有较大破坏作用。
3 结论
以橄榄叶粗多酚得率为指标,对复合酶的最佳配比进行优化。确定当使用纤维素酶∶果胶酶∶中性蛋白酶为1∶1∶2时,提取效果最佳,多酚得率为1.58%;在采用单因素和均匀试验设计方法的基础上,对酶法提取的工艺进行优化,并确定橄榄叶粗多酚的最佳提取方案为酶解时间40 min,酶解温度 72 ℃,pH 值4.2,酶用量7.1%,料液比 1∶52(g/mL)。通过测定食品添加剂对橄榄叶粗多酚稳定性的影响,结果显示:在葡萄糖、蔗糖、阿斯巴甜和木糖醇溶液中的稳定性依次降低,高添加量的糖类对橄榄叶多酚稳定性均有较大影响;低浓度山梨酸钾中多酚稳定性较好,山梨酸钾对多酚稳定性整体优于苯甲酸钠;随着氧化剂和还原剂浓度的增加,多酚稳定性逐渐降低。其中,高浓度氧化剂和还原剂对多酚稳定性破坏均有较大影响。
近年来,植物多酚因具有抗菌、抗病毒、抗氧化、提高机体免疫力等药用价值和保健功效,被广泛用于食品、日用品、化妆品和药品行业,而开发简单化、工业化的多酚提取技术成为未来急需研究的方向[15]。此外,多酚在产品中要更好地发挥作用,其稳定性不容忽视。因此,本文研究结果可为橄榄叶多酚的工业化和规模化提取,及其在食品、日用化妆品中的加工利用方案提供理论依据。

