金丝小枣多酚的提取及抗氧化性和抑菌活性研究
张兆英,王君,宋立立,张亚楠,李欣
(沧州师范学院 生命科学学院,河北 沧州 061001)
植物多酚是一类广泛存在于植物体内的具有多元酚结构的次生代谢物,主要存在于植物的皮、根、叶、果中[1],具有较强的抗氧化、抗癌、抗菌、抗动脉硬化、降血糖等功效[2,3]。植物多酚的抑菌效果已成为研究热点之一,植物多酚可作为天然的防腐剂添加到食品中,起到保鲜的效果。动物性食品中的蛋白质和脂肪可作为微生物的能量来源,动物性食品更易滋生有害致病菌。研究发现,将植物多酚作为天然防腐剂添加到鱼肉、猪肉、牛肉羊肉及其制品中,能有效抑制细菌及真菌的生长,延缓食品品质下降的速度,同时能保持食品的原有风味[4,5]。植物多酚可作为纯天然的调味品添加到酱卤肉制品中,保持肉制品的色泽稳定、鲜亮[6]。植物多酚还能作为调味品应用于果汁、酱油、果酱等食品中,保持食品的颜色[7]。
枣(ZiziphusjujubaMill.)属于鼠李科(Rhamnaceae)枣属(Ziziphus)植物,与桃、李、栗、杏并称为我国古代“五果”,是我国北方重要的果树之一,其果实既可鲜食也可干食[8]。金丝小枣主要以干食为主,皮薄、肉厚、枣核小,是传统的“药食同源”食品。枣肉中营养丰富,含有大量糖类、蛋白质、氨基酸等营养成分,同时,还含有丰富的多糖、多酚、黄酮、皂苷等生物活性物质,具有抗氧化、抗炎、抗癌等功能,是理想的营养保健品[9]。
目前,针对葡萄多酚、芒果多酚、茶多酚等研究较多[10-12],关于金丝小枣多酚抑菌性的研究未见有报道。植物多酚的提取方法较多,超声波辅助提取法是经常被用到的方法之一,借助超声波产生的“空化效应”,可以加速多酚的渗透速度[13]。本试验采用超声波辅助提取法提取金丝小枣中的多酚,并对其抗氧化性和抑菌活性进行分析。
1 材料与方法
1.1 试验材料
1.1.1 试验样品
沧州金丝小枣。
1.1.2 试验试剂
福林-酚试剂、没食子酸:南京都莱试剂公司,分析纯;Tris、邻苯三酚、水杨酸、FeSO4:天津市光复精细化工研究所,分析纯;H2O2、Na2HPO4、NaH2PO4:北京化工厂,分析纯;对氨基苯磺酸、盐酸萘乙二胺溶液、NaNO2、营养琼脂培养基:天津市盛奥化学试剂有限公司,分析纯;浓盐酸、无水乙醇:天津市北辰方正试剂厂,分析纯;枯草芽孢杆菌、大肠杆菌、曲霉、根霉:沧州师范学院微生物实验室提供。
1.1.3 试验仪器
GZX-9070MBE数显电热鼓风干燥箱、DZKW-4电子恒温水浴锅、九阳料理机、AXTD4-低速离心机、723可见分光光度计、752紫外可见分光光度计、FS-250N超声波清洗器、T-A1004N电子天平。
1.2 样品预处理
将金丝小枣清洗干净,烘干表面水分,切成枣片,于鼓风干燥箱中,在温度60 ℃下,烘干3~4 d后,每隔0.5 h称重,至恒重即可。将烘干的枣片用粉碎机进行粉碎,粉碎后过40目筛,获得枣粉,密封干燥,保存备用。
1.3 试验设计方案
1.3.1 单因素试验
影响金丝小枣多酚提取的因素较多,针对超声波辅助提取法,主要影响因素包括:提取剂浓度、超声时间、料液比、超声功率、超声温度,因此选择这5个影响因素进行单因素试验,每个影响因素设置6个水平,见表1。
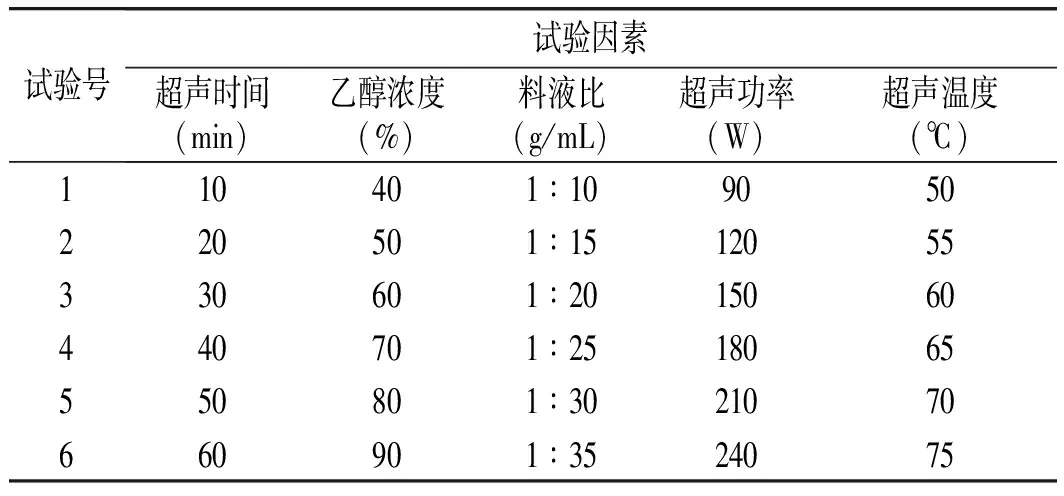
表1 单因素试验表Table 1 Single-factor experiment table
1.3.1.1 超声时间
准确称取0.5 g枣粉,加入60%的乙醇,料液比为1∶20,超声功率为150 W,超声温度60 ℃下提取10,20,30,40,50,60 min,离心,获得金丝小枣多酚提取液,重复3次,取平均值,分析超声时间与多酚提取量的关系。
1.3.1.2 乙醇浓度
准确称取0.5 g枣粉,加入40%、50%、60%、70%、80%、90%的乙醇,料液比为1∶20,超声功率为150 W,超声温度60 ℃下提取40 min,离心,获得金丝小枣多酚提取液,重复3次,取平均值,分析乙醇浓度与多酚提取量的关系。
1.3.1.3 料液比
准确称取0.5 g枣粉,加入60%的乙醇,料液比为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35,超声功率为150 W,超声温度60 ℃下提取40 min,离心,获得金丝小枣多酚提取液,重复3次,取平均值,分析料液比与多酚提取量的关系。
1.3.1.4 超声功率
准确称取0.5 g枣粉,加入60%的乙醇,料液比为1∶20,超声功率为90,120,150,180,210,240 W,超声温度60 ℃下提取40 min,离心,获得金丝小枣多酚提取液,重复3次,取平均值,分析超声功率与多酚提取量的关系。
1.3.1.5 超声温度
准确称取0.5 g枣粉,加入60%的乙醇,料液比为1∶20,温度为50,55,60,65,70,75 ℃下提取40 min,离心,获得金丝小枣多酚提取液,重复3次,取平均值,分析超声温度与多酚提取量的关系。
1.3.2 正交试验
选取超声时间、乙醇浓度、料液比、超声功率和超声温度这5个因素,每个因素设定4个水平(见表2)进行L16(45)的正交试验。按照L16(45)正交试验表(见表3)进行编号。

表2 正交试验因素水平表Table 2 Factors and levels of orthogonal experiment
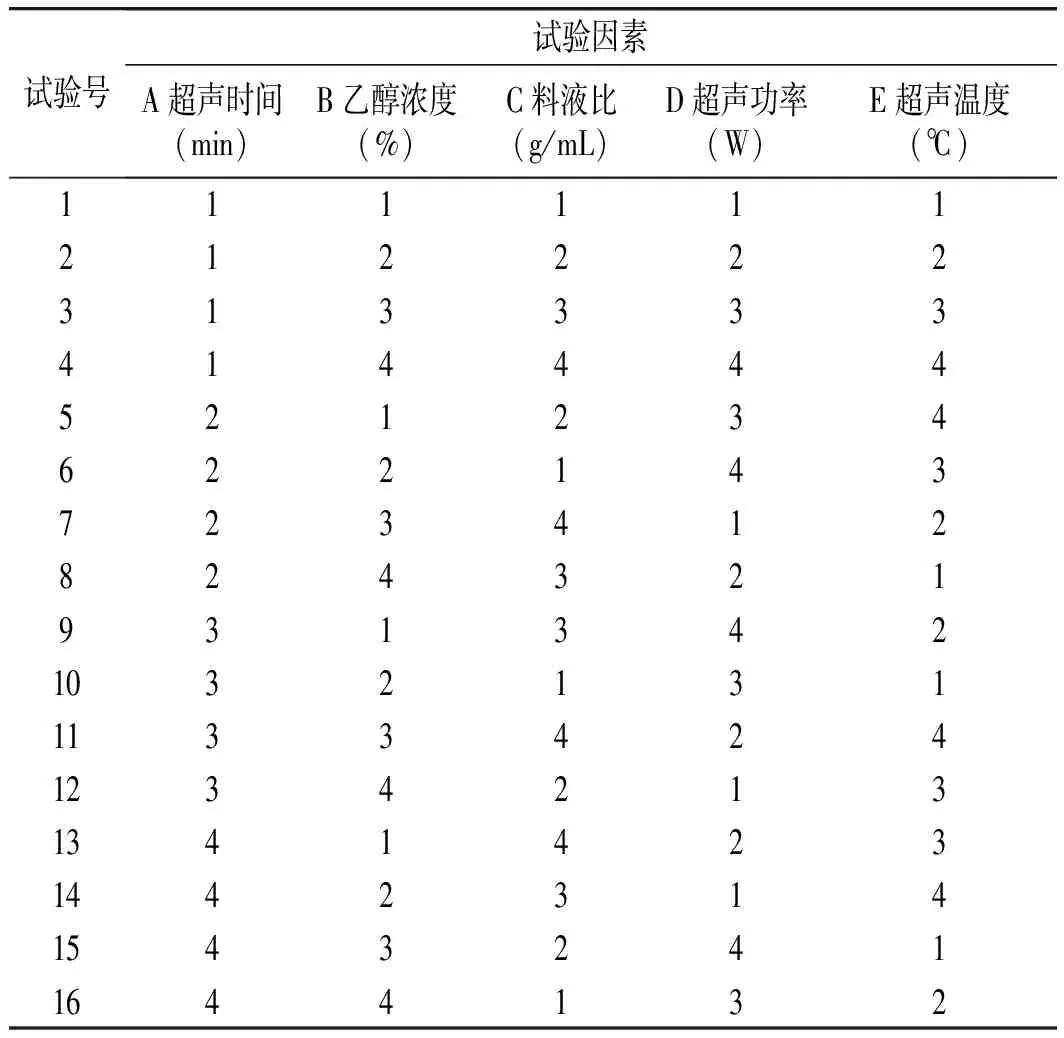
表3 正交试验设计表Table 3 The orthogonal experiment design
1.4 指标测定
1.4.1 标准曲线测定
以没食子酸为对照品,采用福林-酚法测定多酚含量[14],稍作修改。精密称取25 mg没食子酸,用蒸馏水定容至250 mL,即可得到0.1 mg/mL没食子酸标准液。分别吸取0,0.2,0.4,0.6,0.8,1.0,1.2 mL于7支试管中,加入1.5 mL福林酚试剂,混匀,静置5 min,加入3 mL 10% Na2CO3,摇匀后加蒸馏水定容至10 mL,40 ℃避光反应1 h,在760 nm波长处测定吸光度值。
1.4.2 金丝小枣多酚提取量测定
取4 mL的提取液,放置于25 mL容量瓶中,加入12 mL蒸馏水、1 mL福林-酚试剂,混匀,静置5 min,加入5 mL 10%Na2CO3溶液,混匀后,用蒸馏水定容。40 ℃避光反应1 h,在760 nm波长处测定吸光度值。
W=(C×V)/m。
式中:W为多酚提取量(mg/g);C为提取液多酚浓度(mg/mL);V为提取液体积(mL);m为枣的质量(g)。
1.4.3 清除亚硝酸根
取6支试管分别加入浓度为0.05,0.10,0.15,0.20,0.25,0.30 mg/mL的多酚溶液2 mL,5 μg/mL的NaNO2标准溶液1 mL,然后放到37 ℃恒温水浴锅中。30 min后取出,加入0.4%的对氨基苯磺酸2 mL,混匀,放置5 min,再加入0.2%的盐酸萘乙二胺1 mL,加蒸馏水至20 mL,混匀,静置15 min,于538 nm测其吸光度值,重复3次,取平均值。
清除率(%)=1-(A1-A2)。
式中:A1为加入提取液后的吸光度值,A2为金丝小枣多酚样品的吸光度值。
1.4.4 清除羟自由基
采用水杨酸法。取5 mmol/L的水杨酸-乙醇溶液2 mL、10 mmol/L的FeSO4溶液1 mL,混匀,分别加入浓度为0.05,0.10,0.15,0.20,0.25,0.30 mg/mL的金丝小枣多酚提取液2 mL,最后加入2 mL的H2O2,37 ℃下水浴反应30 min,于510 nm处测其吸光度值,重复3次,取平均值。
清除率(%)=1-(A1-A2)。
式中:A1为加入提取液后的吸光度值,A2为金丝小枣多酚样品的吸光度值。
1.4.5 清除超氧自由基
采用邻苯三酚法。取5支试管,分别量取10 mL的Tris-HCl(50 mmol/L,pH 8.2)缓冲溶液,在37 ℃恒温下水浴反应20 min;之后加入3 mL蒸馏水和4 mL浓度分别为0.05,0.10,0.15,0.20,0.25,0.30 mg/mL的多酚提取液,摇匀,立即加入已预热的邻苯三酚1 mL,用0.01 mol/L HCl为参比,于325 nm测吸光度值,重复3次,取平均值。
清除率(%)=(A0-A1)/A0。
式中:A0为空白对照(不加提取液)的吸光度值,A1为加入提取液后的吸光度值。
1.5 抑菌试验
1.5.1 菌种的活化
将枯草芽孢杆菌、大肠杆菌分别接种到牛肉膏蛋白胨培养基中于37 ℃培养12 h;将曲霉、根霉分别接种到土豆蔗糖培养基中于28 ℃培养2~3 d[15]。
1.5.2 抑菌效果测定
用打孔器将滤纸打成直径为10 mm 的圆片,将其灭菌,备用。将活化后的不同菌种分别接种到培养基中,设3次重复。将金丝小枣多酚原液用无菌水稀释为0.10,0.15,0.20,0.25,0.30,0.35,0.40 mg/mL不同浓度的稀释样品,将灭菌的滤纸片浸入金丝小枣多酚稀释液中30 min,然后用无菌镊子取出,平铺于已接种的培养基中,每个培养皿放置3个滤纸片,以无菌水作空白对照。枯草芽孢杆菌和大肠杆菌在37 ℃恒温培养箱内培养 24 h,曲霉和根霉在28 ℃培养箱内培养48 h,观察抑菌效果[16,17]。
2 结果与分析
2.1 多酚的标准曲线及回归方程
以没食子酸溶液浓度为横坐标(X),吸光度为纵坐标(Y),绘制标准曲线(见图1),得到线性回归方程为:Y=5.42X+0.0186,R2=0.9992。
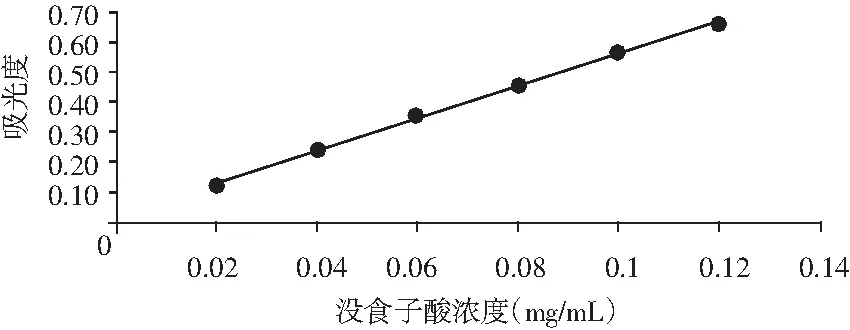
图1 多酚标准曲线Fig.1 The standard curve of polyphenols
2.2 金丝小枣多酚的提取
2.2.1 单因素试验
2.2.1.1 超声时间对金丝小枣多酚提取的影响
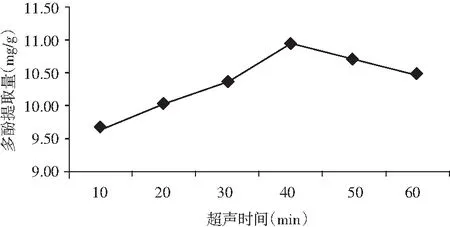
图2 超声时间对金丝小枣中多酚提取的影响Fig.2 The effect of ultrasonic time on polyphenols extraction from Ziziphus jujuba
由图2可知,在超声时间为10~40 min时,随着时间的延长,金丝小枣多酚提取量呈现上升的趋势;在超声时间为40~60 min时,多酚提取量下降。超声时间为40 min时,多酚提取量最高,为10.95 mg/g。因而,选取40 min作为金丝小枣多酚提取的最佳超声时间。
2.2.1.2 乙醇浓度对金丝小枣多酚提取的影响
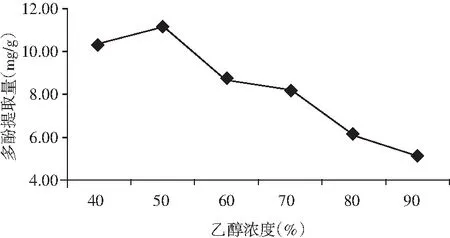
图3 乙醇浓度对金丝小枣中多酚提取的影响Fig.3 The effect of ethanol concentration on polyphenols extraction from Ziziphus jujuba
由图3可知,在乙醇浓度为40%~50%时,金丝小枣多酚提取量缓缓上升;当浓度为50%~90%时,多酚提取量急剧下降;乙醇浓度为50%时,多酚提取量达到最高,为11.15 mg/g。因此,选取50%作为金丝小枣多酚提取的最佳乙醇浓度。
2.2.1.3 料液比对金丝小枣多酚提取的影响

图4 料液比对金丝小枣中多酚提取的影响Fig.4 The effect form solid-liquid ratio on polyphenols extraction from Ziziphus jujuba
由图4可知,当料液比为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35时,金丝小枣多酚提取量分别为10.35,11.80,9.75,7.75,7.10,5.70 mg/g。即在料液比为1∶15时,金丝小枣多酚提取量最高。因此,选取1∶15作为金丝小枣多酚提取的最佳料液比。
2.2.1.4 超声功率对金丝小枣多酚提取的影响
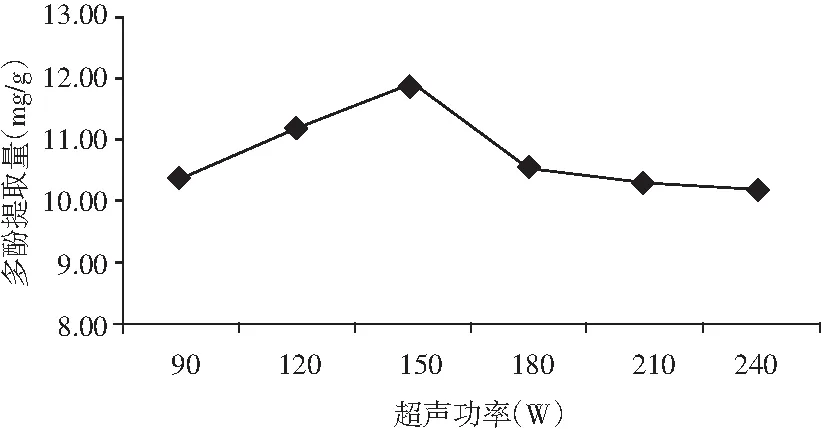
图5 超声功率对金丝小枣中多酚提取的影响Fig.5 The effect of ultrasonic power on polyphenols extraction from Ziziphus jujuba
由图5可知,当超声功率为90~150 W时,金丝小枣多酚提取量逐渐上升;当超声功率为150~240 W时,金丝小枣多酚提取量呈现平缓的下降。在超声功率为150 W时,金丝小枣多酚提取量最高,为11.85 mg/g。因而,选取150 W作为金丝小枣多酚提取的最佳超声功率。
2.2.1.5 超声温度对金丝小枣多酚提取的影响
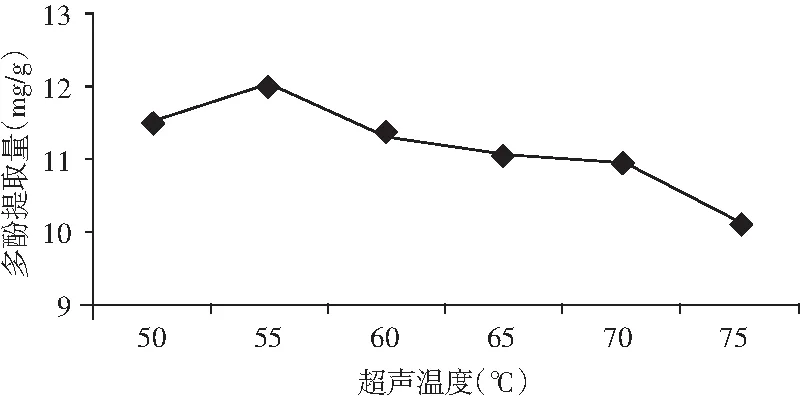
图6 超声温度对金丝小枣中多酚提取的影响Fig.6 The effect of ultrasonic temperature on polyphenolsextraction from Ziziphus jujuba
由图6可知,当超声温度为50~55 ℃时,金丝小枣多酚提取量逐渐增加;在超声温度为55~75 ℃时,多酚提取量下降。在超声温度为55 ℃时,金丝小枣多酚提取量达到12.05 mg/g。所以,选取55 ℃作为金丝小枣多酚提取的最佳超声温度。
2.2.2 正交试验

表4 正交试验结果Table 4 The results of orthogonal experiment
由表4正交试验结果可知,超声波辅助法提取金丝小枣多酚的最佳提取工艺为:超声时间30 min、乙醇浓度50%、料液比1∶15、超声功率210 W、超声温度50 ℃,此条件下,金丝小枣多酚提取量为12.45 mg/g。5个因素对多酚提取量的影响程度不同,因素主次顺序为:料液比>乙醇浓度>超声功率>超声温度>超声时间。
2.3 金丝小枣多酚的抗氧化性试验
2.3.1 清除亚硝酸根
由图7可知,随着金丝小枣多酚浓度的增加,其清除亚硝酸根的能力增强;当多酚浓度为0.20 mg/mL时,清除能力最强,对亚硝酸根的清除率最高,为99.8%;当多酚浓度为0.25 mg/mL时,其清除率略有下降。

图7 多酚浓度对清除亚硝酸根的影响Fig.7 The effect of polyphenols concentration on scavenging of nitrite
2.3.2 清除羟自由基
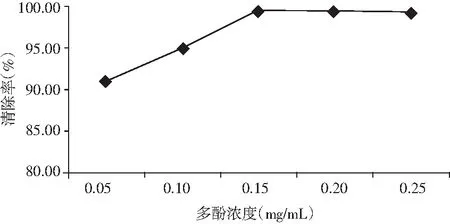
图8 多酚浓度对清除羟自由基的影响Fig.8 The effect of polyphenols concentration on scavenging of hydroxyl radicals
由图8可知,随着金丝小枣多酚浓度的增加,其清除能力逐渐增强;在多酚浓度为0.15 mg/mL时,其对羟自由基的清除率达到99.3%。当金丝小枣多酚浓度大于0.15 mg/mL时,其清除能力随多酚浓度的增加变化平缓。
2.3.3 清除超氧自由基

图9 多酚浓度对清除超氧自由基的影响Fig.9 The effect of polyphenols concentration on scavenging of superoxide free radicals
由图9可知,随着金丝小枣多酚浓度的增加,其对超氧自由基的清除能力逐渐增强。当金丝小枣多酚浓度为0.05,0.10,0.15,0.20,0.25 mg/mL时,其清除率分别为44.30%、49.70%、53.90%、53.50%、54.10%。
2.4 金丝小枣多酚抑菌活性试验
植物多酚能够破坏微生物的细胞壁和细胞膜,使膜的流动性降低,通透性增加,对微生物的细胞形态造成不可逆的改变,从而起到杀菌的作用[18-20]。

表5 不同浓度金丝小枣多酚提取液抑菌效果Table 5 Antibacterial effect of polyphenol extract with different concentration from Ziziphus jujuba
注: “-”表示无抑菌效果,菌落正常生长。
由表5可知,随着金丝小枣多酚浓度的增加,抑菌圈逐渐加大,表明金丝小枣多酚的抑菌能力与其浓度相关。金丝小枣多酚对4种菌均有抑制效果,抑制作用大小顺序为:曲霉>枯草芽孢杆菌>大肠杆菌>根霉。金丝小枣多酚对枯草芽孢杆菌、大肠杆菌、曲霉3种菌的最小抑菌浓度为0.15 mg/mL;对根霉的最小抑菌浓度为0.20 mg/mL。金丝小枣多酚对细菌和真菌都有不同程度的抑制作用。
3 结论
采用超声波辅助法提取金丝小枣多酚,通过单因素试验和正交试验,得到金丝小枣多酚的最佳提取工艺:超声时间30 min、乙醇浓度50%、料液比1∶15、超声功率210 W、超声温度50 ℃,此条件下多酚提取量为12.45 mg/g。影响金丝小枣多酚提取的因素主次顺序为:料液比>乙醇浓度>超声功率>超声温度>超声时间。抗氧化性试验显示,金丝小枣多酚对亚硝酸根、羟自由基和超氧自由基具有清除作用,并且,随着金丝小枣多酚浓度的增加,其清除能力增强。通过抑菌试验可以看出,金丝小枣多酚对枯草芽孢杆菌、大肠杆菌、曲霉、根霉4种菌都有不同程度的抑制作用,且抑制效果随金丝小枣多酚浓度的增加而更加明显。说明金丝小枣多酚对真菌和细菌都能起到抑制作用。金丝小枣多酚可作为天然的防腐剂添加到动物性食品中,延长食品的保鲜期,亦可作为调味品添加到果汁、糕点等食品中,保持食品的色泽稳定。

