沉默GOLPH3对人胃癌细胞迁移与侵袭能力的影响及机制
魏红权 赖丽琴 刘珺 韩小于 王园园 潘庆
GOLPH3基因位于人染色体5P13上,是一个高度保守的33KDa蛋白,定位于高尔基体反面网状结构[1-2],不仅能维持高尔基体扁平结构,还参与将细胞表面受体和蛋白从内体逆转运到高尔基体反面网状结构的过程,起到运输的作用[2-3],Scott等[4]研究报道高尔基磷酸化蛋白 3(golgi phosphoprotein 3,GOLPH3)在癌中可以调节mTOR信号途径及增强癌细胞对雷帕霉素的敏感性,首次提出GOLPH3是一个全新的致癌基因,并能通过mTOR信号系统促进人类癌细胞增殖。为进一步探讨GOLPH3基因对胃癌细胞迁移与侵袭能力的影响及其机制,本研究运用基因沉默的方法将GOLPH3-shRNA质粒转染人胃癌BGC-823细胞,观察GOLH3对胃癌细胞侵袭、转移能力及侵袭相关分子基质金属蛋白酶(MMP)-2和MMP-9分泌的影响,为胃癌的基因靶向治疗提供新的策略和途径。
1 材料和方法
1.1 主要试剂 Lipofectamine 2000购自美国Invitrogen公司,TotalRNA提取试剂盒购自日本Takara公司,RNA逆转录试剂盒购自日本TaKaRa公司,蛋白提取试剂盒购自上海碧云天生物,小鼠抗人GOLPH3抗体购自美国Proteinte公司,小鼠抗人MMP-2、MMP-9抗体购自美国SantaCruz公司,ECL发光试剂盒购自美国Millipore公司。GOLPH3-shRNA质粒及阴性对照由上海吉玛公司合成,见表1。
1.2 研究方法
1.2.1 细胞培养、转染与分组 人胃癌细胞BGC-823购自上海通派公司,饱和湿度,置于含有100U/ml青霉素、100g/ml链霉素、含20%小牛血清(FBS)的1640培养基中,37℃、5%CO2培养箱中培养。取对数生长期的细胞,接种到6孔板中(5×105/孔),待细胞贴壁后,按照Lipofectamine 2000试剂盒的实验步骤进行转染。转染后的细胞于37℃、5%CO2培养箱中继续培养4~6h后换液,继续培养24h,筛选,获得稳定转染干扰载体的细胞,分为对照组(转染无关序列质粒的NC-shRNA组)和3个实验组(转染3个目的基因质粒,分别为GOLPH3-shRNA1组、GOLPH3-shRNA2组、GOLPH3-shRNA3组)。
1.2.2 转染后胃癌细胞BGC-823中GOLPH3的mRNA和蛋白的检测 (1)qRT-PCR法检测GOLPH3的mRNA水平:采用MiniBEST通用RNA提取试剂盒提取总RNA,-80℃保存。使用带有gDNA擦除器的Prime-ScriptRRT reagent Kit逆转录合成 cDNA。用 SYBR Premix Ex Taq和Bio Rad CFX-96 PCR system进行qRT-PCR分析。GOLPH3基因的引物序列上游:5′-CTCCAGAAACGGTCCAGAAC-3′,下游 5′-CCACCAGGTTTTTAGCTAATCG-3′,扩增条件:95℃预变性 10min;94℃30s,56℃退火 30s,68℃ 30s,40 个循环;以 2-ΔΔCt值表达目的基因的相对表达量,每个样本重复3次。(2)Western blot法检测GOLPH3的蛋白水平:用预冷的PBS洗涤BGC-823细胞2次以上,加入100μl的RIPA细胞裂解液,4℃、12 000r/min离心15min,取上清液,进行蛋白质定量后,常规进行聚丙烯酰胺凝胶电泳,上样量为50μg,转膜、封闭后转印至膜,加入小鼠抗人GOLPH3(工作浓度 1∶1 000)和 β-actin(工作浓度1∶2 000)作为一抗,4°C 孵育过夜后,加入辣根过氧化物酶标记的抗小鼠IgG(工作浓度1∶2 000)作为二抗,ECL化学发光,分析条带的灰度值并与各自的内参β-actin的比值来判断目的蛋白的表达水平。并据此从GOLPH3-shRNA1组、GOLPH3-shRNA2组、GOLPH3-shRNA3组中选取对GOLPH3基因干扰效果最好一组稳定转染细胞株做后续实验。
1.2.3 转染后BGC-823细胞迁移能力检测 采用划痕实验法。在6孔板上用DMEM(含10%FBS)培养细胞,待细胞融合后,用移液器枪头用力划直线,PBS冲洗3次,洗去划痕产生的细胞碎片。0、24h分别采用Olympus IX50显微镜和Image-Pro Plus软件捕获和记录细胞迁移的图像,以迁移率表示细胞的迁移能力。迁移率=(划痕后即刻划痕面积—划痕后24h划痕面积)/划痕后即刻划痕面积×100%。实验重复3次,取平均值。
1.2.4 转染后BGC-823细胞的侵袭能力检测 采用侵袭实验法。接种细胞,调整细胞密度至1×106/ml,取细胞悬液200μl加入Transwell小室的上室内,下室加入600μl FBS,在37℃的CO2培养箱培养24h。取出Transwell小室,弃去6孔板孔中培养液,用无钙的PBS洗2遍,甲醇固定30min,膜下面用0.1%结晶紫染色20min。400倍显微镜下随机取5个视野计数细胞,取平均数。每组重复3次,取平均值。

表1 GOLPH3-shRNA干扰序列
1.2.5 转染后 BGC-823细胞 MMP-2、MMP-9 mRNA表达水平检测 采用qRT-PCR法。MMP-2基因的引物序列上游:5′-ATTCCGCTTCCAGGGCACAT-3′,下游5′-CACCTTCTGAGTTCCCACCAA-3′,MMP-9 基因的引物序列上游:5′-GTCCACCCTTGTGCTCTT-3′,下游5′-TGCCACCCGAGTGTAACCAT-3′。方法同 1.2.2。
1.2.6 转染后细胞培养上清液中MMP-2和MMP-9活性检测 采用明胶酶谱法。取转染后的细胞在无血清DMEM培养基中培养24h。次日收集上清液,将上清液移入离心管中2 000r/min离心10min,-80℃保存。样品与上样缓冲液按照3∶1混合后,在含有0.1%明胶的10%SDS-PAGE凝胶中行电泳分离,电泳结束后,将凝胶置于洗脱液中振荡洗脱4次,每次15min,然后置于孵育液中37℃孵育24h,孵育结束后经染色液染色及脱色液脱色后,显示出MMP-2(Active-MMP-2或pro-MMP-2),MMP-9(Active-MMP-9 或 pro-MMP-9)为位于蓝色背景上的透亮带,用凝胶图像分析系统分析读取条带面积,宽度和灰度值,做统计分析。
1.3 统计学处理 采用SPSS 13.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞GOLPH3 mRNA和蛋白表达水平的比较与 NC-shRNA 组比较,GOLPH3-shRNA1、GOLPH3-shRNA2、GOLPH3-shRNA3组 GOLPH3 mRNA和蛋白表达水平均明显降低,差异均有统计学意义(均P<0.05);与 GOLPH3-shRNA1 组比较,GOLPH3-shRNA2、GOLPH3-shRNA3组GOLPH3 mRNA和蛋白表达水平均明显升高,差异均有统计学意义(均P<0.05),因此选用GOLPH3-shRNA1组细胞株做后续实验。见表1、图1。
2.2 两组BGC-823细胞迁移能力的比较 划痕后24h,GOLPH3-shRNA1组中细胞迁移率(13.20±2.00)%,明显低于对NC-shRNA组(40.37±5.37)%,差异有统计学意义(P<0.05),见图 2(插页)。
2.3 两组BGC-823细胞侵袭能力的比较 GOLPH3-shRNA1组中细胞穿过基底膜的细胞数(67.00±7.20)个,明显比 NC-shRNA 组(110.00±9.50)个少,差异有统计学意义(P<0.05),见图 3(插页)。
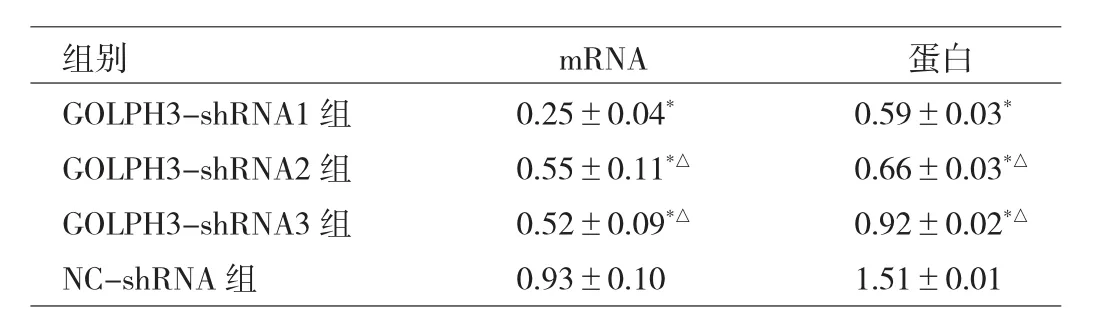
表1 转染后各组细胞中GOLPH3的mRNA和蛋白表达水平的比较
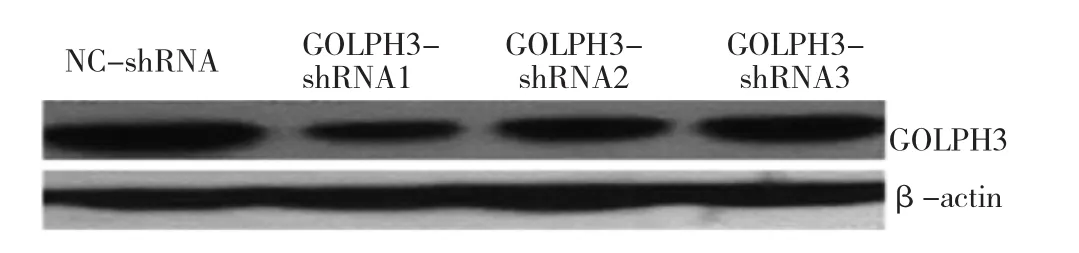
图1 4组细胞GOLPH3蛋白表达水平的电泳图
2.4 各组细胞MMP2、MMP9 mRNA表达水平的比较GOLPH3-shRNA1组细胞中,MMP2、MMP9 mRNA表达水平分别为0.49±0.04和0.69±0.04,均低于NC-shRNA组1.00±0.08和1.00±0.04,差异均有统计学意义(均P<0.05)。
2.5 各组细胞培养上清液 MMP-2和MMP-9活性的比较 与 NC-shRNA组相比,GOLPH3-shRNA1组Active-MMP-2、pro-MMP-9活性分别下降 44.2%和29.9%,差异均有统计学意义(均P<0.05),见图4。
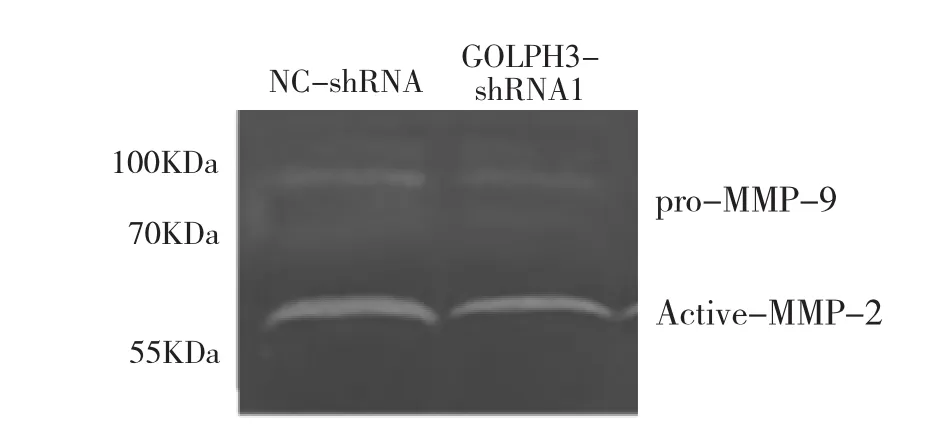
图4 各组细胞培养上清液MMP-2和MMP-9活性的比较
3 讨论
胃癌是全球第2大癌症导致死亡的病因[5],尽管胃癌治疗包括手术和化疗均取得了一些进展,但胃癌患者的预后仍然较差,尤其是晚期患者,美国和欧洲的相对5年存活率是20%左右[6]。因此,寻找胃癌的新治疗靶点和肿瘤发生机制具有重要的临床意义。囊泡运输,特别是内吞转运,在癌症的发生和转移中起着重要作用[7],内吞转运调整的信号级联和表面生长因子受体可能存在新的靶点。最近的研究表明,GOLPH3作为一种与高尔基体相关的内吞蛋白,与囊泡形成、转运有关,在口腔、非小细胞肺癌,食道等多种癌症中呈现高表达,具有致癌基因的作用[8-10],以往的研究表明,胃癌患者血清中GOLPH3浓度显著高于健康人,胃癌组织中GOLPH3的高表达与肿瘤大小、组织学分级、浸润深度、淋巴结转移密切相关[11-12]。因此本研究旨在进一步研究GOLPH3基因对胃癌细胞的侵袭、迁移的影响,GOLPH3-shRNA1质粒转染胃癌细胞BGC-823后,qRT-PCR和Western blot法检测结果显示GOLPH3 mRNA和蛋白表达水平明显低于NC-shRNA组细胞,差异有统计学意义。划痕实验表明,GOLPH3-shRNA1组细胞运动愈合划痕的比例,明显低于NC-shRNA组,侵袭实验证实,GOLPH3-shRNA1组细胞穿过膜的细胞数量,明显少于NC-shRNA组,差异均有统计学意义,表明沉默GOLPH3基因,能使胃癌细胞的迁移和侵袭能力明显降低。
GOLPH3能通过mTOR信号系统促进人类癌细胞增殖[4],而已有研究表明,在多种肿瘤中通过增加PI3K/Akt/mTOR活性可上调几种MMPs的表达[13-14],MMPs是一种螯合了锌离子的蛋白酶类,主要功能是降解各种类型的胶原、纤连蛋白、层粘连蛋白和蛋白聚糖等细胞外基质成分,因此MMPs在肿瘤新生血管生成、肿瘤侵袭和转移中扮演着重要的角色[15-16],其中,MMP-2和MMP-9在癌症转移起着至关重要的作用[16],因此笔者假设,GOLPH3能够通过调节MMP-2或MMP-9,来影响肿瘤细胞的浸润与转移。本实验结果显示,GOLPH3-shRNA1组中,MMP-2、MMP-9 mRNA表达水平,均低于NC-shRNA组,差异均有统计学意义,明胶酶谱实验表明GOLPH3-shRNA1组中Active-MMP-2、pro-MMP-9的活性也明显低于对照组细胞,差异有统计学意义。这些结果证实了笔者的假设,GOLPH3很可能通过增加MMP-2和MMP-9的表达与活性,从而促进胃癌细胞的迁移与侵袭,具体的机制有待于进一步的研究。
本研究结果表明,GOLPH3-shRNA1可以特异性沉默BGC-823细胞中GOLPH3的表达,并降低MMP-2与MMP-9的表达及活性,有效地抑制该细胞的迁移和侵袭,今后笔者将进一步研究他的调控机制,为胃癌发病机制的研究提供了新的线索。

图2 转染GOLPH3-shRNA1后BGC-823细胞迁移能力的比较

图3 两组BGC-823细胞侵袭能力显微镜下所见(×400)

