KIF11、RhoA和Fascin蛋白在口腔鳞状细胞癌中的表达及意义
余 璐 文 燕 汤俊起
口腔鳞状细胞癌是存在于口腔黏膜上皮的鳞状细胞癌,它能早期经淋巴结转移至其他组织器官,有烟酒嗜好的中年人群多发[1]。口腔鳞癌的预后较差,一般采用手术切除作为常用的治疗手段,但是手术的问题在于严重影响患者的面部美观[2-3]。驱动蛋白(kinesin)在膜性细胞器的运输,有丝分裂、信号转导、mRNA和蛋白质的运输等方面起着重要作用[4-5]。驱动蛋白家族成员KIF11作用于早期的有丝分裂,在染色体的分离起着很重要的作用,和细胞增殖有相关性[6]。RhoA属于小G蛋白的Ras超家族成员,广泛参与肌动蛋白的细胞骨架重组、细胞黏附、细胞运动等涉及肿瘤侵袭和转移的各个环节的调控[7]。Fascin蛋白是肌动蛋白结合蛋白,对细胞移动起着重要作用。研究发现Fascin蛋白在多种肿瘤组织和癌前病变组织中呈现上调表达。有研究显示Fascin蛋白对肿瘤早期诊断、预后判定、辅助治疗选择具有重要意义[8-9]。
本研究通过检测KIF11、RhoA和Fascin蛋白在口腔鳞癌中的表达及与口腔鳞癌临床病理特征的关系,为口腔鳞癌的预后判断及临床治疗提供依据。
1 材料与方法
1.1 研究对象
选取2016年2月至2018年2月我院保存的口腔鳞癌蜡块组织标本70例,其中,男性40例,女性30例;年龄40~73岁,中位年龄61岁。淋巴结转移患者29例,无淋巴结转移患者41例;病理分级参照WHO口腔鳞癌分级标准,高分化32例,中分化28例,低分化10例;TNM分期标准,T1期11例,T2期24例,T3期20例,T4例15例。患者纳入标准:①病理确诊为口腔鳞癌;②在手术前没有接受过放疗和化疗等;③临床资料相对完整。排除合并其他原发性恶性肿瘤的患者。选取相同组织标本距癌组织>2 cm的癌旁组织作为对照,经病理性确认切缘为阴性。
1.2 主要试剂
Trizol试剂(北京百泰克生物技术有限公司);甲紫溶液(广东恒健制药有限公司);无酶的RNA冲洗液(北京百泰克生物技术有限公司);免疫荧光制剂(北京百泰克生物技术有限公司)。鼠抗人KIF11单克隆抗体、鼠抗人RhoA单克隆抗体和鼠抗人Fascin单克隆抗体(美国Abcam公司);生物素-链霉卵白素免疫组化检测试剂盒(北京博奥森生物技术有限公司);DAB显色试剂盒(北京中杉金桥生物技术公司)。
1.3 免疫组织化学染色
切片脱蜡水化,3%H2O2甲醇灭活内源性过氧化物酶活性,依次滴加一抗(稀释比例均为1∶300)、二抗,DAB显色,苏木精复染,常规脱水、透明、封片。用磷酸盐缓冲液(PBS)代替一抗作阴性对照。
1.4 RNA的提取和逆转录
使用TRIzol试剂对组织RNA进行提取,按照操作试剂盒的说明进行RNA逆转录,转录产物荣誉DEPC水中,保存于-20 ℃冰箱中待用。
1.5 PCR扩增及电泳
吸取逆转录产物5 μl进行PCR扩增,GAPDH作为内参物,引物由Invitrogen公司合成,其序列表见表1。KIF11、RhoA和Fascin扩增条件为:95 ℃ 10 min,95 ℃ 15 s,59 ℃ 40 s,72 ℃ 45 s,循环次数40次。取PCR反应后产物适量进行凝胶电泳(120 V,35 min)。最后进行电泳条带灰度值的半定量分析,重复5次,mRNA的相对表达量使用目的与内参条带的灰度值比值。

表1 RT-PCR引物序列
1.6 结果判断
病理结果显示KIF11、RhoA和Fascin定位于上皮细胞的细胞质和(或)胞核,阳性判断标准为出现棕黄色颗粒。随机选取5个视野,着色细胞比例≤25%为1分,26%~50%为2分,>50%为3分;染色强度无着色为0分,淡黄色为1分,黄色为2分,棕褐色为3分。最终得分为着色细胞比例和染色强度评分相乘,积<4分为阴性,≥4分为阳性。
1.7 统计学处理
数据处理应用SPSS 19.0软件进行,计数资料的比较,使用χ2检验,采用Spearman 相关分析法用于相关性的分析。P<0.05为差异具有显著性。
2 结果
2.1 KIF11、RhoA和Fascin蛋白在癌组织及癌旁组织中的阳性率比较
KIF11主要在细胞质中表达,KIF11在口腔鳞癌组织中的阳性表达率为68.57%,而癌旁组织中KIF11的阳性表达率为7.14%,显著低于癌组织(P<0.05);RhoA主要表达于细胞质,少量表达于细胞核,癌组织中RhoA阳性表达率为60.00%,而癌旁组织中RhoA阳性表达率为11.43%,显著低于癌组织(P<0.05);Fascin主要表达于细胞质,癌组织中Fascin阳性表达率为64.29%,而癌旁组织中Fascin阳性表达率为12.86%,显著低于癌组织(P<0.05),见表2。

表2 KIF11、RhoA和Fascin蛋白在癌组织及癌旁组织中阳性率比较(例,%)
2.2 KIF11、RhoA和Fascin mRNA表达水平比较
结果显示,KIF11、RhoA和Fascin mRNA在口腔鳞癌组织中的相对表达量分别为0.125±0.067,0.108±0.052和0.116±0.061,明显高于三者在癌旁组织中的相对表达量0.011±0.006,0.034±0.013和0.021±0.009,差异具有统计学意义(P<0.05),见表3。

表3 KIF11、RhoA和Fascin mRNA表达水平比较
2.3 KIF11、RhoA和Fascin蛋白表达与口腔鳞癌临床特征的关系
KIF11、RhoA和Fascin蛋白表达与口腔鳞癌分化程度、颈淋巴结转移、临床分期及肿瘤直径有关(P<0.05),与年龄和性别无相关性(P>0.05),见表4。
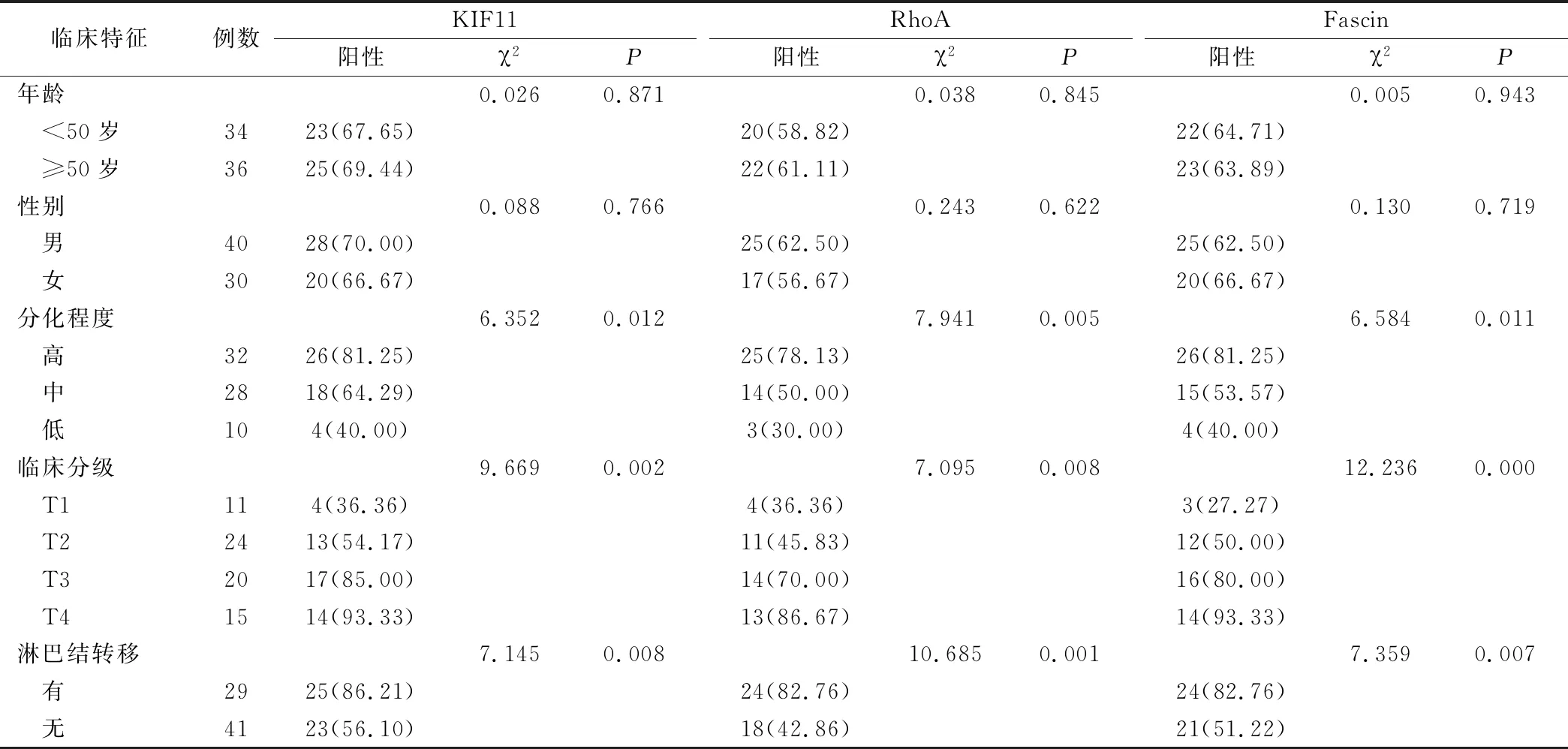
表4 KIF11、RhoA和Fascin mRNA表达水平与口腔鳞癌临床特征的关系(例,%)
2.4 相关性分析
Spearman 相关分析显示,KIF11蛋白与RhoA蛋白表达呈正相关(γ=0.479,P<0.05),Fascin与RhoA蛋白表达呈正相关(γ=0.521,P<0.05)。
3 讨论
目前口腔鳞癌的病因和发病机制仍不清楚,但是越来越多的肿瘤标志物被发现,可用于口腔鳞癌的诊断,治疗和预后[10-11]。KIF11主要与细胞分裂中双极纺锤体的形成和分离以及中心体的分离有关。KIF11在大多数口腔癌细胞和组织中都有表达,但在健康的舌组织中几乎没有检测到。有研究发现抑制KIF11的表达可以促进肿瘤细胞的凋亡,KIF11在口腔鳞癌中的生长和生存中起关键作用,可以成为口腔鳞癌的诊断、治疗和预后因素[12],但相关研究较少。本研究中癌组织中KIF11的阳性表达率为68.57%,显著低于癌旁组织中KIF11的阳性表达率7.14%(P<0.05),KIF11 mRNA在口腔鳞癌组织中的相对表达量分别为(0.125±0.067),显著高于癌旁组织(0.011±0.006)(P<0.05)。结果提示KIF11可作为口腔鳞癌诊断的标志性蛋白。另外KIF11蛋白阳性表达与口腔鳞癌分化程度、临床分期及淋巴结转移有关(P<0.05),结果显示KIF11蛋白阳性表达率越高,肿瘤的恶性程度越高,但是其与年龄和性别无关(P>0.05),提示KIF11蛋白可作为判断口腔鳞癌分化程度等的标志性蛋白。Kayo等研究显示KIF11在99个口腔癌组织中表达率为64.6%,但在健康口腔上皮中没有表达,KIF11可能是口腔癌的一个潜在的预后生物标志物和治疗靶点,与本研究结果一致[12]。
RhoA广泛参与肌动蛋白的细胞骨架重组、细胞黏附、细胞运动等涉及肿瘤侵袭和转移的各个环节的调控,在肿瘤发生发展、侵袭和转移过程中有着重要作用[13]。研究发现在肝癌、乳腺癌、睾丸癌等恶性肿瘤中均发现RhoA存在异常表达,其上调和(或)过表达与不良预后相关[14]。本研究中癌组织中RhoA蛋白的阳性表达率为60.00%,显著低于癌旁组织中RhoA的阳性表达率11.43%(P<0.05);RhoA mRNA在口腔鳞癌组织中的相对表达量(0.108±0.052),显著高于癌旁组织(0.034±0.013)(P<0.05)。以上结果提示RhoA蛋白可作为口腔鳞癌诊断的标志性蛋白。另外RhoA蛋白阳性表达与口腔鳞癌分化程度、临床分期及淋巴结转移有关(P<0.05),说明RhoA蛋白阳性表达率越高,口腔鳞癌的恶性程度越高,但是其与年龄和性别无关(P>0.05),提示RhoA蛋白可作为判断口腔鳞癌分化程度等的标志性蛋白。王莹等研究发现RhoA在口腔鳞癌组织中的阳性表达率为80.0%,作者推测RhoA可能与口腔癌的发生发展密切相关[15]。此结果与本研究结果相一致。
Fascin蛋白活性与癌细胞的运动、细胞的转移有密切关系[8]。研究发现随着Fascin基因表达的增加,细胞分化程度降低,细胞运动性和侵袭能力均增强[16]。另有研究发现随着肿瘤浸润能力的增强,Fascin蛋白的数量会增多,说明其在口腔鳞癌在肿瘤的浸润转移中发挥作用[9]。本研究中口腔鳞癌组织中Fascin的阳性表达率为64.29%,显著低于癌旁组织中Fascin的阳性表达率12.86%(P<0.05);Fascin mRNA在口腔鳞癌组织中的相对表达量(0.116±0.061),显著高于癌旁组织(0.021±0.009)(P<0.05)。以上结果提示Fascin蛋白可作为口腔鳞癌诊断的标志性蛋白。另外Fascin蛋白阳性表达与与口腔鳞癌分化程度、临床分期及淋巴结转移有关(P<0.05),说明Fascin蛋白阳性表达率越高,肿瘤的恶性程度越高,但是其与年龄和性别无关(P>0.05),提示Fascin蛋白可作为判断口腔鳞癌分化程度等的标志性蛋白。
以往研究显示KIF驱动蛋白可以改变RhoA GTP酶信号,当KIF驱动蛋白缺失时细胞中的RhoA活性下降[17]。另外Jayo等发现Fascin-1是Rho的功能靶点,Rho也能调节Fascin-1和肌动蛋白的相互作用[18]。本研究显示口腔鳞癌患者中KIF11和Fascin的表达均与RhoA呈显著正相关,结果提示KIF11、Fascin和RhoA之间存在相互影响的关系,可能共同参与了口腔鳞癌的发生发展。
综上所述,KIF11、RhoA和Fascin蛋白过表达与口腔鳞癌的发生、分化程度等显著相关,共同参与了口腔鳞癌的发生发展,联合检测为临床上口腔鳞癌的诊断及预后提供了新的参考。

