染料木素对LPS诱导BV2小胶质细胞炎症反应的作用
苗悦 都中蕊 杨叶 陈文芳

[摘要]目的探讨染料木素(GEN)对脂多糖(LPS)诱导的BV2小胶质细胞炎症反应的抑制作用及雌激素核受体(ER)阻断剂ICI182,780的阻断效应。
方法常规培养BV2小胶质细胞,分为对照组、LPS组、GEN+LPS组、ICI182,780+GEN+LPS组。对照组和LPS组细胞分别给予0.1g/L二甲基亚砜(DMSO)和1mg/L的LPS作用6h;GEN+LPS组细胞在加入LPS前先用GEN(10μmol/L)预保护1h;ICI182,780+GEN+LPS组先加入ICI182,780(1μmol/L)作用细胞1h,然后加入GEN预保护1h,再加入LPS共同作用6h。应用实时荧光定量PCR技术检测各组肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-[STBX]1β)基因的表达。
结果与对照组比较,LPS组炎性因子TNF-α和IL-[STBX]1β基因的表达明显上调(F=131.00、43.13,q=26.04、14.95,P<0.01);GEN预保护能明显降低LPS诱导的TNF-α和IL-[STBX]1β基因表达上调(q=17.08、9.70,P<0.01),此作用可以被ER特异性阻断剂ICI182,780所阻断(q=10.27、5.85,P<0.01)。
结论GEN能够抑制LPS诱导的BV2小胶质细胞TNF-α和IL-[STBX]1β的基因表达,其抗炎机制与ER途径的激活有关。
[关键词]染料木黄酮;脂多糖类;小神经胶质细胞;炎症;肿瘤坏死因子α;白细胞介素1β
[中图分类号]R338.2;R916.4
[文献标志码]A
[文章编号]2096-5532(2020)01-0001-04
近年來,越来越多的研究结果表明,小胶质细胞参与了帕金森病(PD)的发病和进展[1]。虽然小胶质细胞数量较少,仅占成年大脑神经胶质细胞群的10%~15%[2],但它在中枢神经系统的宿主防御和组织修复中起重要作用[3]。因此,如何有效地预防或抑制小胶质细胞的活化并保护神经元免受损伤是研究人员目前关注的问题。研究表明,雌激素可以抑制小胶质细胞的活化,其抑制作用与小胶质细胞上的雌激素受体有关[4]。然而,长期使用雌激素可导致激素依赖性疾病[5],如乳癌和子宫内膜癌等,从而限制了雌激素的临床应用。植物雌激素因其具有副作用小、使用安全等特点越来越受到人们的关注。染料木素(GEN)是从豆科植物如大豆中提取的,该物质化学结构与类固醇雌激素相似,可以激活经典的雌激素核受体(ER)和G蛋白偶联雌激素受体(GPER)。GEN的生物学作用包括抗炎[6]、抗氧化[7]、抗癌[8]、保护骨骼[9]以及保护心血管系统[10]。有研究发现,GEN可以抑制炎性因子的生成,在体内发挥抗炎保护作用。有临床研究表明,PD病人脑内小胶质细胞被激活,释放的炎症因子导致神经元损害,而神经元的损伤会进一步激活小胶质细胞,从而在小胶质细胞激活和神经元损伤之间形成恶性循环,进而导致神经元的死亡[11]。GEN可对抗上述过程[12-13]。本课题组前期实验已经证明GEN可以通过雌激素膜受体(GPER)发挥抗炎作用[14],因GEN还能与ER结合,为探讨ER是否参与了GEN对小胶质细胞炎症反应的抑制作用,本研究观察了ER特异性阻断剂ICI182,780对GEN抗炎作用的影响。现将结果报告如下。
1材料与方法
1.1实验材料
GEN购自上海同田生物技术有限公司;脂多糖(LPS)和ICI182,780购自美国Sigma公司;BV2小胶质细胞属于小鼠小胶质瘤细胞系,购自北京市协和医学院细胞资源中心;TRIzol试剂购自美国LifeTechnologies公司;聚合酶链式反应(PCR)逆转录试剂盒购自Roche公司;SYBRGreen购自美国Takara公司。
1.2细胞培养及分组
将BV2小胶质细胞接种于培养瓶或6孔板中,应用高糖DMEM培养液(含100kU/L青霉素、100mg/L链霉素和体积分数0.10FBS),置于含体积分数0.05CO2的37℃无菌培养箱中常规培养。显微镜下观察细胞融合度达到80%~90%时进行分组和加药处理。将细胞分为对照组(A组)、LPS组(B组)、GEN+LPS组(C组)和ICI182,780+GEN+LPS组(D组)。对照组细胞给予0.1g/L二甲基亚砜(DMSO)处理;LPS组细胞则加入LPS(1mg/L)作用6h;GEN+LPS组细胞加LPS前先用GEN(10μmol/L)预保护1h;ICI182,780+GEN+LPS组细胞先加入ICI182,780(1μmol/L)作用1h,然后加入GEN(10μmol/L)预保护1h,再加入LPS(1mg/L)共同作用6h。
1.3实时荧光定量PCR(RT-PCR)检测肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-[STBX]1β)mRNA的表达
应用TRIzol裂解细胞,提取总RNA。加入总RNA1μg、5×gDNAEraserBuffer2μL、gDNA1μL,补充DEPC水使总体积达10μL,轻轻混匀、离心。在42℃下变性2min,立即置于冰上冷却。然后将RTPrimerMix1μL、5×PrimeScriptBuf-
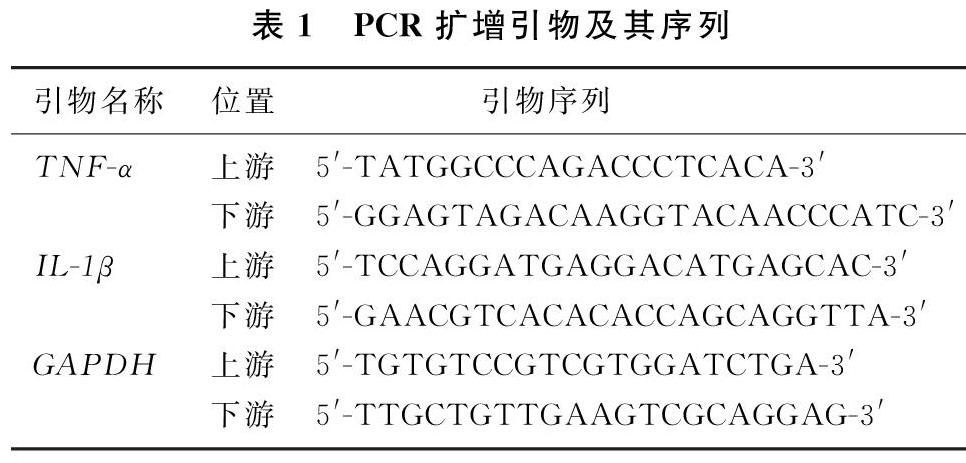
fer2(forRealTime)4μL、PrimeScriptRTEnzymeMixⅠ1μL、RNaseFreeddH2O4μL加入第一步反应体系中至总体积20μL,混匀、离心。在37℃下反应15min,然后升温至85℃,作用5s使逆转录酶失活,4℃冷却。采用SYBRGreen染料法定量检测TNF-α和IL-[STBX]1β与GAPDH的基因表达。PCR扩增引物及其序列见表1。采用2-△△CT法计算目的基因相对表达量。
1.4統计学处理
实验结果以[AKx-D]±s形式表示,应用GraphPadPrism5.0统计软件进行单因素方差分析(One-WayANOVA)并继以Tukey法进行两两比较。P<0.05则表明差异有统计学意义。
2结果
与对照组相比,LPS组炎性因子TNF-α和IL-[STBX]1β的基因表达均明显上调(F=131.00、43.13,q=26.04、14.95,P<0.01);GEN+LPS组TNF-α和IL-[STBX]1β的基因表达较LPS组均明显降低,差异有统计学意义(q=17.08、9.70,P<0.01);GEN的抗炎作用可以被ER特异性拮抗剂ICI182,780所阻断,ICI182,780+GEN+LPS组与GEN+LPS组细胞TNF-α和IL-[STBX]1β基因表达比较,差异有统计学意义(q=10.27、5.85,P<0.01)。见表2。
3讨论
PD是发病率仅次于阿尔茨海默病(AD)的一种神经退行性疾病[15],其病理学特征是黑质中多巴胺能神经元的进行性退化和缺失[16]。PD的确切病因目前尚不明确,但已知与环境、遗传和免疫因素等有关。1988年,有研究者认为炎症可能是PD的第一致病机制[17]。MCGEER等[18]研究结果显示,促炎细胞因子合成增加可以激活PD病人纹状体的小胶质细胞。近年来,越来越多的研究表明,神经炎症在PD的发病机制中起着重要作用[19-22]。神经炎症的特征包括小胶质细胞的活化,反应性星形胶质细胞增多以及许多炎症递质如细胞因子、趋化因子、前列腺素、补体级联蛋白、活性氧和活性氮等物质的释放[23-25]。这些因素可以破坏血-脑脊液屏障并使免疫细胞进入中枢神经系统。因此,越来越多的研究者开始关注如何有效降低神经炎症,为神经退行性疾病的治疗提供作用靶点。
GEN是一种从豆科植物中提取的脂溶性黄酮类化合物,作为一种能有效渗透血-脑脊液屏障的植物雌激素受到了广泛关注[26-28]。以往的研究结果表明,GEN能与ER结合诱导雌激素调控的靶基因表达[29]。近年来,人们认为GEN在体内和体外都具有神经营养和神经保护作用[30-33]。本课题组前期研究结果表明,GEN对1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的小鼠黑质神经元凋亡具有保护作用[34]。GEN能对抗6-羟基多巴胺(6-OHDA)对SK-N-SH细胞的神经毒性[35]。近年来的研究显示,GEN可通过Toll样受体4(TLR4)和核因子κB(NF-κB)信号通路拮抗β-淀粉样肽或LPS诱导的小胶质细胞炎症损伤[12-13]。本课题组前期研究表明,GEN对LPS诱导的小胶质细胞一氧化氮合酶(iNOS)、环氧化酶-2(COX-2)、TNF-α、IL-1β和IL-6的表达有剂量依赖性的抑制作用,10μmol/L的GEN抗炎作用显著,且其抗炎作用可以被GPER特异性阻断剂G15所阻断[14]。为进一步探讨经典核受体ER是否参与了GEN的抗炎抑制作用,本实验观察了ER的特异性阻断剂ICI182,780对GEN抗炎作用的影响,结果显示,应用阻断剂后,GEN对炎症因子TNF-α和IL-[STBX]1β基因表达的抑制作用明显降低,表明ER也参与了GEN的抗炎作用。
综上所述,GEN能够抑制LPS诱导的BV2小胶质细胞TNF-α和IL-[STBX]1β的基因表达,其抗炎机制与ER信号途径的激活有关。
[参考文献]
[1][ZK(#]KETTENMANNH,KIRCHHOFFF,VERKHRATSKYA.Microglia:newrolesforthesynapticstripper[J].Neuron,2013,77(1):10-18.
[2]NAYAKD,ROTHTL,MCGAVERNDB.Microgliadeve-lopmentandfunction[J].AnnuRevImmunol,2014,32:367-402.
[3]KETTENMANNH,HANISCHUK,NODAM,etal.Physiologyofmicroglia[J].PhysiolRev,2011,91(2):461-553.
[4]VILLAA,VEGETOE,POLETTIA,etal.Estrogens,neuroinflammation,andneurodegeneration[J].EndocrineReviews,2016,37(4):372-402.
[5]HANRui,GUShanzhi,ZHANGYujiao,etal.Estrogenpromotesprogressionofhormone-dependentbreastcancerthroughCCL2-CCR2axisbyupregulationofTwistviaPI3K/AKT/NF-κBsignaling[J].ScientificReports,2018,8(1):9575.
[6]LIJinchao,LIJun,YUEYe,etal.Genisteinsuppressestumornecrosisfactorα-inducedinflammationviamodulatingreactiveoxygenspecies/Akt/nuclearfactorκBandadenosinemonophosphate-activatedproteinkinasesignalpathwaysinhumansynoviocyteMH7Acells[J].DrugDesignDevelopmentandTherapy,2014,8:315-323.
[7]JAVANBAKHTMH,SADRIAR,DJALALIM,etal.Soyproteinandgenisteinimprovesrenalantioxidantstatusinexperimentalnephroticsyndrome[J].Nefrologia,2014,34(4):483-490.
[8]CHENWF,HUANGMH,TZANGCH,etal.Inhibitoryactionsofgenisteininhumanbreastcancer(MCF7)cells[J].BiochimicaetBiophysicaActa,2003,1638(2):187-196.
[9]CHENWF,WONGMS.GenisteinmodulatestheeffectsofparathyroidhormoneinhumanosteoblasticSaOS2cells[J].TheBritishJournalofNutrition,2006,95(6):1039-1047.
[10]LEESH,LEEJJ,ASAHARAT,etal.Genisteinpromotesendothelialcolony-formingcell(ECFC)bioactivitiesandcardiacregenerationinmyocardialinfarction[J].PLoSOne,2014,9(5):e96155.
[11]HAQUEME,AKTHERM,JAKARIAM,etal.TargetingthemicroglialNLRP3inflammasomeanditsroleinParkinsonsdisease[J].MovementDisorders,2019.doi:10.1002/mds.27874.
[12]ZHOUXin,YUANLinhong,ZHAOXia,etal.Genisteinantagonizesinflammatorydamageinducedbyβ-amyloidpeptideinmicrogliathroughTLR4andNF-κB[J].Nutrition(Burbank,LosAngelesCounty,Calif.),2014,30(1):90-95.
[13]JEONGJW,LEEHH,HANMH,etal.Anti-inflammatoryeffectsofgenisteinviasuppressionofthetoll-likereceptor4-mediatedsignalingpathwayinlipopolysaccharide-stimulatedBV2microglia[J].Chemico-BiologicalInteractions,2014,212:30-39.
[14]DUZhongrui,FENGXiaoqing,LINa,etal.Gprotein-coupledestrogenreceptorisinvolvedintheanti-inflammatoryeffectsofgenisteininmicroglia[J].Phytomedicine:InternationalJournalofPhytotherapyandPhytopharmacology,2018,43:11-20.
[15]CACABELOSR.Parkinsonsdisease:frompathogenesistopharmacogenomics[J].IntJMolSci,2017,18(3):551.
[16]DICKSONDW.NeuropathologyofParkinsondisease[J].ParkinsonismRelatDisord,2018,46(Suppl1):S30-S33.
[17]MCGEERPL,ITAGAKIS,BOYESBE,etal.ReactivemicrogliaarepositiveforHLADRinthesubstantianigraofParkinsonsandAlzheimersdiseasebrains[J].Neurology,1988,38(8):1285-1291.
[18]MCGEERPL,MCGEEREG.InflammationandneurodegenerationinParkinsonsdisease[J].ParkinsonismRelatDisord,2004,10Suppl1:S3-S7.
[19]LEEY,LEES,CHANGSC,etal.SignificantrolesofneuroinflammationinParkinsonsdisease:therapeutictargetsforPDprevention[J].ArchivesofPharmacalResearch,2019,42(5,SI):416-425.
[20]VIVEKANANTHAMS,SHAHS,DEWJIR,etal.NeuroinflammationinParkinsonsdisease:roleinneurodegenerationandtissuerepair[J].IntJNeurosci,2015,125(10):717-725
[21]KEMPURAJD,THANGAVELR,NATTERUPA,etal.Neuroinflammationinducesneurodegeneration[J].JNeurolNeurosurgSpine,2016,1(1):PMID28127589.
[22]WANGQ,LIUY,ZHOUJ.NeuroinflammationinParkinsonsdiseaseanditspotentialastherapeutictarget[J].TranslNeurodegener,2015,4:19.
[23]SCHAINM,KREISLWC.Neuroinflammationinneurodegenerativedisorders—areview[J].CurrentNeurologyandNeuroscienceReports,2017,17(3):25.
[24]曹飞.小胶质细胞介导的神经炎症在帕金森病发生发展中的作用[J].济宁医学院学报,2019,42(4):289-293,297.
[25]GONZLEZ-REYESRE,NAVA-MESAMO,VARGAS-SNCHEZK,etal.InvolvementofastrocytesinAlzheimersdiseasefromaneuroinflammatoryandoxidativestressperspective[J].FrontiersinMolecularNeuroscience,2017,10:427.
[26]MOZOLEWSKIP,MOSKOTM,JAKBKIEWICZ-BANECKAJ,etal.Nonsteroidalanti-inflammatorydrugsmodulatecellularglycosaminoglycansynthesisbyaffectingEGFRandPI3Ksignalingpathways[J].ScientificReports,2017,7:43154.
[27]CHENWF,HUANGMH,TZANGCH,etal.Inhibitoryactionsofgenisteininhumanbreastcancer(MCF-7)cells[J].BiochimBiophysActa,2003,1638(2):187-196.
[28]CHENWF,WONGMS.GenisteinmodulatestheeffectsofparathyroidhormoneinhumanosteoblasticSaOS-2cells[J].BrJNutr,2006,95(6):1039-1047.
[29]THOMASP,DONGJ.Bindingandactivationoftheseven-transmembraneestrogenreceptorGPR30byenvironmentalestrogens:apotentialnovelmechanismofendocrinedisruption[J].TheJournalofSteroidBiochemistryandMolecularBiology,2006,102(1/5):175-179.
[30]吴环立,马现启,赵海洋.染料木素对实验性脑出血大鼠PI3K/Akt通路的影响[J].临床与病理杂志,2018,38(5):917-921.
[31]刘瑞珍,黎晓,朱焱,等.染料木素磺酸钠对脑缺血再灌注损伤大鼠细胞凋亡相关基因表达的影响[J].赣南医学院学报,2018,38(2):99-102,107.
[32]WUHuancheng,HUQunliang,ZHANGShijun,etal.NeuroprotectiveeffectsofgenisteinonSH-SY5YcellsoverexpressingA53Tmutantα-synuclein[J].NeuralRegenerationResearch,2018,13(8):1375-1383.
[33]OZBEKZ,AYDINHE,KOCMANAE,etal.Neuroprotectiveeffectofgenisteininperipheralnerveinjury[J].TurkishNeurosurgery,2017,27(5):816-822.
[34]LIULixing,CHENWenfang,XIEJunxia,etal.NeuroprotectiveeffectsofgenisteinondopaminergicneuronsinthemicemodelofParkinsonsdisease[J].NeuroscienceResearch,2008,60(2):156-161.
[35]GAOQG,XIEJX,WONGMS,etal.IGF-ⅠreceptorsignalingpathwayisinvolvedintheneuroprotectiveeffectofgenisteinintheneuroblastomaSK-N-SHcells[J].EuropeanJournalofPharmacology,2012,677(1/3):39-46.
(本文編辑 马伟平)

