1型糖尿病患者血浆外泌体蛋白质组学分析*
张 莉,杨书才,唐景云,黄伟忠,黄彩艳
(广东省深圳市坪山区人民医院:1.检验科;2.内分泌科,广东深圳 518118;3.湖北医药学院第八临床学院综合教研室,广东深圳 518118)
糖尿病在我国已成为继肿瘤和心脑血管疾病的第三大威胁人民身体健康的慢性非传染性疾病[1]。其中1型糖尿病(T1DM),又被称为胰岛素依赖型糖尿病,是由于机体胰腺中的β细胞被大量破坏,导致胰岛素分泌严重不足而引起的一种代谢性疾病[2]。T1DM起病急,患者容易发生酮症酸中毒[3],必须用胰岛素治疗才能获得满意疗效,否则将危及生命。外泌体是由细胞中内出芽形成的多囊泡内体与细胞膜融合后向细胞外分泌的具有脂质双层膜的微小囊泡[4],内含有多种生物大分子,如脂质、核酸和蛋白质等。这些生物大分子能及时反映出患者疾病的动态变化,生物大分子也是外泌体在细胞间进行信息交流和物质交换的基础。外泌体的检测在各个领域有着广泛的应用前景,例如:辅助用药及疗效监控等[5]。近年来外泌体研究受到广泛关注,外泌体检测也有望为T1DM患者的诊断提供新的生物学标志物和作为辅助治疗的工具[6]。本研究利用高效液相色谱-质谱联用技术检测了T1DM患者和健康者血浆外泌体中的蛋白质,分析了两组人群间具有表达差异的蛋白质,以及这些差异蛋白可能的生物学功能,旨在为后续T1DM的发病机制研究,以及早期诊断或疗效监控筛选出新的候选分子。
1 资料与方法
1.1一般资料 将2018年6月15日至2018年12月31日于深圳市坪山区人民医院住院的T1DM患者(T1DM组)与健康体检者(对照组)纳入研究,纳入研究者知情同意后,采静脉血(10 mL)置于血液收集管中(含EDTA),2 h内分离静脉血血浆,冷冻离心机调至4 ℃,4 000 r/min,离心15 min,离心后取上层血浆于-80 ℃保存。筛选出无传染性病毒感染和既往病史的患者血液标本。共收集到T1DM患者血浆标本6例,健康者血浆标本6例。
1.2仪器与试剂 外泌体分离试剂盒购于IZON公司;BCA试剂盒、TMT试剂盒购于Thermofisher公司;蛋白酶抑制剂购于Calbiochem公司;碘代乙酰胺、二硫苏糖醇、尿素和三乙基碳酸氢铵购于Sigma公司;胰酶购于Promega公司;乙腈购于Fisher Chemical公司;Strata X C18固相萃取小柱购于Phenomenex公司;液相色谱柱Agilent 300 Extend C18购于Agilent公司。
1.3方法
1.3.1血浆外泌体蛋白提取 血浆标本从-80 ℃取出,于4 ℃,12 000×g,离心15 min,上清液转移至新的离心管,0.22 μmol/L微孔滤膜过滤后,按试剂盒说明书分离外泌体。然后加入终浓度为8 mol/L的尿素以及蛋白酶抑制剂超声裂解,利用BCA试剂盒进行蛋白浓度测定。
1.3.2蛋白标本制备 将二硫苏糖醇加入制得的蛋白溶液中,使终浓度为5 mmol/L后,放置于56 ℃还原30 min。加入碘代乙酰胺使其终浓度为11 mmol/L,于室温避光孵育15 min。随后稀释标本的尿素浓度至低于2 mol/L。以胰酶和蛋白1∶50的质量比例加入胰酶后,放置于37 ℃酶解过夜。过夜后,以胰酶和蛋白1∶100的质量比例加入胰酶,于室温继续酶解4 h。将酶解后的肽段使用Strata X C18除盐后进行真空冷冻干燥。将肽段使用0.5 mol/L三乙基碳酸氢铵溶解,使用TMT试剂盒,按照说明书标记肽段。使用高pH反向高效液相色谱的方法分级标记后的肽段,色谱柱为5 μm粒径,4.6 mm 内径,250 mm长的Agilent 300 Extend C18。肽段分级梯度设置为8%~32%乙腈、pH设置为9,60 min分离60个组分,随后将60个组分合并为9个,合并后的组分进行真空冷冻干燥,进行后续操作。
1.3.3高效液相色谱-质谱联用分析 使用EASY-nLC 1200超高效液相系统分离经过液相色谱流动相A相溶解后的肽段。流动相A含0.1%甲酸和2%乙腈的水溶液;流动相B含0.1%甲酸和90%乙腈的水溶液。液相梯度设置为0~60 min,10%~22%B;60~82 min,22%~35%B;82~86 min,35%~80%B;86~90 min,80%B,流速维持在400 nL/min。使用超高效液相系统分离肽段,后注入NSI离子源中电离进行Orbitrap Fusion Lumos质谱分析。设置离子源电压为2.0 kV,检测分析肽段母离子及其二级碎片都使用高分辨的Orbitrap。设置一级质谱扫描范围为350~1 550 m/z,设置扫描分辨率为60 000;固定二级质谱扫描范围起点为100 m/z,设置二级扫描分辨率为30 000。在一级扫描后选择信号强度最高的前10肽段母离子依次进入HCD碰撞池,进行能量碎裂。依次进行二级质谱分析。设置自动增益控制(AGC)为5E4,设置信号阈值为5E4,设置最大注入时间为70 ms,设置串联质谱扫描的动态排除时间为30 s,避免母离子的重复扫描从而提高质谱有效利用率。
1.3.4数据库搜索 二级质谱数据使用Maxquant(v1.5.2.8)进行检索。检索参数设置为数据库:Human_SwissProt_1808(II0387条序列),添加反库以计算随机匹配造成的假阳性率(FDR),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;设置酶切方式为Trypsin/P;设置漏切位点数为2;设置肽段最小长度为7个氨基酸残基;设置肽段最大修饰数为5;设置First search和Main search的一级母离子质量误差容忍度分别为20 ppm和5 ppm,二级碎片离子的质量误差容忍度为相对分子质量0.02×103。设置半胱氨酸烷基为固定修饰,可变修饰为甲硫氨酸的氧化,蛋白N端的乙酰化,脱酰胺化(NQ)。设置定量方法为TMT-10plex,蛋白鉴定、肽段谱图匹配(PSM)鉴定的FDR都为1%。
1.3.5蛋白差异表达分析 选择质谱分析中获得的可定量蛋白进行多次全蛋白定量重复实验。计算T1DM组和对照组平均值的比值,该比值作为两组最终的差异表达量,计算两组该蛋白水平比较的P值。
1.3.6生物信息学分析 分别使用InterProScan、KAAS、KEGG Mapper、Wolfpsort、Perl module、Blast、R package networkD3等软件对差异蛋白进行蛋白注释、功能分类、功能富集分析、聚类分析及蛋白相互作用分析。
1.4统计学处理 每组各个标本的相对定量值以2为底数取对数值(以使得数据符合正态分布),然后用双样本双尾t检验方法计算P值。当P<0.05时,差异表达量大于1.2为显著上调,小于1/1.2为显著下调。
2 结 果
2.1T1DM外泌体差异表达蛋白 经质谱分析和蛋白理论数据搜库后,得到有效谱图数为41 569。通过谱图解析共鉴定到9 779条特异性肽段,共得到1 146个蛋白,其中948个可用于定量。经多次重复实验得到每个标本的定量值后,发现T1DM组相对于对照组表达上调的蛋白数为37,下调的为122,见图1。
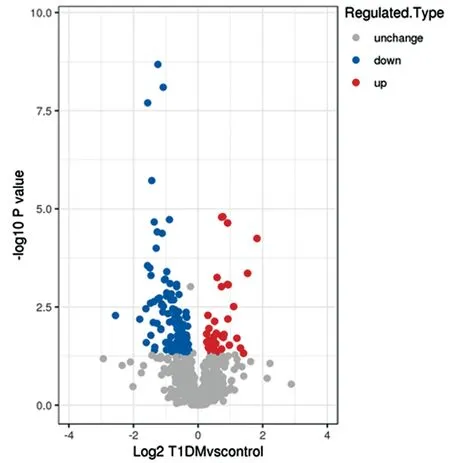
图1 血浆外泌体差异表达蛋白定量火山图
2.2差异表达蛋白的功能分类 对差异表达进行功能分类后,发现这些差异表达的蛋白质主要集中于单一生物进程、生物调控、细胞进程及应激反应等生物进程;细胞器、细胞、细胞外区域等细胞组成;分子间相互捆绑及应激等分子功能,见图2。并且在亚细胞结构定位也主要集中于细胞外基质、细胞质和细胞核,见图3。差异表达蛋白在COG/KOG功能分类中的分布集中于细胞骨架、翻译后修饰及信号转导等,见图4。

图2 差异表达蛋白在GO二级分类中统计分布图
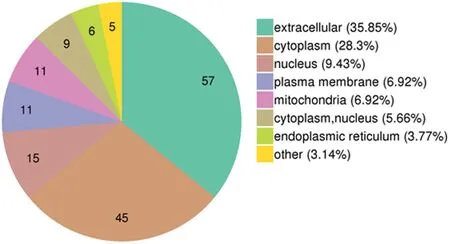
图3 差异表达蛋白的亚细胞结构定位分布图
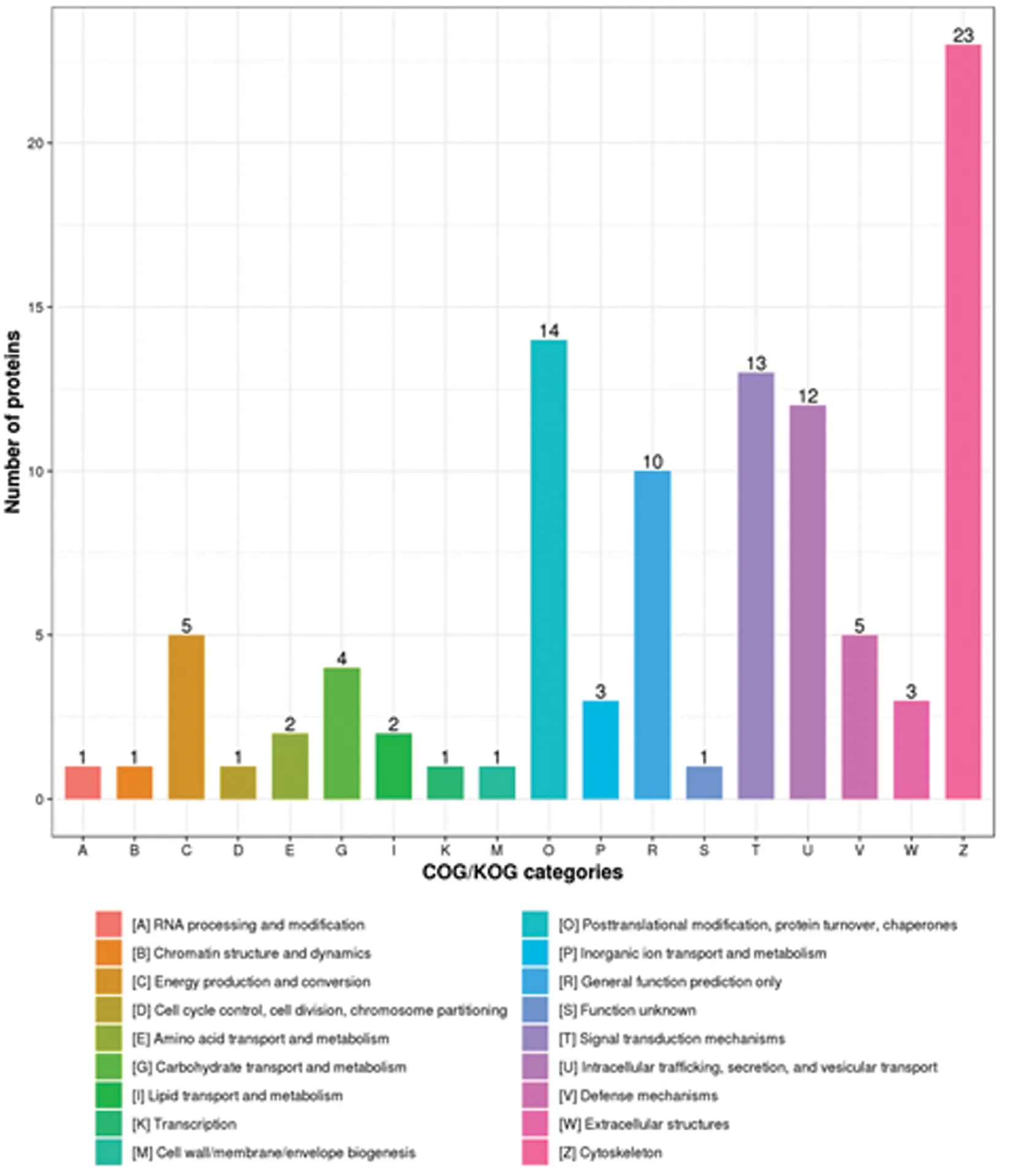
图4 差异表达蛋白的COG/KOG功能分类分布图
2.3差异表达蛋白KEGG通路分析 通过2.2鉴定出的全体蛋白及筛选出的差异表达蛋白,将差异蛋白进行KEGG通路的富集分析,见图5。差异蛋白主要集中于凝血与补体级联反应、胆固醇代谢及沙门氏菌感染等信号通路。
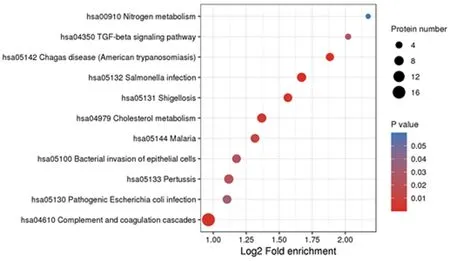
注:圆圈大小代表富集程度。
图5差异表达蛋白在KEGG通路中富集分布气泡图
3 讨 论
研究发现包括细胞质蛋白、膜蛋白、高尔基体相关蛋白和内质网相关蛋白在内的超过4 600种蛋白质与外泌体有关[7-8]。外泌体中最常被鉴定的蛋白质有膜转运蛋白、融合蛋白、热休克蛋白、四跨膜蛋白超家族成员tetraspanins,多泡体生物合成相关蛋白、细胞骨架蛋白等[9-10],同时外泌体中也存在着与代谢相关的酶类、信号转导蛋白、载体蛋白和组织相容性抗原[11]。近年来越来越多的研究发现,外泌体中的蛋白能够作为生物靶点[12],并且检测蛋白表达也可以反映疾病进程[13]。对血浆外泌体蛋白质的分析为T1DM的组织学研究提供补充,也为临床筛选出T1DM用于诊断、预后及分型的分子靶点做出了贡献。
近年来,高效液相色谱-质谱联用这一技术的使用让定量蛋白质组学取得了长足进步,也加速了科学家对于外泌体的了解,更为筛选外泌体来源的分子靶点提供了新的方向。本研究一共鉴定到1 146个蛋白质,其中948个蛋白质包含定量信息。本课题组发现,相较于对照组,T1DM患者血浆外泌体中有37个蛋白表达发生上调,122个蛋白表达发生下调。
首先,本课题组对差异表达蛋白进行了功能分类,发现这些差异表达的蛋白质广泛参与了各个生物进程,并且定位于多个亚细胞结构中。另外,这些蛋白在细胞内发挥着不同的功能,参与到各种分子信号通路中。为检测差异表达蛋白在某些功能类型上富集趋势的显著性,本课题组对这些差异表达蛋白进行KEGG通路富集分析。KEGG途径包括代谢、遗传信息处理、环境信息处理、细胞过程、人类疾病、药物开发等,是探索已知分子间相互作用的桥梁[14]。研究发现,差异蛋白主要集中于凝血与补体级联反应、胆固醇代谢及沙门氏菌感染等信号通路。这与T1DM发病机制方面的研究相符合。目前,关于T1DM发病机制的研究主要集中于自身免疫系统缺陷、遗传因素及病毒感染等[15]。
4 结 论
本研究为进一步阐明T1DM发病机制提供了参考方向,并为T1DM的早期诊断提供了一些新的候选分子。

