CDCA3在食管癌中的表达及其对食管癌细胞增殖与凋亡的影响
方 兰,卢一艳△,刘金楠
(1.航天中心医院病理科,北京 100049;2.中国人民解放军总医院病理科,北京 100039)
食管癌是全球肿瘤相关死亡的第六大原因,在男性中为第三常见肿瘤,女性中第五常见。统计数据显示,全球2018年食管癌死亡病例为51万左右,我国食管癌病例死亡人数占全球一半以上,是我国男性和女性肿瘤相关死亡的第三大主要原因[1-2]。目前食管癌的治疗包括手术、放疗和化疗等手段,三者的联合治疗具有一定的疗效,但是患者预后仍然较差[3]。因此,研究影响食管癌发生、发展中的潜在分子机制,对寻找食管癌治疗候选靶点、开发靶向药物、改善患者预后具有重大意义。细胞周期相关因子(CDCA3)是促使细胞进行有丝分裂的始动因子,在多种肿瘤组织中表达增加,参与肿瘤恶性疾病的进展[4-7]。SU等[8]采用生物信息学分析发现CDCA3为食管癌中差异表达基因之一,然而CDCA3在食管癌中的具体作用目前仍不明确。本研究分析了CDCA3在食管癌组织和细胞中的表达,并分析了CDCA3对食管癌细胞增殖和凋亡的影响及其可能的作用机制,现作如下报道。
1 材料与方法
1.1一般资料 收集2016年1月至2018年1月入住航天中心医院行首次手术切除的食管癌患者的癌组织及其配对的癌旁组织标本各50例。纳入研究的患者术前未接受包括放化疗等任何形式的抗肿瘤治疗,经病理专家证实为食管癌,所有患者均签署知情同意书,所有操作均符合航天中心医院伦理委员会规定。
1.2细胞、试剂与仪器 食管癌细胞系Eca109、Kyse-170、TE1和人食管鳞状上皮细胞Het-1A均购自美国ATCC细胞库;RPMI1640培养基、FBS和0.25%胰蛋白酶购自美国Gibco公司;RNA提取试剂RNAiso Plus、PrimeScriptTMRT reagent Kit反转录试剂盒和SYBR Premix Ex TaqTMqRT-PCR试剂盒均购自日本Takara公司;CDCA3、内参GAPDH引物由上海捷瑞生物工程有限公司合成;转染试剂脂质体Lipofectamine 2000为赛默飞世尔科技公司产品;CDCA3 siRNA由上海吉凯有限公司设计;MTS试剂盒购自美国Biovision公司;细胞周期及细胞凋亡Annexin Ⅴ-FITC /PI检测试剂盒均购自上海碧云天生物技术有限公司;蛋白RIPA裂解液购自美国Solarbio公司。CDCA3、CyclinD1和clevead caspase-3兔多克隆抗体购自英国Abcam公司,Mastercycler Ep Realplex qRT-PCR仪购自德国Eppendorf公司;Multiskan MK3型酶标仪购自美国Thermo Fisher Scientific公司;倒置显微镜购自日本Olympus公司;BDFACS Calibur 流式细胞仪购自美国Becton Dickinson公司;Mini-PROTEAN Tetra电泳仪购自美国Bio-Rad公司。
1.3方法
1.3.1实时荧光定量PCR(qPCR)检测食管癌组织和细胞中CDCA3 mRNA的表达 采用RNA提取试剂RNAiso Plus提取组织和细胞中的总RNA,测定RNA浓度及纯度(以A260/A280进行判断)后,根据反转录试剂盒中的操作指南将总RNA反转录为cDNA,以cDNA为模板进行PCR扩增,以GAPDH为内参,GAPDH上游引物5′-ACA ACT TTG GTA TCG TGG AAG G-3′,下游引物5′-GCC ATC ACG CCA CAG TTT C-3′,CDCA3上游引物5′-AAG AGC GTC CCA GTC ACA C-3′,下游引物5′-CCA GCA CTA GGT GAA CGG G-3′;反应条件:95 ℃预变性5 s,95 ℃变性5 s、60 ℃退火30 s,共40个循环。采用2-ΔΔCt法计算CDCA3 mRNA的相对表达水平。实验重复3次,取平均值。
1.3.2细胞培养及转染 Eca109、Kyse-170、TE1和Het-1A细胞均接种于含10%FBS的RPMI1640培养基中,培养在37 ℃、5%CO2培养箱中,待细胞融合度为90%时传代。Eca109、TE1细胞生长至对数期时,胰酶消化以2×105个/孔接种于6孔板中,按照转染说明书将siRNAs和si-NC转染至细胞中,细胞转染48 h后采用qPCR验证siRNAs沉默效果。对照序列(si-NC序列):5′-UUC UCC GAA CGU GUC ACG UTT-3′。si-CDCA3-1序列:5′-GCA AUA GAU GGA AAC CAA ATT-3′;si-CDCA3-2序列:5′-GCU CUC CUA CUC UUG GUA UTT-3′;si-CDCA3-3序列:5′- GAG UGA AGU AUU UGA AAC UTT-3′;选取沉默效果较好的两条si-CDCA3序列进行后续实验。
1.3.3MTS增殖实验 Eca109、TE1细胞生长至对数期时,胰酶消化以3 000个/孔接种于96孔板中,每组有6个平行孔,按照转染说明书将转染沉默效果较好的两条si-CDCA3转染至细胞中,继续培养72 h,弃掉培养基,每孔加入100 μL新鲜培养基和20 μL MTS工作液,细胞培养箱孵育2 h后,全波长扫描仪测取每个样品在490 nm波长处测的吸光度(A)值,细胞增殖抑制率=(A实验组-A对照组)/A对照组×100%。
1.3.4流式细胞仪检测细胞周期和凋亡情况 (1)细胞周期:收集转染si-CDCA3 48 h的Eca109、TE1细胞,PBS洗3次后,加入预冷的75%的乙醇固定2~24 h,以每管1×106个细胞,加入500 μL Binding Buffer、25 μL PI和10 μL RNase A染液,混匀后避光室温孵育30 min。于流式细胞仪进行检测。(2)细胞凋亡:收集转染si-CDCA3 48 h的Eca109、TE1细胞,PBS洗3次后,以每管1×106个细胞,加入500 μL Binding Buffer、5 μL PI和5 μL Annexin Ⅴ-FITC染液,混匀后避光室温孵育15 min。PBS洗1次后,流式细胞仪检测并分析凋亡细胞数。
1.3.5Western blot检测蛋白表达 收集转染si-CDCA3 48 h的Eca109、TE1细胞,加入蛋白裂解液(含有100×的蛋白酶和磷酸酶抑制剂),超声充分裂解30 min,在低温下(4 ℃)以14 000 r/min的转速进行20 min的离心运动,获得细胞总蛋白,BCA法检测蛋白浓度,加入Loading Buffer煮沸,之后将蛋白经湿转移至聚偏二氟乙烯(PVDF)膜上,在室温下采用8%脱脂牛奶进行封闭,2 h后采用TBST冲洗,加入目的基因一抗,在4 ℃的环境下孵育过夜,次日TBST洗3次,加入二抗,在室温下孵育1 h,ECL化学发光法曝光条带。采用Quantity One 5.0 软件进行分析,计算目的条带灰度值与GAPDH灰度值的比值。
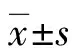
2 结 果
2.1CDCA3 mRNA在食管癌组织和细胞中的表达水平 食管癌组织中CDCA3 mRNA的相对表达水平为1.84±0.89,高于癌旁组织的1.07±0.57(P<0.05),见图1A。CDCA3 mRNA在食管癌细胞系Eca109、Kyse-170、TE1中的表达水平分别为11.65±2.46、4.02±1.05、7.86±1.21,均高于在食管鳞状上皮细胞Het-1A中的表达水平(1.00±0.10,P<0.05)。Eca109和TE1细胞系中CDCA3 mRNA的表达水平高于Kyse-170细胞系(P<0.05),选CDCA3 mRNA高表达的Eca109和TE1细胞系进行后续实验,见图1B。
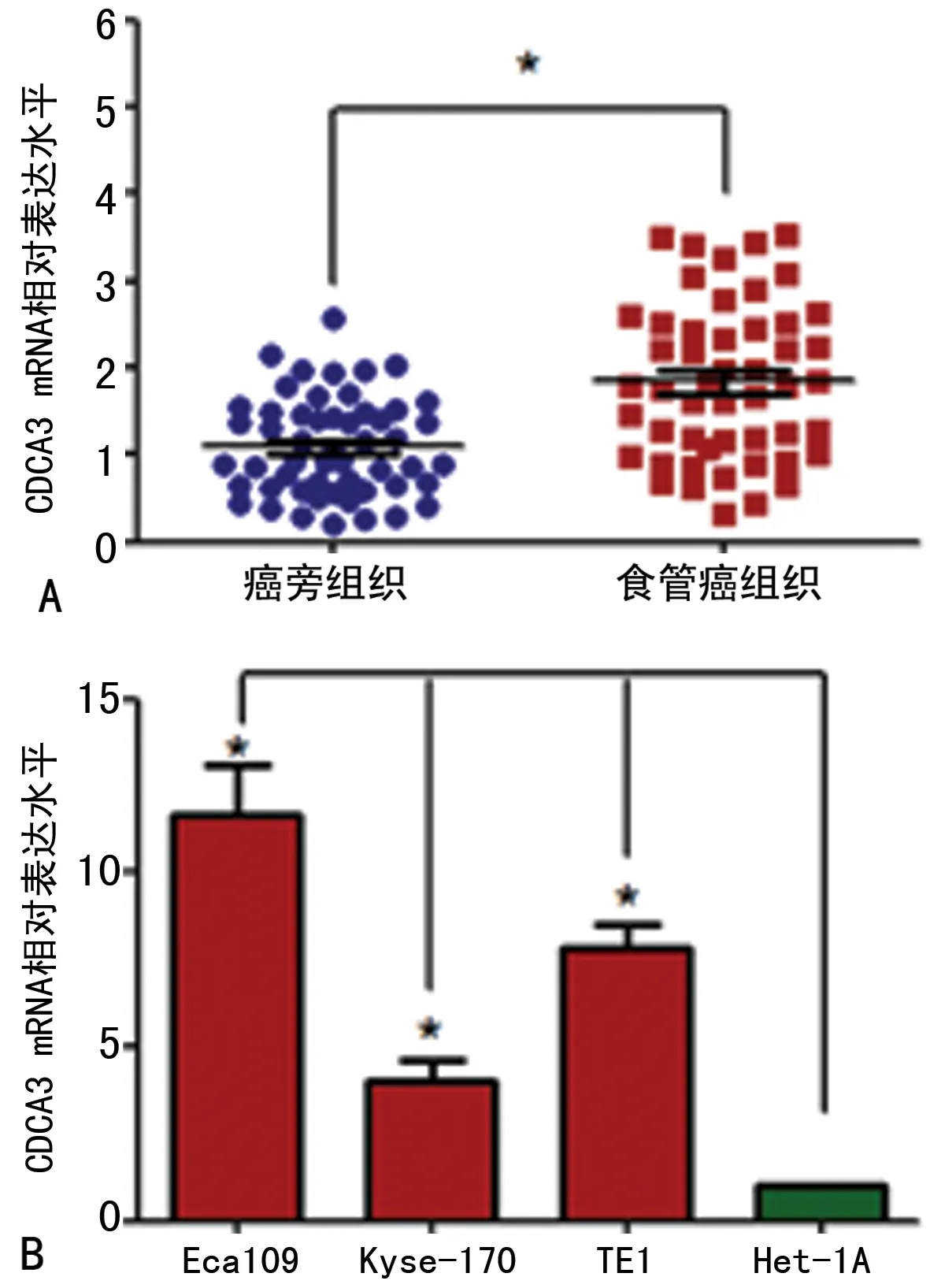
注:A为CDCA3 mRNA在食管癌组织和癌旁组织中的表达;B为CDCA3 mRNA在食管癌细胞系中的表达;组间比较,*P<0.05。
图1CDCA3mRNA的表达
2.2检测转染si-CDCA3的沉默效果 Eca109细胞转染si-NC、si-CDCA3-1、si-CDCA3-2和si-CDCA3-3后的CDCA3 mRNA表达水平分别为1.00±0.02、0.19±0.03、0.24±0.08和0.54±0.16,与si-NC相比,转染si-CDCA3-1、si-CDCA3-2和si-CDCA3-3后的细胞CDCA3 mRNA表达水平降低(P<0.05);TE1细胞转染si-NC、si-CDCA3-1、si-CDCA3-2和si-CDCA3-3后的CDCA3 mRNA表达水平分别为1.00±0.06、0.20±0.09、0.36±0.11和0.66±0.20,与si-NC相比,转染si-CDCA3-1、si-CDCA3-2和si-CDCA3-3后的细胞CDCA3 mRNA表达水平降低(P<0.05),见图2。后续实验采用si-CDCA3-1和si-CDCA3-2来沉默CDCA3的表达。

注:与转染si-NC的同系细胞比较,*P<0.05。
图2Eca109和TE1细胞转染si-CDCA3后CDCA3
mRNA的表达情况
2.3沉默CDCA3表达对食管癌细胞增殖的影响 Eca109细胞转染si-NC、si-CDCA3-1和si-CDCA3-2后的增殖率分别是(100.00±5.00)%、(36.00±5.29)%和(50.67±8.39)%,与si-NC相比,转染si-CDCA3-1和si-CDCA3-2的细胞增殖率降低(P<0.05);TE1细胞转染si-NC、si-CDCA3-1和si-CDCA3-2后的增殖率分别是(100.00±3.24)%、(38.67±5.51)%和(54.33±5.69)%,与si-NC相比,转染si-CDCA3-1和si-CDCA3-2后的细胞增殖率降低(P<0.05)。见图3。
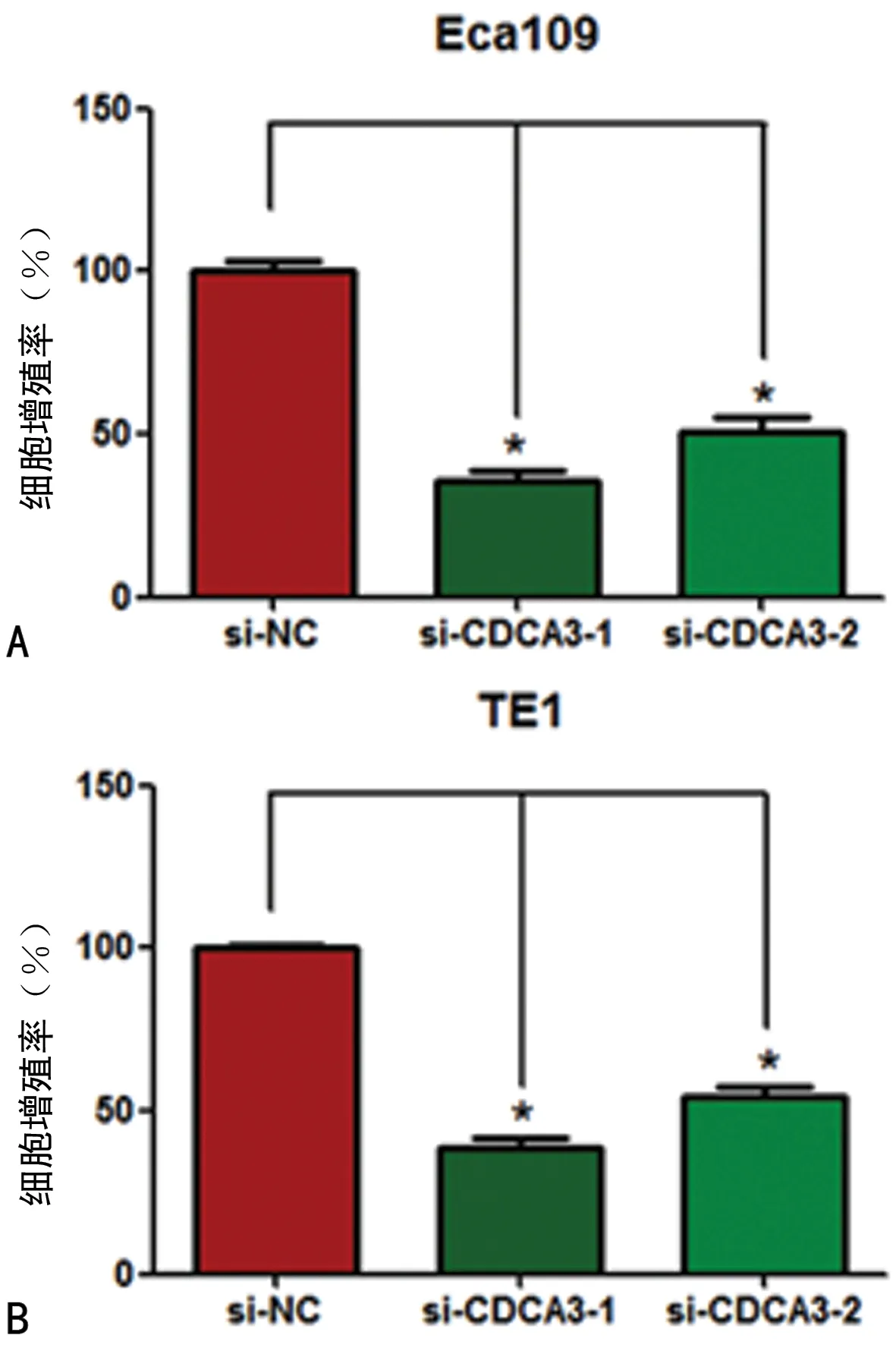
注:与si-NC比较,*P<0.05。
图3沉默CDCA3对Eca109和TE1细胞增殖的影响
2.4沉默CDCA3表达对食管癌细胞周期的影响 Eca109细胞转染si-NC、si-CDCA3-1和si-CDCA3-2后,G0/G1期细胞比例分别是(56.12±1.05)%、(61.00±0.53)%和(59.90±0.66)%,与si-NC相比,转染si-CDCA3-1和si-CDCA3-2细胞的G0/G1期细胞比例增加(P<0.05);TE1细胞转染si-NC、si-CDCA3-1和si-CDCA3-2后的G0/G1期细胞比例分别是(68.10±2.05)%、(78.45±0.28)%和(76.11±1.20)%,与si-NC相比,转染si-CDCA3-1和si-CDCA3-2后的细胞G0/G1期细胞比例增加(P<0.05)。见图4。

注:与si-NC比较,*P<0.05。
图4沉默CDCA3表达对Eca109和TE1细胞周期的影响
2.5沉默CDCA3表达对食管癌细胞凋亡的影响 Eca109细胞转染si-NC、si-CDCA3-1和si-CDCA3-2后的凋亡率分别是(0.25±2.67)%、(26.33±1.19)%和(14.07±1.59)%,与si-NC相比,转染si-CDCA3-1和si-CDCA3-2细胞的凋亡率增加(P<0.05);TE1细胞转染si-NC、si-CDCA3-1和si-CDCA3-2后的凋亡率分别是(2.17±0.317)%、(38.00±2.65)%和(21.00±2.00)%,与si-NC相比,转染si-CDCA3-1和si-CDCA3-2细胞的凋亡率增加(P<0.05)。见图5。

注:与si-NC比较,*P<0.05。

图5 沉默CDCA3表达对Eca109和TE1细胞凋亡的影响
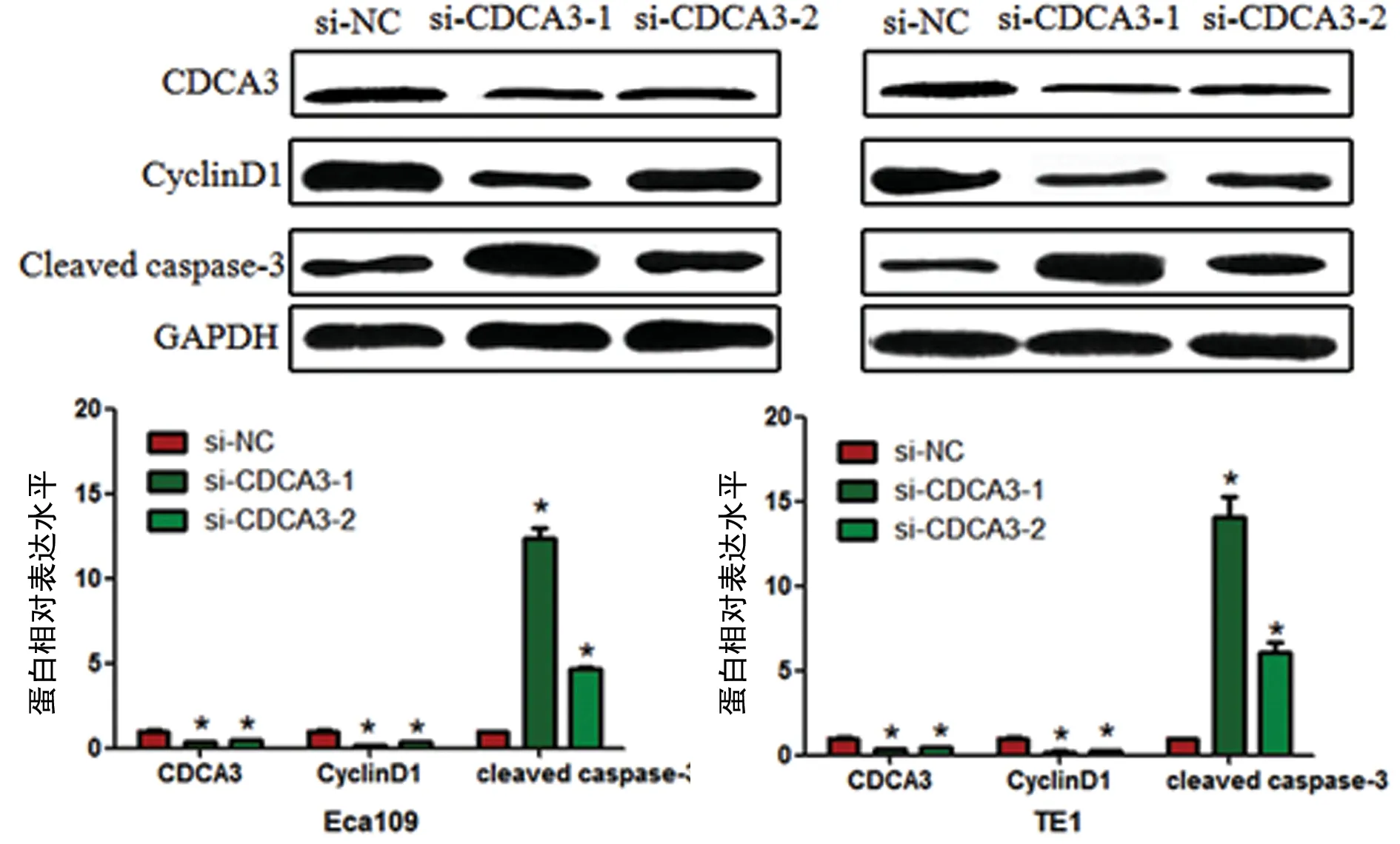
注:与si-NC比较,*P<0.05。
图6沉默CDCA3表达对Eca109和TE1细胞CyclinD1、cleavedcaspase-3蛋白表达的影响
2.6沉默CDCA3表达对CyclinD1、cleaved caspase-3蛋白的影响 为进一步探讨CDCA3表达对食管癌细胞增殖和凋亡作用的机制,检测沉默CDCA3表达对CyclinD1、cleaved caspase-3的影响。Western-blot检测发现,与转染si-NC的细胞相比,转染si-CDCA3-1和si-CDCA3-2细胞中CDCA3蛋白表达水平降低(P<0.05)。沉默CDCA3后,Eca109和TE1细胞中CyclinD1蛋白表达减少,而cleaved caspase-3蛋白表达增加(P<0.05)。见图6、表1。
3 讨 论
肿瘤是疾病相关死亡的主要原因,而我国恶性肿瘤的发病率和病死率均居世界首位,近年来随着生活节奏的加快、工作压力的增加等外在环境因素及肿瘤异质性内在因素,使得肿瘤的发病率和病死率呈现上升趋势[9-10]。食管癌是恶性程度较高的肿瘤,由于早期症状的隐匿性,确诊时通常为晚期,患者预后较差。近年来靶向治疗为食管癌的治疗提供了新的思路,该方向也成为临床研究的重点[11-12]。恶性肿瘤的发生比较复杂,癌基因激活和抑癌基因失活产生的基因功能紊乱,是肿瘤发生、发展的重要因素[13-14]。不良的饮食习惯、吸烟等因素引起基因变异导致调控失常,促进食管癌的发生、发展,因此从基因分子水平探究诊治食管癌的新方向,已成为食管癌领域的研究热点[15-16]。
细胞的生长在于细胞的分裂,细胞分裂的失控导致细胞增殖异常是恶性肿瘤细胞的共同特征,细胞周期的进程取决于复杂的周期相关蛋白调节网络,研究已经证实周期相关蛋白分子与肿瘤的发生密切相关,靶向周期相关蛋白阻止细胞周期的进程可以显著抑制肿瘤的增殖能力,可能是改善患者疗效的潜在靶点[17]。细胞周期分裂相关蛋白家族成员CDCA3,被称为进入有丝分裂的“触发因子”,CDCA3作为S期激酶相关蛋白1(SKP1)/淘汰素(Cullin1)/F-box(SCF)E3泛素连接酶复合物的一部分,介导有丝分裂抑制激酶wee1的降解,从而介导细胞周期的进展[18]。本研究显示,在食管癌组织以及细胞系中CDCA3 mRNA的表达均高于癌旁组织以及正常人食管鳞状上皮细胞。研究报道,CDCA3 mRNA在乳腺癌组织中的表达水平显著高于对照组,并显著降低了患者的存活率[4];非小细胞肺癌组织和细胞中CDCA3的表达水平均高于对照组[5];生物信息学分析CDCA3在食管癌中表达上调[8]。此外,通过进一步研究发现,沉默CDCA3的表达可抑制食管癌细胞Eca109、TE1的增殖且使细胞阻滞于G0/G1期。ZHANG等[6]研究发现在胃癌细胞BGC823中敲低CDCA3的表达抑制细胞增殖、集落形成和体内移植瘤的生长,诱导细胞G0/G1期的阻滞;QIAN等[7]同样报道在结肠癌细胞SW480中敲减CDCA3的表达,在体内和体外均抑制细胞增殖,机制为细胞周期G1到S期的转换停滞,与本研究结果一致,但是ADAMS等[5]研究在非小细胞肺癌中抑制CDCA3的表达通过将细胞阻滞在G2/M期发挥抑制细胞增殖的作用,表明CDCA3在不同的恶性肿瘤中发挥的调控作用机制可能不同。细胞凋亡是正常生命现象,细胞凋亡异常同样导致恶性肿瘤的发生,肿瘤的化疗、放疗等治疗中均涉及细胞凋亡的激活,因此细胞凋亡在肿瘤治疗中具有重要作用[19-20]。已有研究报道在非小细胞肺癌中CDCA3的缺失可诱导细胞的凋亡[5],而CDCA3是否参与食管癌的细胞凋亡尚不清楚。本研究显示,沉默CDCA3表达后,凋亡细胞增多,表明CDCA3参与食管癌细胞的凋亡。
本研究已经发现CDCA3调控食管癌细胞增殖和凋亡,但是具体的作用机制仍需进一步研究。本研究采用Western blot检测CDCA3沉默后,Eca109、TE1细胞中CyclinD1的表达降低。CyclinD1是细胞周期的正性调控因子,通过促进Rb的磷酸化,使pRb-E2F复合物解离,E2F促使DNA合成相关基因的转录,启动G1期DNA的复制进入S期,CyclinD1表达减少时,细胞周期阻滞在G1期[21],本研究结果提示CDCA3高表达可能通过增加CyclinD1蛋白的表达促进食管癌增殖。细胞凋亡涉及一系列的蛋白改变,凋亡发生的重要标志为Caspase蛋白家族的激活,其中Caspase3蛋白是细胞凋亡的执行分子,其被切割为cleaved caspase-3后可导致下游蛋白级联激活反应,是细胞凋亡不可逆的标志[22]。而沉默CDCA3的表达后,Eca109、TE1细胞中cleaved caspase-3的表达增加,提示CDCA3高表达可能通过抑制Caspase3蛋白的表达抑制食管癌细胞凋亡。
综上所述,CDCA3在食管癌组织和细胞中表达均增加,在食管癌细胞中沉默CDCA3的表达可抑制细胞增殖、诱导G0/G1期细胞阻滞,并可以对细胞凋亡产生促进作用,其机制可能是调控cyclinD1、cleaved caspase-3蛋白的表达。CDCA3可能是食管癌治疗的潜在分子靶点。本文未对CDCA3的表达与患者预后生存期进行分析,这将在今后研究中进一步探索。
4 结 论
本文首次报道CDCA3在食管癌中高表达,发挥促癌基因的功能。抑制CDCA3的表达可能通过调控周期蛋白和凋亡蛋白抑制食管癌细胞的增殖。CDCA3可能成为治疗食管癌新的治疗靶点。

