常压室温等离子体诱变选育高产核黄素枯草芽孢杆菌
郭佳欣,张培基,刘丁玉,洪坤强,陈涛,王智文*
1(天津大学 化工学院,天津, 300350)2(系统生物工程教育部重点实验室,天津, 300350)3(合成生物学前沿科学中心,天津, 300350)4(天津化学化工协同创新中心合成生物学平台,天津, 300350)
核黄素是一种与生物生长紧密相关的物质,参与细胞的氧化还原和新陈代谢,与核酸、蛋白质以及脂肪的代谢有关,维护细胞功能的正常运行[1-2]。在医药与饲料领域有着广泛的应用[3-7]。
常压室温等离子体(atmospheric and room temperature plasma,ARTP) 诱变技术作为一种近年来新兴的高效诱变手段,具有突变谱广、安全性高、操作快速简单、成本低、环境友好等优点[8]。该方法在工业诱变育种中具有极大的应用潜力,ARTP诱变已经成功地应用于多种细菌和真菌,还应用在植物、藻类上,在促进细胞生长和细胞生物量的生产,提高酶活性,提高各种化学品产量等方面均有成功展示[9]。
诱变选育是提高核黄素产量的有效策略,但经过多轮突变和筛选后产量会达到瓶颈[10]。为了获得更具有工业竞争力的核黄素高产菌,除了人工诱变外,代谢工程选育高产菌株也是重要的发展方向。最近,SHI等[11]通过过表达核黄素操纵子,解调嘌呤合成途径转录水平和解除关键酶反馈抑制作用,改善嘌呤核苷酸的供应,得到了1株核黄素高产菌,产量较出发菌提升了3倍。BUEY等[12]通过过表达核苷酸生物合成的关键酶IMP脱氢酶,促进GTP的积累,使1株棉囊阿舒氏酵母菌的核黄素产量提升了40%。
本科研组前期通过随机诱变、基因组重排和代谢工程等手段构建了一系列核黄素突变菌株,但是突变株存在生长缓慢、菌体浓度低、遗传背景不清晰以及遗传操作困难等问题。WANG等对B.subtilis24进行了全基因组测序和逆向代谢工程重构了1株遗传背景清晰的重构菌枯草芽孢杆菌BS120,核黄素产量达到(1.85±0.03) g/L[13]。本研究进一步对BS120进行ARTP等离子诱变,筛选遗传稳定的核黄素高产突变菌株,为探讨核黄素高产的调控机制奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株或质粒
核黄素生产菌BS120、核黄素操纵子质粒pMX45,保藏于天津大学代谢工程与系统生物学实验室。
1.1.2 培养基
Spizizen基本培养基(g/L):葡萄糖 8,(NH4)2SO40.2,KH2PO41.31,Na2HPO40.6,MgSO4·7H2O 0.2,柠檬酸三钠二水 0.25,谷氨酰胺 2,色氨酸 0.05,VB1溶液 0.01,1 000×微量元素溶液 1 mL。
LB液体培养基(g/L):胰蛋白胨 10,酵母提取物 5和NaCl 10,pH 7.0。固体培养基加2%(质量分数)琼脂。
96深孔板筛选培养基(g/L):葡萄糖 40,酵母粉 8,尿素 2,K2HPO40.5,KH2PO40.5,MgSO40.5,pH 7.0。
发酵培养基(g/L):葡萄糖 100,酵母粉 20,尿素 2,K2HPO40.5,KH2PO40.5,MgSO40.5,pH=7.0。
基本盐培养基(g/L):葡萄糖40,(NH4)2SO42,KH2PO413.1,Na2HPO46,柠檬酸三钠二水1.2,MgSO4·7H2O 2.5,色氨酸0.05,1 000×微量元素500 μL。
1.1.3 主要试剂
酵母粉 YP601,安琪酵母股份有限公司;寡霉素、8-氮鸟嘌呤,大连美仑生物技术有限公司;D-(+)-葡萄糖,上海生工生物工程有限公司;胰蛋白胨、酵母抽提物、红霉素,BBI生命科学有限公司。
1.1.4 仪器与设备
ARTP-IIS诱变系统,北京思清源有限公司;TU-1901紫外分光光度计,北京谱析通用仪器公司;MULTIPLEX1R32R大型离心机,赛默飞世尔科技公司;SBA-40C生物传感分析仪,山东省科学院生物研究所;BIOMETRAPCR仪,Tpersonal。
1.2 实验方法
1.2.1 ARTP诱变
挑取单菌落至基本盐液体培养基中,37 ℃、220 r/min条件下培养至OD600为2.0~3.0,离心收集菌体,用PBS缓冲液洗涤2次后,重悬菌体制成菌悬液备用。ARTP诱变条件为100 W、10 SLM、2 mm。吸取10 μL菌悬液均匀涂布至无菌载片上,诱变时间为20~60 s,诱变后的菌液加到4.99 mL PBS缓冲液的EP管中,振荡混匀,取100 μL菌液涂布于Spizizen培养基固体平板,37 ℃恒温培养至单菌落长出。绘制致死曲线,选择出合适的诱变时间。
致死率计算如公式(1)所示[14]为:

(1)
1.2.2 筛选拮抗物最小抑制浓度(minimum inhibitory concentration,MIC)的测定
将出发菌株的菌悬液经适度稀释,取100 μL涂布在含有20~50 mg/L 8-氮鸟嘌呤或100~300 mg/L寡霉素的Spizizen基本盐培养基平板上,37 ℃倒置培养48~72 h,以不含筛选拮抗物平板上菌体的生长状况为对照,观察并记录未长出菌落的筛选拮抗物的最低浓度,即为该筛选拮抗物的MIC[15],然后按MIC作为添加水平制作相应的筛选拮抗物筛选平板。
1.2.3 诱变菌株的初筛和复筛
取100 μL诱变后菌液涂布于含有相应筛选拮抗物MIC浓度的筛选平板,37 ℃恒温培养12~16 h。挑取诱变的单菌落,对点到Spizizen基本盐固体平板上,37 ℃,24~48 h。初筛后,挑取核黄素产量显著提高的突变单菌落接种到5 mL液体LB试管中,37 ℃静置过夜培养。取1 mL菌液接种至50 mL LB液体培养基的250 mL三角瓶中,220 r/min、37 ℃振荡培养12 h,获得一级种子。吸取适量的一级种子接种至100 mL发酵培养基的500 mL三角瓶中,初始OD为0.05,41 ℃、220 r/min振荡培养96~120 h,测定核黄素的产量、残糖,筛选出核黄素高产突变菌株。
1.2.4 发酵产物测定
1.2.4.1 核黄素浓度的测定
本实验中核黄素浓度测定是通过紫外分光光度计测量OD444,有效范围为0.3~0.8。使用0.5 mol/L NaOH溶液进行溶解稀释,再用乙酸-乙酸钠溶液稀释并中和NaOH溶液,13000 r/min离心2 min沉淀固体杂质,测量上清液吸光度。
核黄素质量浓度核算[16]如公式(2)所示:
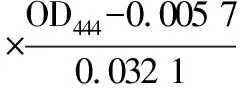
(2)
1.2.4.2 残糖的测定
发酵过程中葡萄糖是利用生物传感分析仪进行测定[16]。
1.2.5 核黄素操纵子质粒转化
本实验使用化学转化法,即枯草芽孢杆菌的Spizizen转化法[16]向枯草芽孢杆菌BSG3中转化核黄素操纵子质粒pMX45。
1.2.6 遗传稳定性分析
挑取单菌落至5 mL LB液体培养基,37 ℃培养12 h后,取100 μL菌液至另一支4.9 mL LB液体培养基试管,相同条件下重复转接20次。根据公式计算代时得到一次转接为6代,对第0、30、60、90、120代进行摇瓶发酵,测定核黄素浓度。
1.2.7 数据处理
实验结果为3次独立实验的平均值,用平均值和标准偏差表示。采用单因素方差分析法进行统计学分析,用Origin 8.1软件进行作图。
2 结果与分析
2.1 最佳ARTP诱变时间的选择
在诱变处理时,对出发菌株BS120进行20、30、40、50、60 s诱变处理,并绘制致死率曲线(图1-A)。当照射时间为30 s时,致死率达到45.02%; 照射时间为40 s时,致死率达到了91.30%。进一步测定35~40 s诱变后的致死率,对出发菌株BS120进行35、36、37、38、39 s诱变处理,并绘制致死率曲线(图1-B)。诱变的致死率约为90%时,筛选到目标突变菌株的可能性最大[17],所以选择37s作为诱变时间。

A-诱变处理时间0、20、30、40、50、60 s;B-诱变处理时间35、36、37、38、39 s图1 枯草芽孢杆菌致死曲线Fig.1 Lethal curve of Bacillus subtilis
2.2 诱变菌株的筛选与发酵验证
2.2.1 8-氮鸟嘌呤为拮抗物的突变株筛选
8-氮鸟嘌呤(8-azaguanine)作为核黄素合成途径中核黄素前体物鸟三磷(guanosinetriposophate,GTP)的结构类似物可以阻断磷酸核糖焦磷酸合成酶(pho-sphoribosyl-pyrophosphate synthetase,PRPS)对GTP的反馈抑制作用[18-19],从而大量积累GTP进而有效促进核黄素的合成,增加核黄素的产量[20-21]。
为了测定8-氮鸟嘌呤对出发菌株BS120的MIC,将BS120菌悬液稀释至菌体浓度为1×105个/mL涂布在添加了8-氮鸟嘌呤的Spizizen培养基中,37 ℃培养24 h,对平板上生长的菌落进行计数(表1)。
由表1可知, 8-氮鸟嘌呤的MIC为40 mg/L。将对BS120经ARTP诱变37 s后的菌液涂布于添加了40 mg/L 8-氮鸟嘌呤筛选平板,37 ℃,24~48 h,经过96孔板初筛后对产量较高的9株菌株进行摇瓶复筛(图2)。其中编号为1-3-28的菌株摇瓶发酵96 h核黄素产量为(2 996.68±30.66) mg/L,得率为(30.52±1.18) mg/g葡萄糖,较BS120分别提高61.60%和58.12%,命名为BSG1。
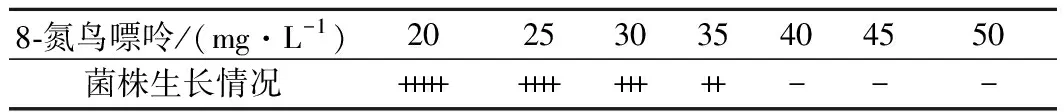
表1 出发菌株BS120对8-氮鸟嘌呤敏感性Table 1 8-azaguanine resistance of BS120
注: “+++++”代表每板菌落数目超过104;“++++”代表菌落数目在103~104;“+++”代表菌落数目在102~103;“++”代表菌落数目在10~100;“+”代表菌落数目稀少,在10以内;“-”代表无菌落生长(下同)
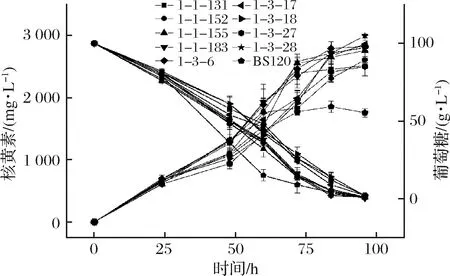
图2 8-氮鸟嘌呤为拮抗物的突变株摇瓶复筛结果Fig.2 Screening results of 8-azaguanine mutant strains
2.2.2 寡霉素筛选诱变菌株
寡霉素(oligomycin)作为细胞氧化磷酸化酶的抑制剂[22-23]。也可以促进呼吸链中黄素辅酶的需求量,进而促进核黄素的生物合成,提高胞内核黄素的含量[24]。为了测定寡霉素对出发菌株BSG1的MIC,将BSG1菌悬液稀释至菌体浓度为1×105个/mL涂布在含寡霉素的Spizizen培养基中,37 ℃,24 h,对平板上生长的菌落进行计数(表2)。
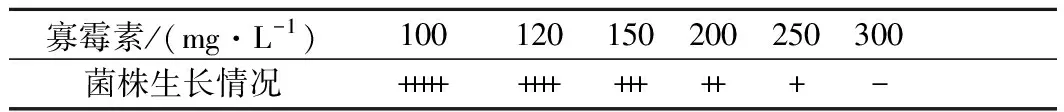
表2 出发菌株BSG1对寡霉素敏感性Table 2 Oligomycin resistance of BSG1
由表2可知,寡霉素的MIC为300 mg/L,将诱变的菌株涂布于含有300 mg/L寡霉素筛选平板,经过96孔板初筛后选取产量较高的11株菌株进行摇瓶复筛(图3)。其中编号为2-3-19的菌株摇瓶发酵96 h 核黄素产量为(3 403.76±55.96) mg/L,得率为(34.50±0.47) mg/g葡萄糖,较亲株BSG1分别提升13.58%和11.54%,命名为BSG3。
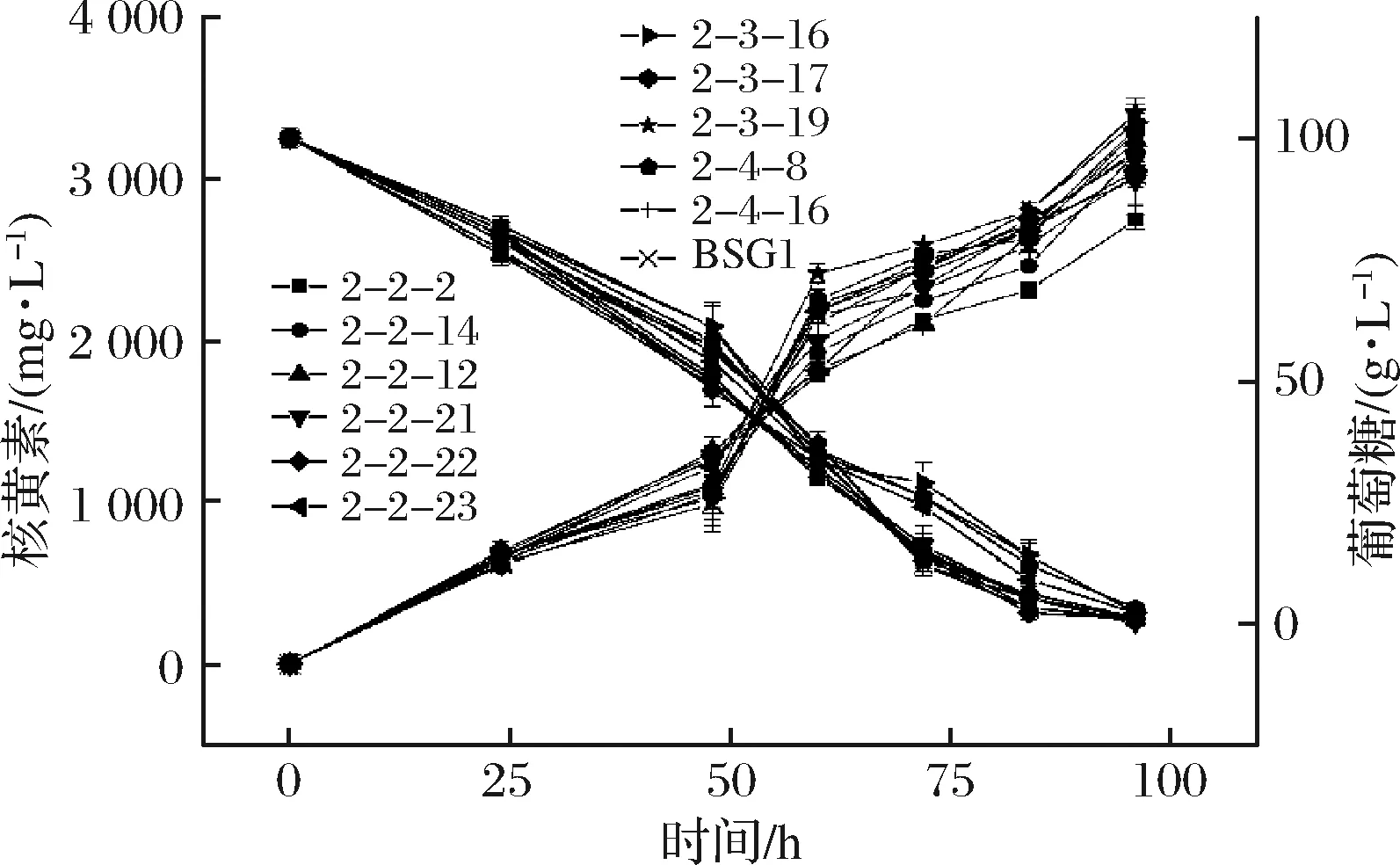
图3 寡霉素诱变菌株摇瓶复筛结果Fig.3 Screening results of oligomycin mutant strains
2.3 核黄素操纵子的过表达提高核黄素产量
核黄素操纵子过表达质粒pMX45是约28 kb的低拷贝数质粒,包含核黄素操纵子的EcoRI 酶切染色体片段(10 kb)和18 kb的载体两部分组成[25]。将其转入BSG3中以期为进一步提高核黄素产量,并同时对BSG5及BS120,BSG1,BSG3进行发酵验证(图4)。
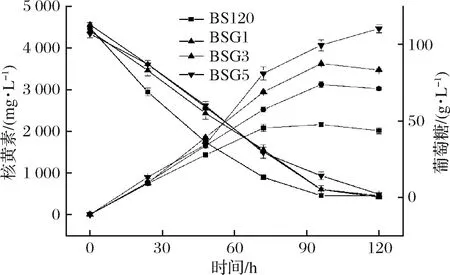
图4 BS120,BSG1,BSG3和BSG5发酵验证Fig.4 Validation fermentationof BS120, BSG1, BSG3and BSG5
由图4可知,BSG5在摇瓶发酵120 h核黄素产量可达到(4 467.08±99.47) mg/L,得率为(42.56±1.25) mg/g葡萄糖,较BSG3提升分别为31.24%和23.36%。质粒pMX45的导入促进核黄素产量得到了显著提升。
2.4 突变菌株生长与核黄素合成能力
分别检测了亲本菌株和3株突变株的生长情况(图5)。出发菌株BS120和BSG1,BSG3生长规律基本相同,而BSG5生长相对滞后。原因可能是导入的pMX45质粒较长,造成菌株生长代谢负担加重,菌株生长变慢。

图5 BS120,BSG1,BSG3和BSG5生长曲线图Fig.5 Growth curve of BS120, BSG1, BSG3 and BSG5
随后,对4株菌分别进行发酵表征,每隔12 h测定核黄素及残糖(图6)。

图6 BS120, BSG1, BSG3和BSG5发酵表征对比图Fig.6 Fermentation characterization of BS120, BSG1,BSG3 and BSG5
由图6可知,在基本盐培养基中,发酵到60 h时,4株菌株均基本停止耗糖。BSG5核黄素产量和得率达到(258.76±1.25) mg/L和(10.97±1.01) mg/g葡萄糖,较出发菌株BS120提升分别为92.73%和133.26%,优于BS120((134.26±2.69) mg/L和(4.69±0.19) mg/g葡萄糖)、BSG1((178.91±1.25) mg/L和(6.68±0.83) mg/g葡萄糖)及BSG3((194. 07±1.86) mg/L和(7.60±0.59) mg/g葡萄糖)。
2.5 突变菌株的遗传稳定性
诱变菌株在不断传代的过程中可能出现退化现象,导致发酵性能下降,因此需要测试诱变菌株的遗传稳定性。由图7中知,BSG1、BSG3和BSG5产量基本稳定,具有良好的遗传稳定性。
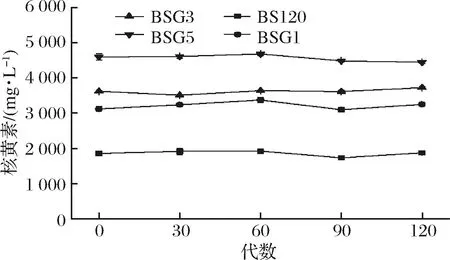
图7 BS120,BSG1,BSG3和BSG5遗传稳定性测试Fig.7 Genetic stability of BS120, BSG1, BSG3 and BSG5
3 结论与展望
本研究以BS120为出发菌株,依次使用8-氮鸟嘌呤和寡霉素作为筛选拮抗物,筛选到了核黄素产量显著提高的突变株,说明ARTP诱变与合适的拮抗物筛选技术,是人工合成诱变获得枯草芽孢杆菌高产突变株的有效手段。将来的工作可以围绕两方面进行展开:一方面,可以考虑选用其他与核黄素生产相关的结构类似物如玫瑰黄素、6-氯鸟嘌呤、别嘌呤[19]等作为筛选拮抗物进行诱变筛选,并结合具有更高筛选通量的的筛选技术,如流式细胞分选仪或者微流滴细胞分选仪[26],以胞内核黄素荧光信号强度为分选标记,通过迭代诱变筛选,获得生产性状更加优越的诱变菌种;另一方面,可以通过对诱变菌株的基因组、转录组以及蛋白质组的分析,深入理解突变菌株高产核黄素的遗传调控机理,通过逆向代谢工程构建高产核黄素菌株,获得到产量较高且遗传背景清晰的核黄素高产菌,为进一步阐释枯草芽孢杆菌产核黄素遗传基础,探讨核黄素高产的调控机制奠定基础。

