CuCo/BNNSs纳米催化剂对固态储氢材料氨硼烷水解的催化性能
翟佳欣 李国华 甘思平 张雪明 朱萌萌 张晓蕊 胡恩言
(河北工业大学化工学院,天津 300130)
0 引 言
氢被认为是最有前途的“零碳”清洁能源,从储层中释放氢气是储氢材料研究中的一个关键挑战问题[1]。氨硼烷由于其高氢含量(19.6%(w/w)),高稳定性和在水中的高溶解度(0.336 g·mL-1)而被认为是最有前途的固态化学储氢材料之一[2-4]。与热解释氢相比,AB水解释氢可以在室温下进行,并且1 mol AB可以释放多达3 mol的H2。然而,没有催化剂存在下AB的水解速率非常缓慢[5]。在Pt基等贵金属催化剂的存在下,可以实现较高的H2释放速率。由于成本因素限制了该类催化剂的推广使用[6-7]。从实际应用的观点来看,制备具有同样高催化性能的低成本非贵金属催化剂成为研究热点。
目前已经证明由2种非贵金属形成的复合体系在氨硼烷的水解释氢中具有比较优异的活性[8-10],但进一步提高催化活性和稳定性仍是难题。催化活性很大程度上取决于金属纳米粒子(NPs)的尺寸,粒径越小催化性能也越强[11]。然而与大颗粒相比,纳米尺寸的金属粒子容易形成附聚物[12],导致催化活性的丧失,因此增强其稳定性是关键。六方氮化硼纳米片(BNNSs)是一种新型的二维材料,具有较大的比表面积,能为金属纳米粒子的附着提供所需的柔性平滑表面,防止其团聚[13]。理论计算表明,过渡金属与BNNSs表面键合生成的N-pz-Metal-dz2反键杂化物(图1),能增强金属在 BNNSs 表面的稳定性[14-15]。在氨硼烷水解反应中纳米氮化硼还可缩短AB水解反应中的诱导时间,降低氢释放温度[16]。以上特性使得BNNSs成为优异的氨硼烷水解释氢催化剂载体材料。
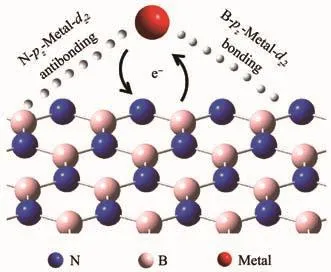
图1 h-BN与过渡金属表面键合示意图Fig.1 Bonding of h-BN to transition metal surfaces
我们采用PVP辅助离子插层法[17],高产率制备了少层BNNSs。通过室温共还原法制备了CuCo/BNNSs纳米催化剂,CuCo合金内部产生的电子协同效应以及BNNSs的载体效应使得CuCo/BNNSs双金属纳米催化剂对AB水解释氢具有与贵金属相似的催化活性。此外,通过向反应液中加入酸碱可以极大提高AB水解速率,在pH=14时Cu0.5Co0.5/BNNSs对室温下AB水解的TOF值极高。在碱性条件下对CuCo/BNNSs催化AB水解释氢机理进行了初步分析。
1 实验部分
1.1 试剂及仪器
六方氮化硼(h-BN,上海阿拉丁生化科技股份有限公司);氢氧化钠、盐酸(分析纯,天津市科密欧化学试剂有限公司);氯化锂、氯化钾、二水合氯化铜、六水合硝酸钴 (分析纯,上海笛柏生物科技有限公司);硼氢化钠、硼酸、氯化铵(分析纯,天津市江天化工技术有限公司);氨硼烷(纯度不低于97%,上海贤鼎生物科技有限公司);聚乙烯吡咯烷酮(纯度不低于99.0%,北京索莱宝科技有限公司)。
采用德国BRUKER公司NanoScope V型原子力显微镜(AFM)测试样品的厚度;采用德国布鲁克AXS有限公司D8(达芬奇设计)型X射线衍射仪(XRD)测试样品的微观结构,以Cu Kα辐射为射线源(λ=0.154 18 nm),工作电压为40 kV,电流为40 mA,扫描范围为2θ=5°~90°,扫描速率为12°·min-1;采用德国布鲁克公司VECTOR22型红外光谱仪(FTIR)测试样品的化学键,扫描范围为500~4 000 cm-1;采用日本HORIBA公司LabRAM HR Evolution型拉曼光谱仪(Raman)测试样品的Raman光谱,激光源为Ar+;采用美国赛默飞世尔科技有限公司ESCALAB 250Xi型X射线电子能谱仪(XPS)测试样品的价态,以Mg Kα射线为激发源(1 254.6 eV),以碳污染结合能为284.6 eV为基准进行结合能校正;采用美国FEI公司Nova Nano SEM450型扫描电子显微镜(SEM)测试样品形貌,工作电压为10 kV;高倍透射电镜图(HRTEM)在美国FEI公司Talos F200S型透射电子显微镜上进行,工作电压为200 kV,样品在微栅铜网上进行观测。
1.2 Cu0.5Co0.5/BNNSs复合材料的制备
1.2.1 氮化硼纳米片(BNNSs)的制备
将1.0 g h-BN粉末分散在200 mL去离子水中,加入PVP(300 mg),将混合物搅拌均匀,之后加入20 mg KCl和20 mg LiCl。然后将上述分散体转移至不锈钢水热釜的Teflon内衬中,在150℃下持续搅拌12 h。冷却至室温后超声分散1 h,分散液以2 500 r·min-1的转速离心 30 min,将上清液抽滤、洗涤、干燥得到BNNSs粉末。
1.2.2 Cu0.5Co0.5/BNNSs催化剂的制备
通过一步共还原法合成了一系列具有不同Cu和 Co 含量的 CuxCo1-x/BNNSs(x=0,0.1,0.3,0.5,0.7,0.9,1)纳米催化剂。Cu0.5Co0.5/BNNSs催化剂具体合成步骤如下:将100 mg BNNSs置于100 mL去离子水中,超声使其均匀分散,然后将CuCl2·2H2O(1 mL,0.1 mol·L-1)和 Co(NO3)2·6H2O(1 mL,0.1 mol·L-1)加入上述分散液室温下搅拌8 h。接着剧烈搅拌下将NaBH4(5 mL,50 mg)溶液快速加入至上述混合液,待无气泡产生后反应结束,经过滤、洗涤、干燥后得到灰绿色产物。为了比较催化活性,Cu0.5Co0.5NPs在无载体存在的条件下按上述方法制备,其中Cu和Co的含量与Cu0.5Co0.5/BNNSs中保持一致。
1.3 氨硼烷水解释氢实验
将35 mg催化剂与5 mL去离子水的混合液置于双颈圆底烧瓶中,超声使其分散(pH=7)。烧瓶一端连接量气管以测量气体体积,另一端用橡胶塞密封,将烧瓶在惰性气体保护下置于298 K的水浴中。磁力搅拌下将氨硼烷(3 mL,0.5 mol·L-1)通过橡胶塞注入反应烧瓶,氨硼烷水解制氢反应开始。每隔5 s观察量气管水位以记录释放氢气的体积。当不再观察到气体逸出时,反应完成。所有催化剂催化氨硼烷水解制氢反应的实验与上述实验方法相同。为了计算反应的活化能,Cu0.5Co0.5/BNNSs催化AB水解反应在不同温度(293、298、303、308 和 313 K)下进行。
2 结果与讨论
2.1 氮化硼纳米片的结构与形貌分析
PVP辅助离子插层法逐层剥离块状六方氮化硼机理如图2所示,离子插层产生的膨胀力和PVP的吸附拉力共同作用实现了BNNSs的高效剥离。图3a为原始h-BN与 BNNSs的XRD图,在2θ=26.77°、41.51°、55.13°、75.9°处的特征衍射峰分别对应于 h-BN 的 (002)、 (100)、 (004)和 (110)晶 面 (PDF No.45-0895),表明剥离过程没有破坏h-BN的晶格结构。与h-BN相比,BNNSs的(002)晶面衍射峰发生负偏移且峰强显著降低,(004)和(100)晶面对应的衍射峰强度比值I(004)/I(100)从1.1升至2.0,这是因为剥离过程沿着(002)晶面方向进行,(004)晶面作为(002)晶面的次级衍射峰被更多的暴露出来。Raman光谱(图3b)表明,剥离后BNNSs层数减少,层间相互作用减弱,使得BNNSs相对于h-BN特征峰强度减弱蓝移至1 366.23 cm-1,半峰宽从12.535 cm-1增加到13.506 cm-1。以上数据均表明 BNNSs 的层数减少[18]。
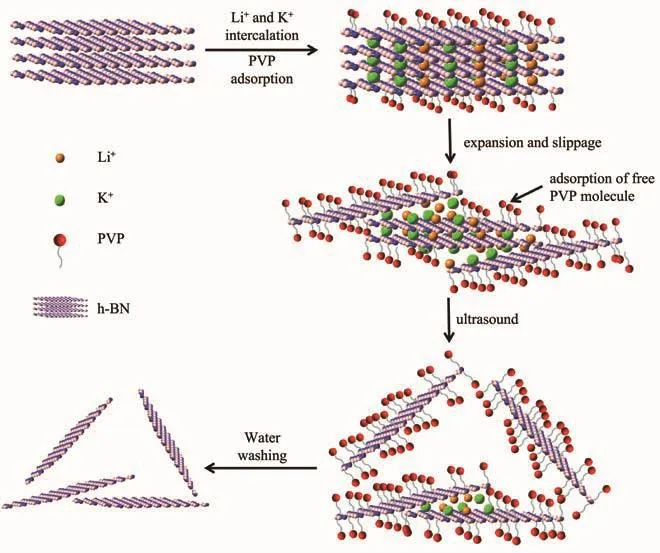
图2 剥离过程示意图Fig.2 Schematic illustration for the exfoliation process
图4(a,b)分别是氮化硼纳米片的 SEM图和TEM图,可以看出与原料h-BN片层较厚相互堆叠,而剥离得到的BNNSs呈薄层透明片状结构且表面光滑。HRTEM图(图4c)进一步表明氮化硼纳米片显示出高度有序的晶格条纹,相邻条纹间距为0.33 nm,层数分别为2和6层。选区电子衍射(SAED)显示出完整的六方晶体结构,表明剥离过程没有破坏其六方结构。使用原子力显微镜更加直观的确定氮化硼纳米片的厚度,图4(d~e)显示剥离得到的氮化硼纳米片的厚度为1.38 nm,约为4个原子层厚度。选取50个纳米片进行厚度统计 (图4f),98%以上的氮化硼纳米片层数小于6层。以上结果表明PVP辅助离子插层法成功制备出少层氮化硼纳米片,计算产率高达37%。
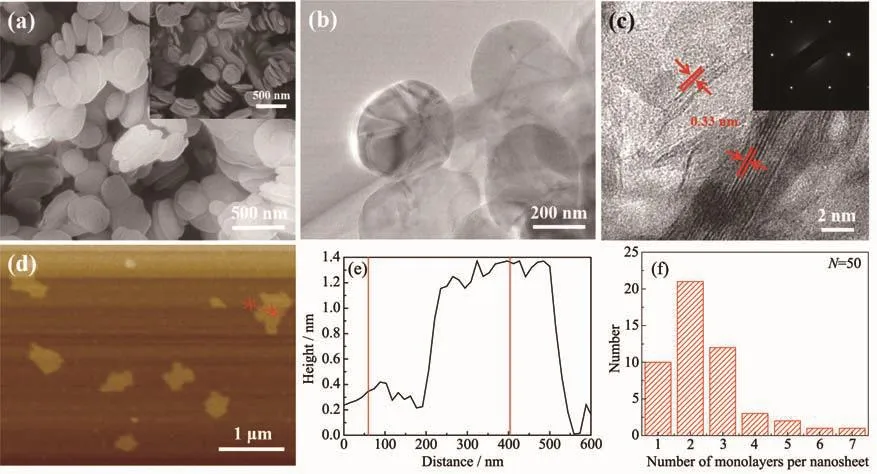
图4 (a)BNNSs的SEM图(插图为块状h-BN)、(b)TEM图、(c)HRTEM图(插图为SAED图案)、(d)AFM图、(e)高度轮廓图和(f)每层的厚度统计图Fig.4 (a)SEM image(inset is bulk h-BN),(b)TEM image,(c)HRTEM image(inset is SAED pattern),(d)AFM image,(e)corresponding height profile and(f)statistical analyse on the number of monolayers per sheet of BNNSs
2.2 还原剂加入方式对催化剂形貌的影响
还原剂加入速率对金属纳米粒子的粒径分布和形貌具有显著影响。图5(a,b)为以不同方式加入还原剂时制备出的Cu0.5Co0.5/BNNSs催化剂的SEM图。用快速倾倒方式制备出的催化剂CuCo纳米粒子粒径分布较窄,在BNNSs表面均匀分散。用慢速滴注方式制备出的Cu0.5Co0.5/BNNSs粒径较大,在BNNSs表面团聚。这是由于快速混合时,大多数金属离子形成晶核,反应体系中不再发生形核,晶粒进入长大阶段,符合“爆发形核、缓慢生长”的模型,因此可以制备出大小均一、粒度分布窄的CuCo纳米粒子。当采用慢速滴注时,形核后局部浓度还会达到临界过饱和浓度,从而会二次形核和多次形核,所以形成的CuCo粒子粒径变大。由于纳米级粒子具有更高的催化活性,故采用倾倒混合方式制备Cu0.5Co0.5/BNNSs纳米催化剂。

图5 不同还原剂滴加速率下制备Cu0.5Co0.5/BNNSs的SEM图Fig.5 SEM images of products under different mixing rates of reducing agent
2.3 催化剂的TEM表征
图6(a~c,f)为CuCo/BNNSs纳米催化剂的 TEM图及粒径统计图,可以看出球形CuCo纳米粒子平均粒径约为2.7 nm且均匀分散在BNNSs表面,无任何团聚现象。HRTEM图6(d~e)显示出清晰的晶格条纹,条纹间距0.214和0.217 nm分别对应于Cu的(111)晶面和 BNNSs 的(100)晶面[19]。其中 Cu 的晶格间距比文献报道[19]偏大,这是因为Co的进入使Cu发生晶格膨胀,形成了CuCo合金结构。没有观察到Co的晶格条纹是因为Co以无定形状态存在,这与XRD(图7b)结果相一致。通过电感耦合等离子体原子发射光谱(ICP-AES)进一步测定催化剂中金属负载量,结果如表1所示。Cu、Co实际比值与理论值接近,表明共还原法成功地将金属还原并负载到载体上。
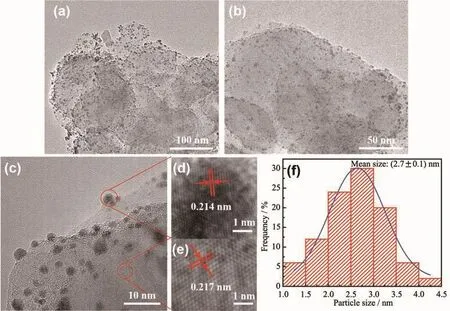
图6 Cu0.5Co0.5/BNNSs纳米粒子的(a~c)TEM图,(d,e)HRTEM图和(f)粒径统计图Fig.6 (a~c)TEM images,(d,e)HRTEM images and(f)size distribution of Cu0.5Co0.5/BNNSs nanoparticles

表1 CuxCo1-x/BNNSs催化剂的ICP-AES分析结果Table 1 ICP-AES results of CuxCo1-x/BNNSs catalysts
2.4 催化剂XRD表征
图7给出了Cu0.5Co0.5/BNNSs、Cu/BNNSs、Co/BNNSs及BNNSs的XRD图。以BNNSs的XRD图为参照,图7a中金属纳米粒子的加入使氮化硼纳米片的(002)晶面特征衍射峰明显减弱,这是由于金属纳米粒子与BNNSs表面间的相互作用改变了电荷分布,结晶度降低。图7b显示,Cu/BNNSs中Cu单质不稳定,部分被氧化成Cu2+。Co/BNNSs中没有观察到Co的特征衍射峰,而XPS全谱图(图9a)中观察到Co的存在,说明Co以无定形状态存在。Cu0.5Co0.5/BNNSs的XRD图在2θ=43.69°处有明显特征峰,它位于Cu的(111)晶面(PDF No.65-9026)和Co的(002)晶面(PDF No.15-0806)之间,归属于Cu0.48Co0.52的合金结构(PDF No.50-1452)。部分Co原子进入到Cu原子的晶格内部或晶格间隙中引起晶格膨胀[20],使CuCo合金拥有更大的结构扭曲,从而暴露更多活性位点。Cu0.5Co0.5/BNNSs的XRD图中未观察到CuO的衍射峰,表明双金属复合体系稳定性增强。
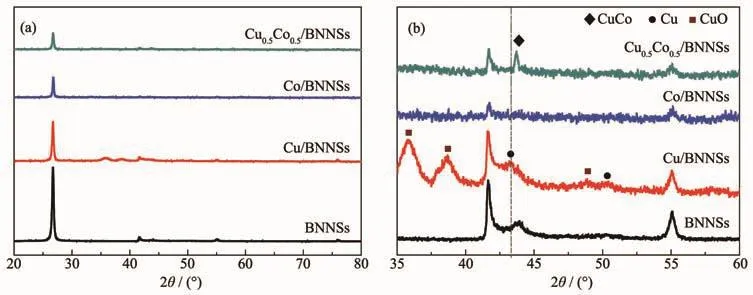
图7 BNNSs、Cu/BNNSs、Co/BNNSs和 Cu0.5Co0.5/BNNSs的(a)XRD 图及(b)部分放大图Fig.7 (a)XRD patterns and(b)partial magnification patterns of BNNSs,Cu/BNNSs,Co/BNNSs and Cu0.5Co0.5/BNNSs
2.5 催化剂的FTIR和Raman表征
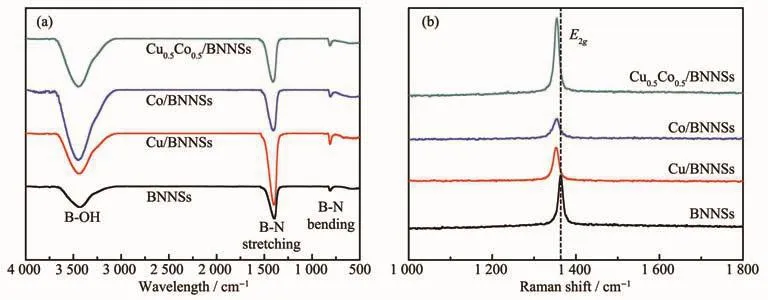
图8 BNNSs、Cu/BNNSs、Co/BNNSs和 Cu0.5Co0.5/BNNSs的(a)红外光谱图和(b)Raman谱图Fig.8 (a)FTIR and(b)Raman spectra of BNNSs,Cu/BNNSs,Co/BNNSs and Cu0.5Co0.5/BNNSs
使用FTIR和Raman光谱对催化剂进行表征,如图8a所示,位于1 398和812 cm-1处的2个吸收峰分别对应于BNNSs的面内B-N伸缩振动和面外B-N-B弯曲振动。位于3 400 cm-1的吸收峰归属于氮化硼纳米片表面的-OH振动。B-OH的存在有助于增加BNNSs表面的活性位点,使得金属纳米粒子稳定分散在其表面。Raman光谱(图8b)显示,催化剂中金属纳米粒子的加入导致B-N键键长伸长,E2g振动发生红移,以上结果均表明CuCo合金与BNNSs的成功复合[21]。
2.6 催化剂的XPS表征
为了进一步分析催化剂表面金属元素的电子价态以及金属之间的电子传递作用,对Cu0.5Co0.5/BNNSs、Cu/BNNSs和Co/BNNSs催化剂进行XPS表征。全谱(图9a)显示 Cu0.5Co0.5/BNNSs中含有 C、O、N、B、Cu和Co元素。B1s轨道能谱(图9b)中位于189.9和190.8 eV的强峰分别对应B-N和B-O波段,B-O可能源于剥离及负载过程中氮化硼表面接连的-OH[19]。Cu2p 谱(图9c)显示,Cu0.5Co0.5/BNNSs中 Cu 主要以金属态存在。而在Cu/BNNSs中部分Cu被氧化,以金属态(Cu2p3/2,932.7 eV;Cu2p1/2,952.5 eV)和氧化态(Cu2+2p3/2,934.9 eV;Cu2+2p1/2,954.6 eV)存在,在942.3和962.5 eV处观察到的震荡卫星峰归属于CuO,这与XRD中的结果一致,表明双金属合金结构具有比单金属更强的稳定性。Co2p谱(图9d)显示,Co在Co/BNNSs和Cu0.5Co0.5/BNNSs中均以金属态(Co2p3/2,777.9 eV;Co2p1/2,793.0 eV)和氧化态(Co2+2p3/2,785.1 eV;Co2+2p1/2,797.1 eV)存在,在 786.2 和797.1 eV处观察到的震荡卫星峰归属于CoO。其中CoO为主要物相,这是由于相比于Cu2+而言Co2+不易被还原。此外,与单金属催化剂Cu/BNNSs和Co/BNNSs相比,Cu0.5Co0.5/BNNSs中Cu2p的结合能发生正偏移,而Co2p的结合能发生负偏移。这是由于Cu(100)晶面(4.65 eV)[22]与 Co(100)晶面(5.44 eV)[23]的功函数不同,部分电子需从Cu转移到Co以平衡费米能级。这种金属间的电子转移使得Cu-Co之间产生强烈的电子协同效应,从而显著提高Cu0.5Co0.5/BNNSs对氨硼烷水解产氢的催化活性。
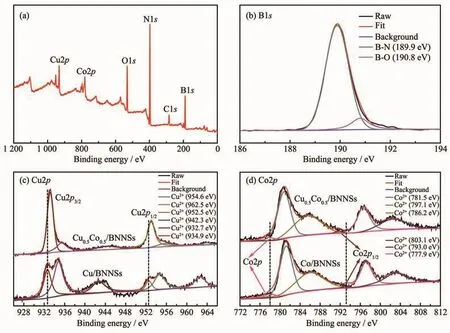
图9 Cu0.5Cu0.5/BNNSs的(a)XPS全谱和B1s的XPS光谱;Cu/BNNSs和Cu0.5Co0.5/BNNSs样品的(c)Cu2p和(d)Co2p的XPS光谱Fig.9 (a)Survey and(b)B1s XPS spectra for Cu0.5Co0.5/BNNSs;(c)Cu2p and(d)Co2p spectra for Co/BNNSs and Cu0.5Co0.5/BNNSs samples
2.7 催化剂催化性能研究
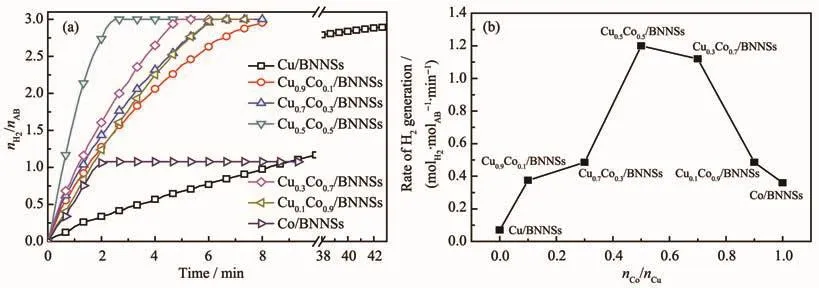
图10 (a)不同CuCo/BNNSs催化剂催化氨硼烷水解释氢曲线;(b)释氢速率随Co含量的变化图Fig.10 (a)Hydrogen generation from the hydrolysis of AB catalyzed with CuCo/BNNSs catalysts;(b)Plots of hydrogen generation rate versus Co content
为了评价催化剂催化性能,将制备的单金属催化剂Cu/BNNSs、Co/BNNSs及双金属催化剂CuxCo1-x/BNNSs(x=0,0.1,0.3,0.5,0.7,0.9,1)分别在室温(25℃)下催化氨硼烷水解。图10a表明释氢量和反应速率与催化剂组成密切相关,单金属催化剂对AB水解的催化活性普遍较低且反应不完全,而所有双金属CuCo/BNNSs催化剂均具有比单金属催化剂更好的活性。此外,从图10b可知双金属CuxCo1-x/BNNSs纳米催化剂具有不同的催化活性,氢气的生成速率随着Co含量的增加呈“火山型”曲线,其中Cu0.5Co0.5/BNNSs纳米催化剂表现出最高的催化活性。这是由于Cu-Co之间的电子传递使CuCo纳米粒子间的协同作用增强,催化活性显著提高。然而,Co含量过多会覆盖住Cu的活性位点使得催化氨硼烷水解活性降低[24]。
2.8 机理研究
2.8.1 双金属协同效应
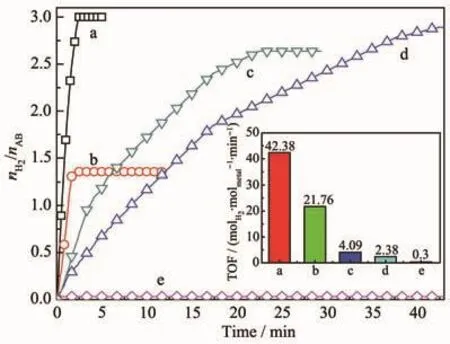
图11 催化剂催化氨硼烷水解释氢曲线Fig.11 Hydrogen generation from the hydrolysis of AB catalyzed by catalysts
如图11所示,为了系统研究CuCo/BNNSs催化剂对AB水解释氢的催化性能我们分别比较了单金属催化剂Cu/BNNSs与Co/BNNSs、双金属催化剂Cu0.5Co0.5/BNNSs、载体材料BNNSs以及单金属催化剂物理混合物的催化活性。显然,相比于单金属催化剂Cu/BNNSs与Co/BNNSs,双金属催化剂Cu0.5Co0.5/BNNSs能催化AB水解释氢完全,具有更高的催化活性。单独的BNNSs对AB水解几乎没有催化活性。此外,在金属含量保持一致时,单金属催化剂物理混合物Cu/BNNSs+Co/BNNSs的催化活性明显低于Cu0.5Co0.5/BNNSs。以上结果表明CuCo合金内部的电子转移使得Cu0.5Co0.5/BNNSs对AB水解释氢具有较高催化活性。
2.8.2 金属-载体协同效应及氮化硼纳米片载体诱导效应
为进一步研究载体对AB水解释氢的影响,制备了 Cu0.5Co0.5NPs、Cu0.5Co0.5NPs+BNNSs物理混合物、Cu0.5Co0.5/rGO和Cu0.5Co0.5/TiO2催化剂并检测其催化性能,其中rGO通过文献报道的Hummer法[25]合成。结果如图12所示,负载型催化剂催化活性明显高于Cu0.5Co0.5NPs催化剂,表明载体对Cu0.5Co0.5NPs具有良好的分散作用,暴露出更多的活性位点。Cu0.5Co0.5NPs+BNNSs的物理混合物催化活性低于Cu0.5Co0.5/BNNSs,这是由于Cu0.5Co0.5/BNNSs催化剂中Cu0.5Co0.5NPs与BNNSs表面键合生成N-pz-Metal-dz2反键杂化物[14],增强了 Cu0.5Co0.5NPs 与 BNNSs 表面的结合能力,提高了Cu0.5Co0.5/BNNSs催化剂的催化活性。此外,Cu0.5Co0.5/BNNSs表现出比Cu0.5Co0.5/rGO和Cu0.5Co0.5/TiO2更高的催化活性。这可归因于AB分子中的双氢键(B-H…H-N)使整个分子处于稳定状态,纳米BNNSs虽然本身不具有催化活性但可以破坏B-H…H-N从而有效缩短AB水解时的诱导时间,降低氢释放温度[16]。以上特性使得BNNSs成为AB水解催化剂的优异载体材料。
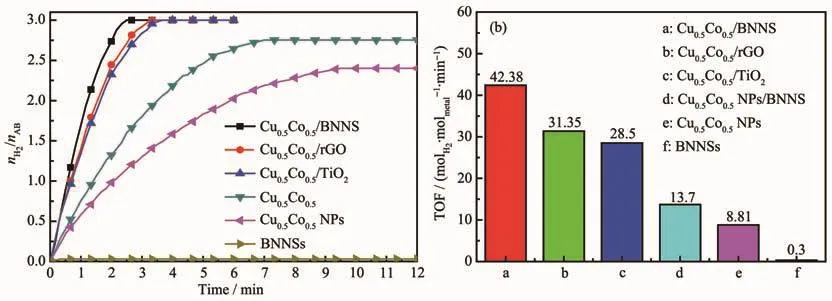
图12 (a)不同催化剂催化氨硼烷水解释氢曲线及(b)催化剂对应TOF值Fig.12 (a)Hydrogen generation from the hydrolysis of AB catalyzed by different catalysts;(b)TOF values obtained from the data of(a)catalysts
2.8.3 pH值对氨硼烷水解释氢速率的影响
保持催化剂用量和氨硼烷浓度不变,通过用NaOH和HCl调节pH值研究室温下Cu0.5Co0.5/BNNSs对AB水解制氢的催化活性。无催化剂存在时,HCl与NaOH对AB水解无催化活性。如图13所示,未经处理的催化剂分散液pH=7,此时催化活性最低。经酸碱调节后催化活性均有明显提高,这是因为AB水解释氢反应中会产生偏硼酸铵附着在催化剂的表面,覆盖住活性位点,从而降低催化剂的催化活性[26]。OH-与 H+的引入可以显著降低 NH4+和BO2-的浓度,使得催化剂中的活性位点可以很好地暴露在反应体系中,总反应方程式如式(1~3)所示[5],式中NH4+(aq.)与BO2-(aq.)表示氨硼烷水解产氢过程中反应液中存在的 NH4+与 BO2-;NH3·H2O(aq.)和H3BO3(aq.)表示反应体系中引入OH-或H+后反应液中的 NH3·H2O 和 H3BO3。用 NH4Cl和 H3BO3调节 pH时,反应速率显著降低,NH4+和BO2-的引入对整个反应具有阻碍作用。此外,OH-能够促进AB和H2O分子在催化剂表面的吸附,进而活化氨硼烷分子和H2O中的O-H键[27],促进氨硼烷水解产氢。室温下pH=14时Cu0.5Co0.5/BNNSs催化剂催化活性最高,可以在1 min左右催化AB完全水解产氢,有望促进氨硼烷作为储氢材料走向实际应用。
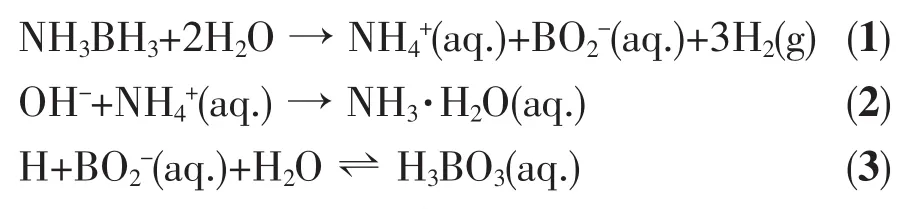
2.8.4 碱对氨硼烷水解的促进机理
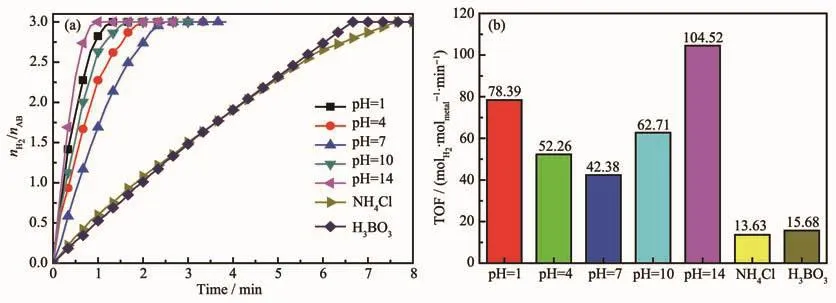
图13 (a)不同pH下Cu0.5Co0.5/BNNSs催化氨硼烷水解释氢曲线及(b)催化剂对应的TOF值Fig.13 (a)Hydrogen generation from the hydrolysis of AB catalyzed by Cu0.5Co0.5/BNNSs at different pH values and(b)TOF values obtained from the data of(a)catalysts
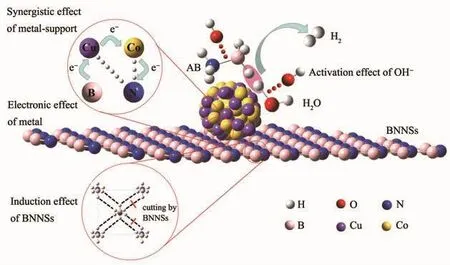
图14 碱性条件下Cu0.5Co0.5/BNNSs催化氨硼烷水解释氢机理图Fig.14 Proposed mechanism for the catalytic hydrolysis of AB by Cu0.5Co0.5/BNNSs under alkaline conditions
以上研究表明,Cu-Co间的电子协同效应、Cu0.5Co0.5纳米粒子与BNNSs间的金属-载体协同效应、BNNSs的诱导效应以及OH-对水分子的活化作用在Cu0.5Co0.5/BNNSs催化AB水解产氢过程中具有强烈的四重协同效应。可能的催化机理如图14所示。首先,Cu与Co间的协同电子效应以及Cu0.5Co0.5纳米粒子与BNNSs间的金属-载体协同效应促进AB分子与H2O分子吸附在催化剂表面,进而有效活化B-N键,降低反应势垒。BNNSs作为载体在稳定Cu0.5Co0.5纳米粒子的同时还可以削弱AB中存在的B-H…H-N从而降低氢释放温度并缩短诱导时间。反应液中的OH-活化H2O分子并进攻BH3基团,发生SN2反应导致B-N键的断裂,生成活化中间体 H3BOH*(式(4),* 表示活性物质)[28]。由于 BH3OH*具有高的不稳定性反应活性,会进攻H2O分子,生成活性 BH2OH* 的同时释放 1 个 H2分子(式(5))[29],由于B、N原子间的静电相互作用使得B-N键再生具有较小的势垒(式(6)),生成的HOBH2-NH3重复上述步骤2次释放出2个H2分子。上述过程中SN2反应为AB水解释氢的限速步骤,进一步表明OH-可以显著加快反应诱导期,增强Cu0.5Co0.5/BNNSs纳米催化剂的催化活性。
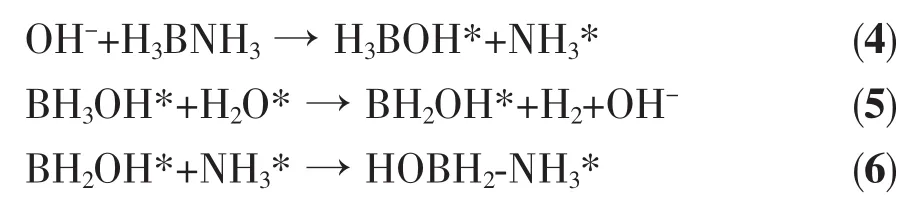
2.9 氨硼烷水解反应活化能
为研究AB水解反应的活化能(Ea)对Cu0.5Co0.5/BNNSs在不同反应温度下(298~318 K)催化AB水解进行测试。结果如图15a所示,AB的产氢速率随反应温度的升高而增加。图15b为通过Arrhenius方程计算出的Cu0.5Co0.5/BNNSs在室温(298 K)下催化AB水解反应的活化能为32.57 kJ·mol-1,TOF值高达104.52molH2·molmetal-1·min-1,催化活性高于部分贵金属催化剂(表2),表明Cu0.5Co0.5/BNNSs纳米催化剂具备优异的催化性能。
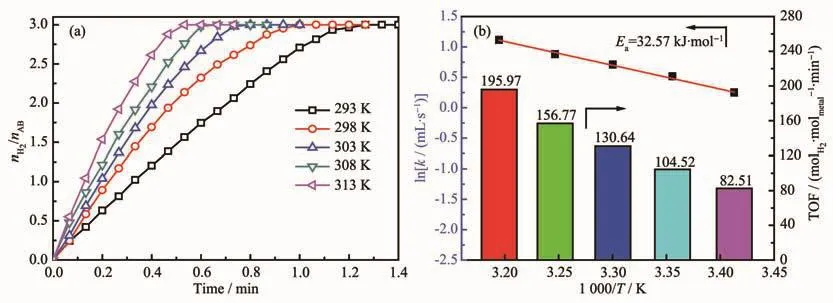
图15 (a)不同温度下Cu0.5Co0.5/BNNSs催化氨硼烷水解释氢曲线;(b)阿伦尼乌斯方程与TOF值Fig.15 (a)Hydrogen generation from the hydrolysis of AB and(b)Arrhenius plot and TOF values obtained from the data of(a)
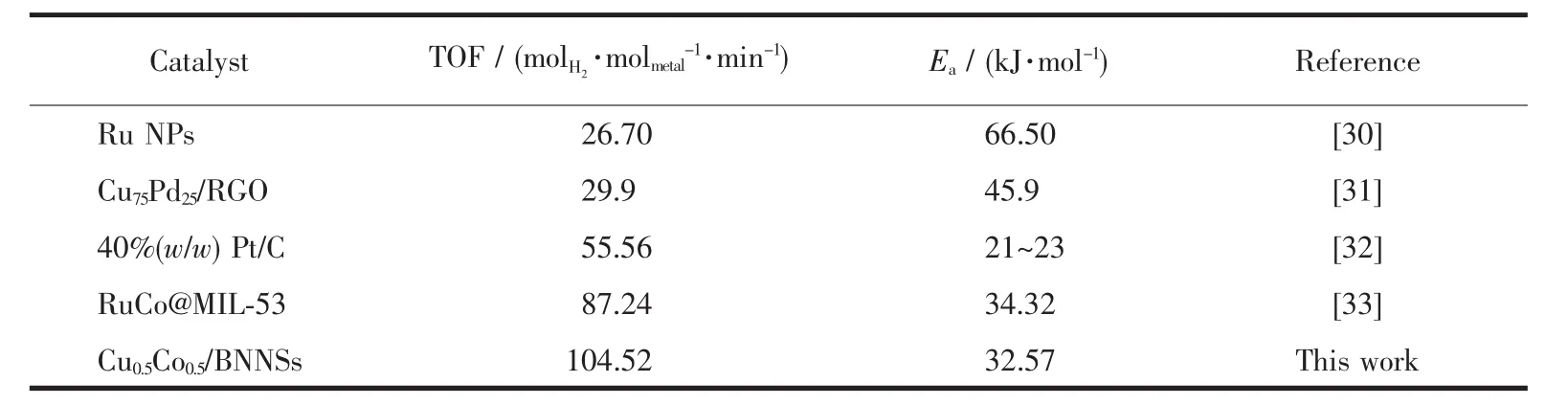
表2 AB水解产氢催化活性数据比较Table 2 Comparison of the catalytic performance of Cu0.5Co0.5/BNNSs with reference data
2.10 催化剂稳定性测试
催化剂的循环稳定性能在实际应用中是非常重要的。保持反应液pH=14,探讨Cu0.5Co0.5/BNNSs纳米催化剂的稳定性。图16表明Cu0.5Co0.5/BNNSs纳米催化剂的催化活性即使在6次运行后仍无明显下降,这表明Cu0.5Co0.5/BNNSs催化剂具有良好的循环稳定性。由6次循环前后催化剂的XRD图(图17a)可以看出Cu0.5Co0.5合金衍射峰强度略微降低,但主要物相依然是Cu0.5Co0.5合金。6次循环后催化剂的TEM(图17b)显示催化剂中Cu0.5Co0.5纳米粒子发生轻微团聚,依然保持较小粒径。此外,随着循环次数的增加,反应液被稀释并且在AB水解过程中偏硼酸盐浓度逐渐增加,均不利于反应的进行,进而减弱催化剂的催化活性。
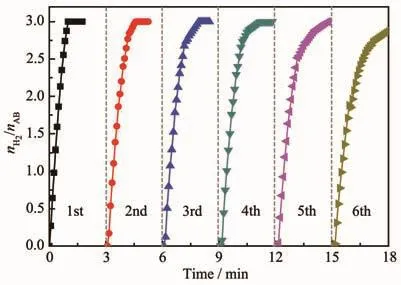
图16 在298 K下Cu0.5Co0.5/BNNSs催化氨硼烷水解循环稳定性测试Fig.16 Stability test for hydrogen generation from the hydrolysis of AB catalyzed by Cu0.5Co0.5/BNNSs at 298 K
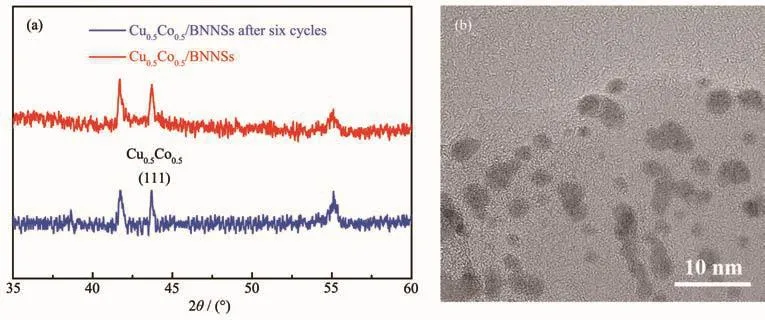
图17 六次循环实验后Cu0.5Co0.5/BNNSs催化剂的(a)XRD图及(b)TEM图Fig.17 (a)XRD pattern and(b)TEM image of Cu0.5Co0.5/BNNSs catalyst after six cycles
3 结 论
采用PVP辅助离子插层法制备了高质量的BNNSs,并以其为载体通过共还原方法合成了CuCo/BNNSs纳米催化剂,并研究了催化剂对AB水解产氢的催化性能。催化性能测试结果表明,Cu0.5Co0.5/BNNSs纳米催化剂在pH=14条件下对AB水解释氢的催化活性最高。TOF值可达104.52molH2·molmetal-1·min-1,活化能为32.57 kJ·mol-1,催化性能高于部分贵金属催化剂。这归因于Cu0.5Co0.5纳米粒子间的电子协同效应、Cu0.5Co0.5纳米粒子与BNNSs间的金属-载体协同效应、BNNSs载体的诱导效应以及OH-的活化效应的共同作用。

