基于原位脱羧3-硝基邻苯二甲酸构筑的金属配合物的合成、晶体结构及物理性质
吴国志 汪鹏飞*,,2 李善青*, 方霄龙
(1微纳粉体与先进能源材料安徽省普通高校重点实验室,池州学院材料与环境工程学院,池州 247000)
(2南京大学配位化学国家重点实验室,南京 210023)
0 引 言
由于在催化、发光、磁性以及新能源材料等领域具有潜在的应用前景,配合物受到了广泛的关注[1-7]。这类材料具有零维簇(单核)、一维链、二维层、三维骨架等不同结构特征,这就赋予了他们的不同物理性质。在合成这类材料过程中,利用不同的中心金属离子的配位数、含有功能基团的有机配体以及辅助配体对最后配合物的结构都会产生较大的影响。为了构筑一些特定的配合物,水热法(溶剂热法)为反应体系提供了高温高压的环境,使有机配体的溶解度大幅提高,往往有利于特定结构的产物生成。在这其中,利用金属离子与有机配体原位反应形成配合物也有报道,主要包括脱羧的C-C键断裂、环加成、三唑或四唑的形成,也有通过有机溶剂分子在高温高压下的原位反应形成的配合物[8-10]。在我们近期的研究中,通过N,N-二甲基甲酰胺(DMF)原位分解的产物之一甲酸根与稀土金属离子构筑了一个三维框架结构配合物[La(CO3)3]n[11]。这里我们选择了一种含有羧酸基团的有机配体3-硝基邻苯二甲酸和含氮配体(菲咯啉和三氮唑)与不同的金属盐在水热条件下反应,组装了 2 个配合物:[Zn(3-NBA)(trz)]n(1)和[Pb(3-NBA)(phen)2]NO3(2)(3-NBA-=3-硝基苯甲酸根)。值得注意的是2个配合物中3-硝基邻苯二甲酸在反应的过程中都发生了C-C键断裂的脱羧反应,并且都是2-位上的羧酸基团。为了探索其中的原因,我们详细研究了反应条件对最后产物的影响,并且通过理论计算方法计算了相关键能,发现3-硝基邻苯二甲酸2-位上的C-C键的键比其1-位上C-C键能要小,前者是395.43 kJ·mol-1,而后者是420.20 kJ·mol-1。此外,我们还研究了2个配合物的热稳定性和室温条件下的固体荧光性质。
1 实验部分
1.1 试剂与仪器
所用的化学试剂3-硝基邻苯二甲酸(3-NPAH2)、1,2,4-三氮唑(Htrz)、菲咯啉一水合物(phen·H2O)、三乙胺(Et3N)、ZnSO4·7H2O、Pb(NO3)2均为分析纯,使用前未做任何纯化。红外光谱使用Nicolet iS10光谱仪,KBr压片法测定;元素分析(C、H、N)在 Perkin-Elmer 240C元素分析仪上测定;样品的粉末XRD在日本理学UltimaⅣX射线衍射仪上测定(Cu Kα,λ=0.154 056 nm),管电压和管电流分别为40 kV和40 mA,2θ=5°~50°,扫描速率为4°·min-1。热重分析在Thermo Gravimetric Analyzer(Q500)上氮气气氛测定,温度范围 25~700℃,升温速率 20℃·min-1;荧光测试在Edinburgh FLS 980荧光光谱仪上使用多晶样品在室温下完成。
1.2 配合物的合成
1.2.1 [Zn(3-NBA)(trz)]n(1)的合成
分别称取 ZnSO4·7H2O(1.0 mmol,0.287 6 g),3-NPAH2(1.0 mmol,0.211 1 g)和 Htrz(2.0 mmol,0.138 1 g),再加入40 mL去离子水,室温条件下搅拌30 min后加入Et3N 0.2 mL,继续搅拌30 min,得到乳白色均相液体。再将该液体转移到聚四氟乙烯作内衬的不锈钢反应釜(100 mL)中,将反应釜放入烘箱中160℃保温72 h后自然冷却至室温,得到浅黄色块状晶体,收集晶体用去离子水和乙醇洗涤数次,室温干燥。产率25%(基于金属Zn计算)。红外光谱(KBr,cm-1):3 437(w),3 127(m),1 618(s),1 604(s),1 561(s),1 528(s),1 484(m),1 437(m),1 406(m),1 348(s),1 296(m),1 211(w),1 170(s),1 096(s),1 042(w),1 003(m),927(w),910(w),839(w),788(m),723(s),665(m)。元素分析按C9H6N4O4Zn的计算值(%):C 36.09,H 2.02,N 18.70;实验值(%):C 36.20,H 2.06,N 18.64。对合成的多晶样品进行粉末XRD表征可确定产物为纯相。
1.2.2 [Pb(3-NBA)(phen)2]NO3(2)的合成
分别称取Pb(NO3)2(1.0 mmol,0.331 2 g),3-NPAH2(1.0 mmol,0.211 1 g) 和 phen·H2O(1.0 mmol,0.198 g),再加入60 mL去离子水,室温下搅拌30 min后转移至聚四氟乙烯作内衬的不锈钢反应釜(100 mL)中,再将反应釜放入烘箱中160℃保温72 h后自然冷却至室温,得到含有大量淡黄色絮状不溶物的液体。过滤该液体混合物,滤液静置1周时间得到淡黄色块状晶体,收集晶体,用去离子水和乙醇洗涤数次,室温干燥。产率20%(基于金属Pb计算)。红外光谱 (KBr,cm-1):3 430(m),1 620(m),1 591(m),1 550(m),1 516(s),1 426(s),1 383(vs),1 342(s),1 315(m),1 220(w),1 066(w),854(s),725(s),631(w),511(w)。元素分析按 C31H20N6O7Pb的计算值 (%):C 46.79,H 2.53,N 10.56;实验值(%):C 46.65,H 2.58,N 10.63。对合成的多晶样品进行粉末XRD表征可确定产物为纯相。
1.3 单晶X射线衍射及结构测定
单晶数据在带有石墨单色器的Bruker Smart-Apex-ⅡCCD衍射仪上测定的。选取尺寸分别为0.26 mm×0.21 mm×0.14 mm(1)和 0.08 mm×0.06 mm×0.06 mm(2)的透明晶体,用 Mo Kα 射线(λ=0.071 073 nm)以及φ-ω扫描方式收集单晶的衍射点。衍射数据用SAINT程序进行还原处理[12],并用SADABS程序进行经验吸收校正[13]。晶体的分子结构使用SHELXS-97[14]程序由直接法解出,对非氢原子采用各向异性参数使用SHELXL-2018程序进行全矩阵最小二乘法精修[15]。最后通过理论加氢方法确定氢原子位置。2个配合物的晶体学参数见表1,部分键长和键角见表2和3。
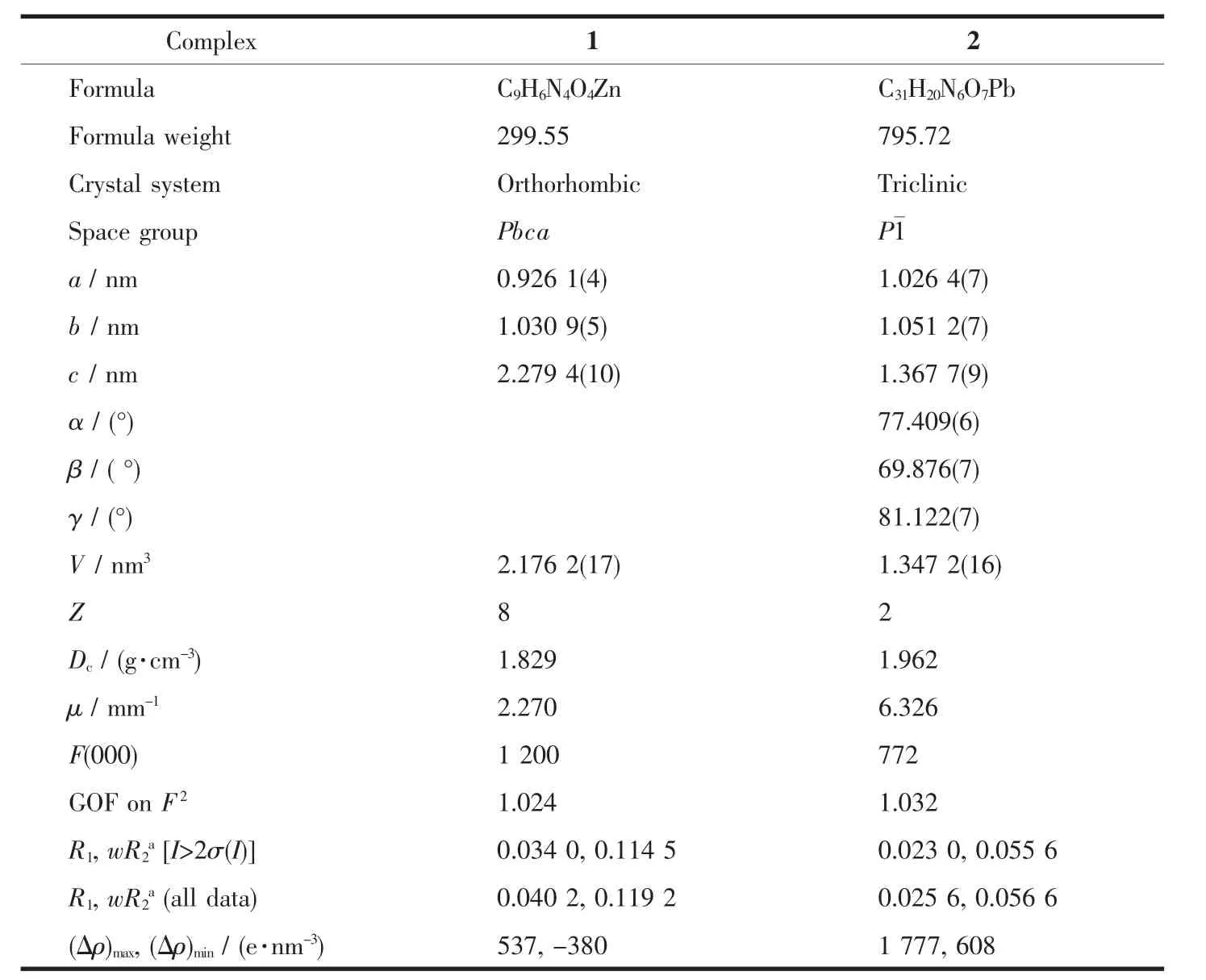
表1 配合物1~2的晶体学参数Table 1 Crystal data and structure refinement for complexes 1~2
CCDC:1915797,1;1915798,2。

表2 配合物1的主要键长(nm)和键角(°)Table 2 Selected bond lengths(nm)and angles(°)for complex 1

表3 配合物2的主要键长(nm)和键角(°)Table 3 Selected bond lengths(nm)and angles(°)for complex 2

续表3
2 结果与讨论
2.1 合成条件讨论
配合物1和2是利用3-硝基邻苯二甲酸、可溶性金属盐以及含氮配体 (1,2,4-三氮唑和菲咯啉)通过水热反应直接制备或滤液静置而得到的。在合成2个配合物的水热反应中,都发生了3-硝基邻苯二甲酸原位C-C键的断裂成3-硝基苯甲酸从而形成了相应的产物。为了了解各种因素对产物的影响,我们详细地探索了反应温度、碱以及羧酸原料对产物的影响。对于配合物1,有机胺Et3N扮演了重要的作用,如果使用无机碱(NaOH、LiOH和KOH)代替Et3N调节反应的pH值,无法得到任何晶态产物;而对于配合物2,无需添加任何无机碱和有机碱调节反应的pH值;如果加入碱,得到的产物会产生更多的沉淀,滤液静置挥发得不到任何产物。如果使用3-硝基苯甲酸代替3-硝基邻苯二甲酸作为反应原料按照相同的条件得不到相应的产物。此外,反应温度对2个配合物影响较大,反应温度一定要控制在150~170℃之间,低于或高于此温度反应均得不到2个配合物。所得到的2个配合物均不溶于水和其他的常规的有机溶剂。
2.2 晶体结构描述
2.2.1 配合物1的晶体结构
配合物1结晶于正交晶系Pbca空间群。如图1所示,配合物1的不对称单元含有1个中心锌离子(Zn2+)、1个3-硝基苯甲酸根离子(3-NBA-)以及 1个脱质子化的三氮唑阴离子(trz-)。中心锌离子采用五配位扭曲的四方锥构型,4个基点位置分别被来自1个3-硝基苯甲酸根离子的2个羧酸氧原子 (O1和O2)和2个三氮唑氮原子(N1和N2A)所占据,其轴向位置被另外1个三氮唑的氮原子(N3C)所占据。Zn-N键的键长在0.200 9(3)~0.201 6(3)nm之间,Zn-O键的键长在0.212 1(4)~0.224 4(4)nm之间,相关键长范围与其它锌-羧酸-三氮唑配位聚合物的键长一致[16-17]。配合物 1中,三氮唑阴离子采用 μ3-配位构型连接3个锌离子,从而形成一个单层结构(图2)。相邻的层沿c轴方向采用ABAB方式堆积(图3)。配合物1中原位产生的3-硝基苯甲酸根采用螯合方式连接1个锌离子,3-硝基苯甲酸中硝基苯环位于无机层的两侧。层与层之间通过一种弱相互作用堆积而成三维结构(图4),这种作用是由硝基氧原子与三氮唑环之间的N-O…π弱相互作用,其中O4…π距离为0.310 6 nm,所形成的夹角在 63°到 75°之间[18-19]。层与层之间相邻的苯环之间不存在π…π弱相互作用,主要是它们之间的距离为0.497 2 nm,超过正常的弱相互作用范围[20]。
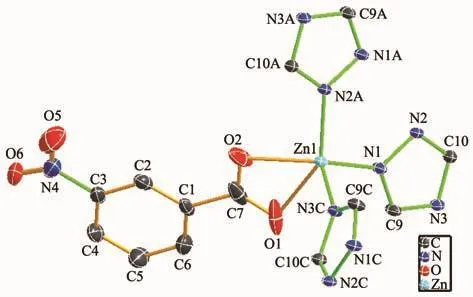
图1 配合物1的结构单元图Fig.1 Asymmetric unit of complex 1

图2 配合物1的单个无机层结构Fig.2 Single inorganic-layer structure of complex 1
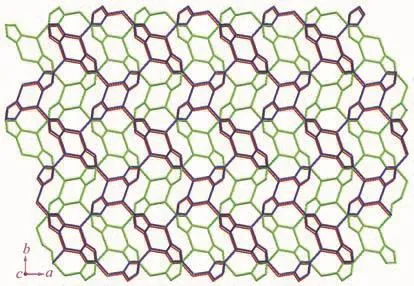
图3 配合物1中无机层的ABAB堆积形式Fig.3 ABAB stacked fashion of complex 1
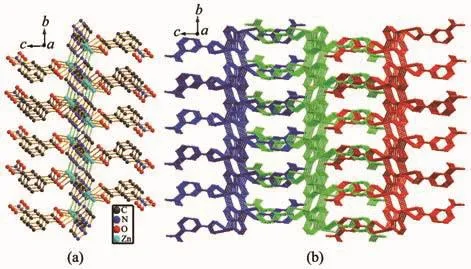
图4 (a)配合物1的二维层状结构;(b)配合物1沿着a轴方向堆积结构Fig.4 (a)Two-dimensional layer structure of complex 1;(b)Packed structure of complex 1 along a axis
2.2.2 配合物2的晶体结构
配合物2属于三斜晶系,P1空间群。如图5所示,配合物2的不对称结构单元由1个中心离子(Pb2+)、1 个 3-硝基苯甲酸根阴离子(3-NBA-)、2 个菲咯啉(phen)中性分子以及1个游离态的硝酸根离子(NO3-)组成。配合物2中,中心铅离子具有六配位扭曲的八面体构型 {PbO2N4},6个配位点被来自2个phen分子中的4个氮原子(N2,N3,N4和N5)以及1个3-NBA-中的2个羧酸氧原子(O1和O2)所占据。Pb-O键的键长为0.262 2~0.274 6 nm,Pb-N键的键长为0.253 8~0.268 9 nm,这些键长参数与相关铅配位聚合物中Pb-O/N键长范围是一致的[21-23]。在该配合物中,3-NBA-的1个羧酸基团采取螯合配位方式螯合铅离子形成一个单核结构,相邻的单核结构配合物通过phen分子之间的π…π相互作用堆积而成二维结构,作为一个大的平面共轭分子,整个phen分子含有3个六元环,都可能与其他共轭分子之间形成π…π相互作用。在该配合物中,形成π…π相互作用不是中心位置的苯环而是位于两侧位置的六元吡啶环,2个六元吡啶环中心点之间的距离为0.388 2 nm,2个phen分子在结构中处于平行位置,NO3-作为电荷平衡离子存在于单核结构单元之间起到稳定整个结构的作用(图6)。
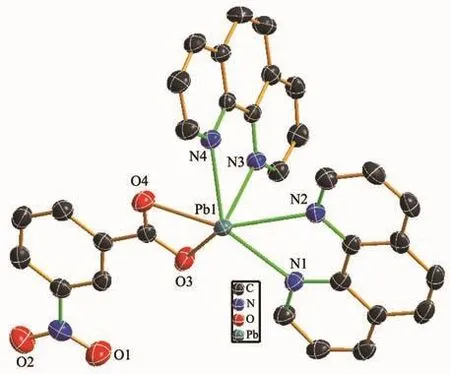
图5 配合物2的结构单元图Fig.5 Asymmetric unit of complex 2
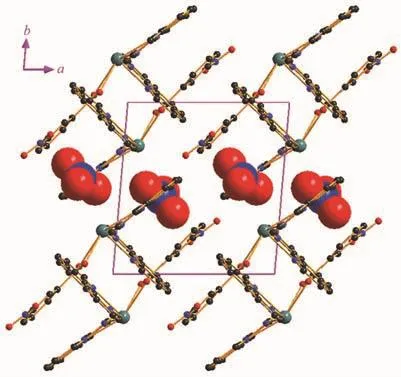
图6 配合物2沿着c轴方向的堆积图Fig.6 Packed structure of complex 2 along c axis
2.3 配合物的热稳定性
为了详细了解2个配合物的热稳定性,我们在氮气气氛下测试了2个配合物的热重曲线。如图7所示,配合物1能够稳定到350℃,随后TG曲线剧烈下降,表明配合物1的结构骨架开始坍塌分解,400℃后的曲线几乎不再下降,说明该配合物不再分解,最后的残余量为29.75%,剩余产物可能为ZnO(理论值:27.04%),可能含有极少量碳。而对于配合物2,直到180℃以上才开始失重,在180~230℃范围内剧烈失重,随后在230~330℃之间曲线下降的程度较慢,表明配合物2的主体结构坍塌并分解,最后的剩余量为28.92%,可能的产物为PbO(理论值:28.05%)。
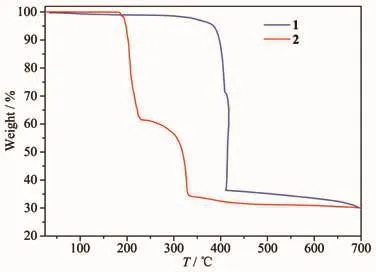
图7 配合物1~2的热重曲线Fig.7 Thermal gravimetric analyses(TGA)curves for complexes 1~2
2.4 配合物的固体荧光性质
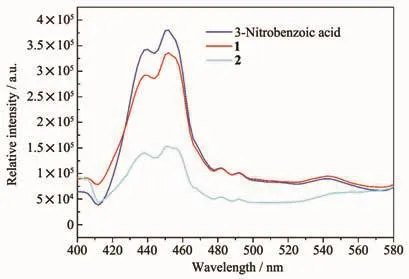
图8 3-硝基苯甲酸和配合物1~2在室温下的发射光谱图Fig.8 Emission spectra of 3-nitrobenzoic acid and complexes 1~2 at room temperature
由于在发光材料领域具有潜在应用前景,配合物的荧光性质一直受到广泛的关注[24]。为了进一步了解2个配合物的发光性质,我们在室温条件下测试2个配合物以及有机配体3-硝基苯甲酸的多晶样品室温下的固体荧光性质。由图8可见,有机配体3-硝基苯甲酸在301 nm激发光激发下在440和452 nm处具有2处发射峰。有机配体的发射光归因于其π*→π跃迁。而配合物1和2在相同的激发光(λex=301 nm)激发下具有非常相似的发射光谱。2个配合物的荧光来源于有机配体3-硝基苯甲酸,发光强度的变化是由于有机配体与中心金属离子形成配位键导致有机配体的刚性和共平面程度的变化[25-26]。
3 结 论
以相同的羧酸配体以及2种含氮辅助配体与不同的金属盐反应,成功合成出2种金属配位配合物:[Zn(3-NBA)(trz)]n(1)和[Pb(3-NBA)(phen)2]NO3(2),其中有机羧酸配体3-硝基邻苯二甲酸发生了原位C-C键断裂反应形成3-硝基苯甲酸根。配合物1具有二维层状结构,层与层之间存在一种由硝基氧原子与三氮唑环形成的N-O…π弱相互作用;而配合物2显示零维单核结构特征,这些单核单元通过菲咯啉环之间π…π弱相互作用形成了三维超分子结构。此外,研究了2种金属配合物材料室温下的固体荧光性质,相对于有机配体。2种金属配合物发射光波长没有发生明显变化,表面配合物的荧光来自于3-硝基苯甲酸配体。
Supporting information is available at http://www.wjhxxb.cn

