酸马奶中乳酸菌对Escherichia coli O8腹泻小鼠生长性能、血清免疫及抗氧化指标的影响
吉米斯 敖日格乐* 王纯洁 斯木吉德 高瑞娟 阿日查 超 克 张 剑
(1.内蒙古农业大学 动物科学学院,呼和浩特 010018; 2.内蒙古农业大学 兽医学院,呼和浩特 010018)
细菌性疾病暴发对人类健康和农业生产造成巨大威胁。细菌引起的感染性腹泻会导致机体生长速度缓慢、精神萎缩、免疫力下降甚至会致死。为预防或治疗细菌性疾病,抗生素被广泛应用。然而,由于生产中抗生素的不当使用,导致细菌病原对抗生素产生耐药性,在革兰氏阳性和革兰氏阴性细菌种中出现多重耐药性细菌,引起公共卫生危机。因此,寻求抗生素的替代品,用于预防和治疗致病性大肠杆菌所致腹泻病,比如益生菌、益生元、植物提取物和有机酸等天然促生长剂(Nature growth promoters, NGPs),已经在世界范围内得以广泛应用[1]。益生菌食品因其含有微生物,食用后可维持肠道菌群的平衡,对某些疾病起到治疗或预防的作用[2]。酸马奶中含有丰富的微生物资源,其中最主要是乳酸菌和酵母菌。研究表明许多乳酸菌(Lactic acid bacteria, LAB)具有益生菌特性,LAB是公认的食品安全级(GRAS)益生菌之一,具有降血压、抗感染、免疫调节、预防糖尿病、抗氧化、调节胃肠道菌群平衡、降低血清胆固醇和降低肿瘤风险等效果[3-7]。LAB可提高小鼠免疫力,改善动物肠道结构,同时可以促进机体胆汁酸的肠肝循环和脂质代谢功能[8]。饲料中添加适量的德氏乳酸菌能够提高黄河鲤皮肤的抗氧化能力和免疫调节功能,同时能上调抗菌肽基因的表达,进而对机体免疫性能和生长性能具有一定的调节作用[9]。益生菌可刺激白细胞介素-10(IL-10)和转化生长因子β(TGF-β)的表达,IL-10和TGF-β是肠道内环境稳态的关键介质,二者之间具有协同作用[10-11]。大鼠灌胃植物乳杆菌XM5能有效缓解D-半乳糖对脑组织的氧化损伤,能显著提高衰老模型组大鼠血清中的T-AOC、GSH-Px和SOD活力,肝脏中的GSH-Px活力[12]。酸马奶中乳酸菌主要为戊糖乳杆菌、植物乳杆菌、副干酪乳杆菌、副干酪乳杆菌类坚韧亚种、干酪乳杆菌、嗜酸乳杆菌和马乳酒乳杆菌等。然而,关于副干酪乳杆菌类坚韧亚种(Lactobacillusparacaseisubsp.tolerans)对致病菌所致腹泻小鼠血清免疫和抗氧化功能方面影响的相关研究尚少,因此,本试验拟以EscherichiacoliO8腹泻小鼠模型组作为研究对象,灌胃不同浓度的乳酸菌和抗生素进行腹泻治疗,通过评价副干酪乳杆菌类坚韧亚种对腹泻小鼠生长性能、免疫功能和抗氧化性能的改善作用,以期为进一步深入开发研究益生菌类功能性食品提供理论依据。
1 材料与方法
1.1 试验设计
选择SPF级昆明小鼠(KM鼠)60 只,雌雄各半,体重一致,购自内蒙古大学实验动物中心。为了适应环境,先饲养(饲料主成分为玉米、豆粕、鱼粉、多种维生素等,不含抗生素)5 d后称重,选取体重(20±2) g的个体,随机分为6 组,每组10 只,试验期为7 d,分组情况及给药方式见表1。
1.2 菌株、培养基及试剂
菌株为从酸马奶中筛选的副干酪乳杆菌类坚韧亚种。致病菌为从荷斯坦奶牛粪便中分离纯化的致病性E.coliO8菌株,-80 ℃保存;Nisin购自Sigma-Aldrich(上海)贸易有限公司;MRS固体和液体培养基、营养琼脂培养基和营养肉汤培养基,均购自广东环凯微生物科技有限公司;盐酸环丙沙星购自广州白云山制药股份有限公司;小鼠白细胞介素4(IL-4)ELISA试剂盒、小鼠白细胞介素6(IL-6)试剂盒、小鼠白细胞介素10(IL-10)试剂盒、小鼠γ干扰素(IFN-γ)试剂盒、小鼠转化生长因子-β(TGF-β)试剂盒、小鼠过氧化氢酶(CAT)试剂盒、小鼠总抗氧化能力(T-AOC)试剂盒、小鼠过氧化氢酶(CAT)试剂盒、小鼠超氧化物歧化酶(SOD)试剂盒、小鼠谷胱甘肽过氧化物酶(GSH-Px)试剂盒和小鼠丙二醛(MDA)试剂盒,均购自江苏酶免实业有限公司;大小鼠维持饲料购自北京科澳协力有限公司。
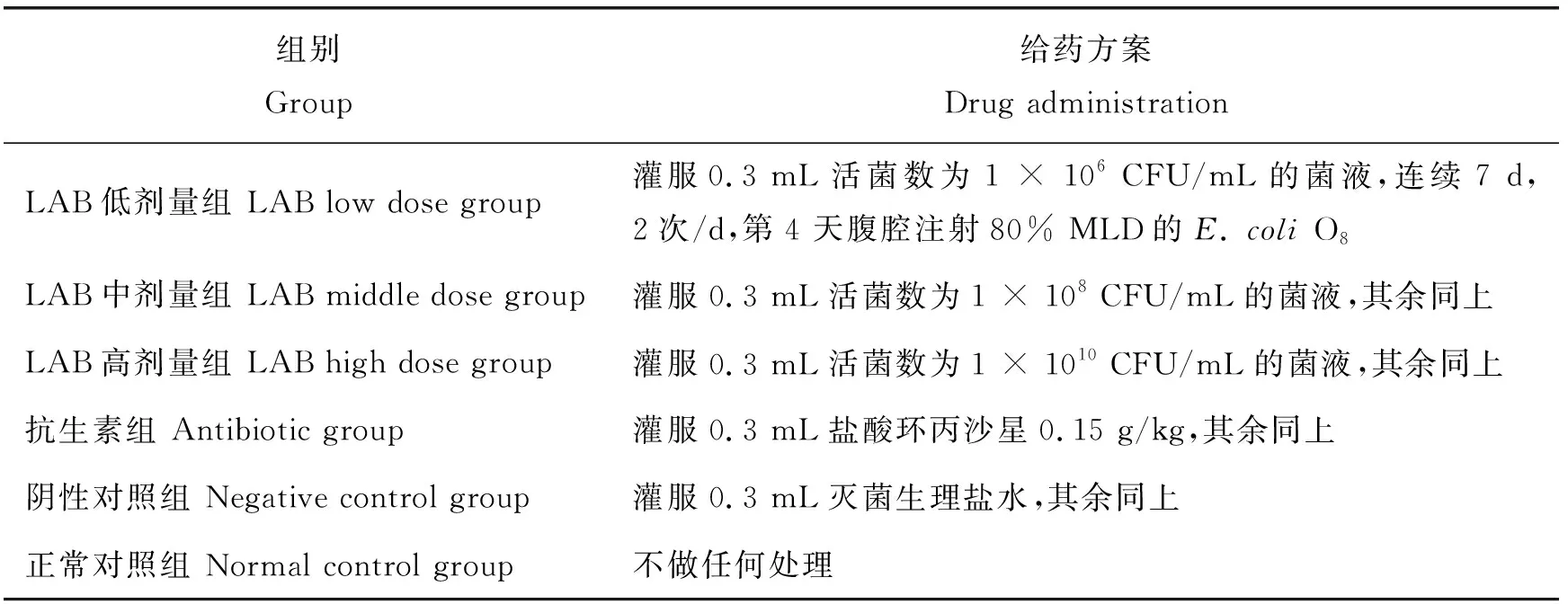
表1 体内抑菌试验分组情况及给药方案Table 1 Grouping and dosage scheme of the antibacterial test in vivo
注: MLD为最低致死量。
Note: MLD is the minimal lethal dose.
1.3 仪器及设备
LDZM-40KCS立式压力蒸汽灭菌器购自上海申安医疗器械厂;ZXSD-B1090生化培养箱购自上海智城分析仪器制造有限公司;SW-CJ-2D双人单面垂直送风净化工作台购自苏州博莱尔净化设备有限公司;3K15高速冷冻离心机购自德国Sigma公司;酶标仪购自美国伯腾仪器有限公司。
1.4 试验菌株活化及菌悬液的制备
将20%(V/V)的甘油中-80 ℃保存的乳酸菌和大肠杆菌置37 ℃水浴融化,再分别划线接种到MRS固体培养基和营养琼脂培养基上,接种好的乳酸菌置于37 ℃厌氧培养24~48 h,大肠杆菌置于37 ℃有氧培养18~24 h,再挑取单个菌落分别接种到MRS液体培养基和营养肉汤中,乳酸菌培养时间24 h。用酶标仪测定600 nm OD值来确定菌密度,调整至制备所需浓度的菌悬液,4 ℃下保存备用。
1.5 测定指标及方法
1.5.1小鼠临床症状的观察
试验期间观察并记录小鼠精神状态、饮食量、毛色、腹泻和死亡情况。
1.5.2体重和采食量的测定
在试验第1 天、第3 天、第5 天和第7 天清晨分别进行空腹称重每只小鼠并记录各组小鼠的采食量,分析体重和采食量的变化。
1.5.3免疫器官指数的测定
各组小鼠于末次灌药禁食24 h(自由饮水)后称重,腹腔注射0.3%的戊巴比妥钠溶液(10~20 μL/g)麻醉每只小鼠心脏穿刺采血后,无菌取出脾脏和胸腺,称重并计算免疫器官指数,计算公式如下:
脾脏指数=脾脏重/小鼠活体重 胸腺指数=胸腺重/小鼠活体重
1.5.4血清免疫指标和抗氧化指标的测定
小鼠心脏穿刺采集的全血室温静置2 h后3 000~4 000 r/min离心10 min分离血清,采用酶联免疫吸附法(ELISA)测定血清中细胞因子水平、免疫球蛋白含量和抗氧化酶活性,每组做6个重复。测定标本A450值,以标准物的浓度为纵坐标,A450值为横坐标,在Excel上绘出标准曲线,根据标本的A450值由标准曲线算出相应的浓度。
血清中细胞因子水平的测定:采用ELISA试剂盒按照操作说明书进行检测血清γ干扰素(IFN-γ)、IL-6、IL-4、IL-10、转化生长因子-β(TGF-β)水平。
血清中抗氧化指标的测定:采用ELISA试剂盒按照操作说明书进行检测小鼠血清过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的活性及丙二醛(MDA)含量。
1.6 数据统计及分析
原始数据先用Excel 2016做简单的处理,再应用SPSS 20.0软件进行单因素方差分析(one-way ANOVA, LSD),差异显著时进行Duncan氏多重比较检验,测定结果以平均值±标准误(mean±SE)表示,P<0.05表示差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果与分析
2.1 各组小鼠临床症状变化
分别连续灌胃LAB高、中、低组和抗生素组不同剂量的LAB和抗生素7 d,在第4 天给小鼠腹腔注射E.coliO8,随后几天观察该4组,包括正常对照组和阴性对照组,小鼠的外部体征和器官形态。研究发现:试验前3 天各组小鼠未出现任何异常反应和死亡现象;在试验第4 天阴性对照组死亡2 只,除正常对照组外,其他组小鼠具有精神萎靡,饮食量减少,被毛逆立,伏地不动,蜷缩一起,畏冷等症状(图1(a)-I和(b)-I);在试验第5 天阴性对照组和抗生素组各死亡1 只,除正常组外其他组均出现明显的腹泻,带有黏液,精神状态较差,肠道充血膨胀,眼睑红肿有分泌物等症状(图1(a)-Ⅱ~Ⅳ和(b)-Ⅱ~Ⅳ),平均各组2至3 只小鼠有拉血症状,采食量和饮水量明显下降,表明腹泻模型造模成功;在试验第6 天阴性对照组和LAB低剂量组各死亡1 只,LAB中剂量组死亡2 只,各组小鼠精神状态有所好转,饮食量逐渐增加,阴性对照组中20%的小鼠出现便秘现象,可能是炎症导致的便秘;在试验第7 天各组小鼠腹泻症状轻微,阴性对照组眼睑病变减轻,其他组眼睑症状基本消失,饮食情况也基本恢复正常。
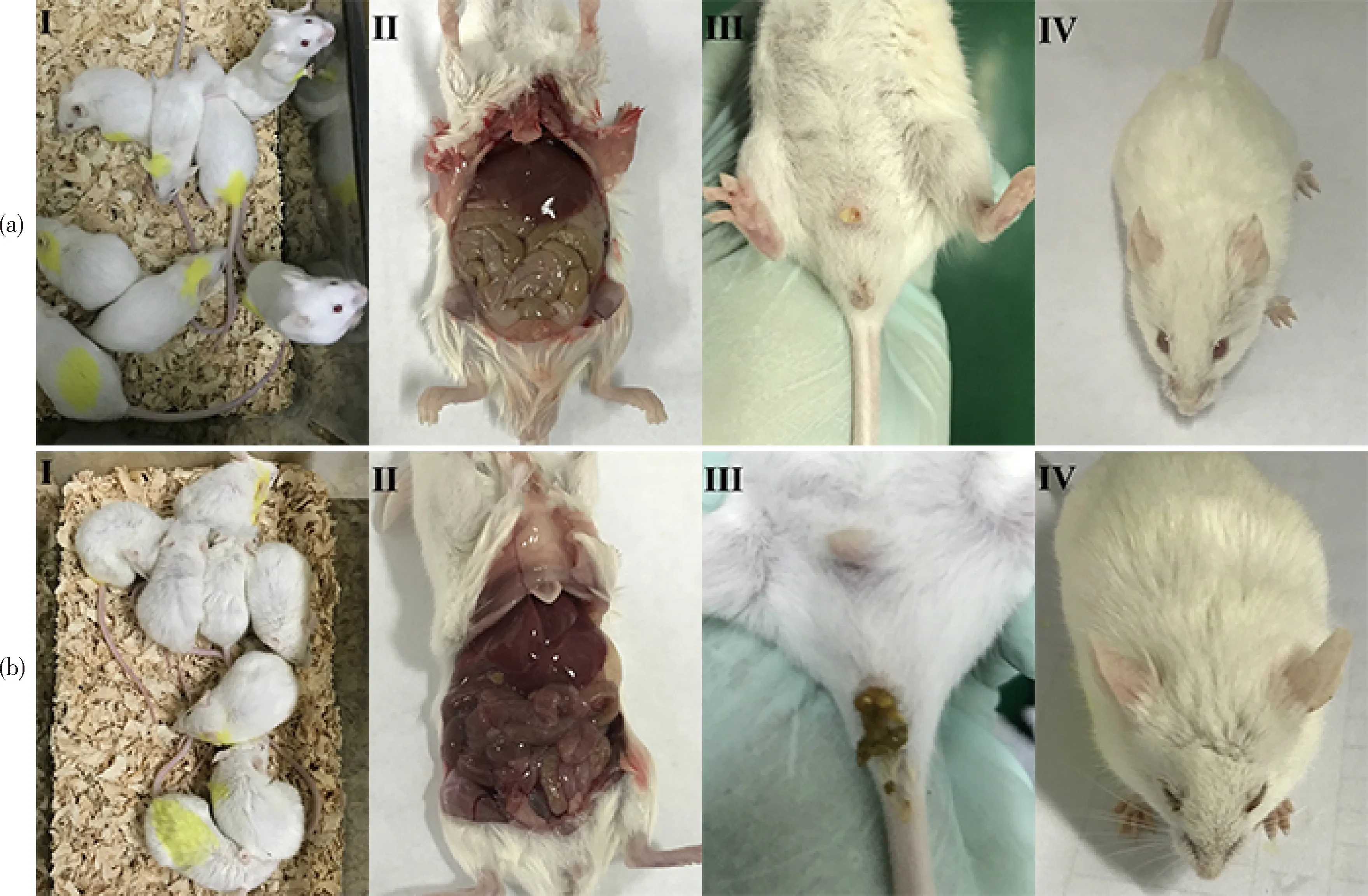
(a)正常对照组;(b)阴性对照组。Ⅰ精神状态;Ⅱ肠道变化;Ⅲ粪便性状;Ⅳ眼睛状态。(a) Normal control group; (b) Negative control group. Ⅰ Mental states; Ⅱ Intestinal changes; Ⅲ Fecal traits; Ⅳ Eye condition.
图1 各组小鼠临床症状变化
Fig.1 Clinical symptoms of mice in different groups
2.2 各组小鼠体重和采食量的变化
将不同处理中腹泻模型小鼠体重变化进行组间比较:在试验前3 天随饲养时间的延长各组小鼠体重均呈上升趋势,但未产生显著性影响(P>0.05),LAB低、中、高剂量组、抗生素组、阴性对照组和正常对照组小鼠体重分别增长了0.68、0.08、0.23、0.79、0.81、1.35、0.84 g。在试验第5 天,与正常对照组相比,LAB低、高剂量组、抗生素组小鼠体重显著降低(P<0.05),LAB中剂量组差异不显著(P>0.05),阴性对照组极显著降低(P<0.01)。试验第7 天,与阴性对照组相比,其他组小鼠体重显著提高(P<0.05),表明LAB能够稳定腹泻小鼠体重变化,腹腔注射E.coliO8后,致使小鼠体重减轻(表2)。

表2 试验期间各组小鼠体重变化Table 2 Changes of body weight of mice in different groups during the whole experimental period g
注:同列数据不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。下表同。
Note: Within the same column, different letters represent significant differences (P<0.05), while the same letters represent no significant differences (P>0.05). The same below.
将不同处理中腹泻模型小鼠平均采食量的变化进行组间比较:试验第1天和第3天各组小鼠平均采食量相对平稳。试验第5天与正常对照组相比,其他组小鼠平均采食量明显下降,试验第7天除阴性对照组外,其他试验组采食量基本处于恢复状态,总体表现为除正常对照组外,阴性对照组的平均采食量最低,LAB高剂量组的平均采食量最高(表3)。
表3 试验期间各组小鼠平均采食量的变化
Table 3 Change of ADFI of mice from different groups during the whole experimental period g
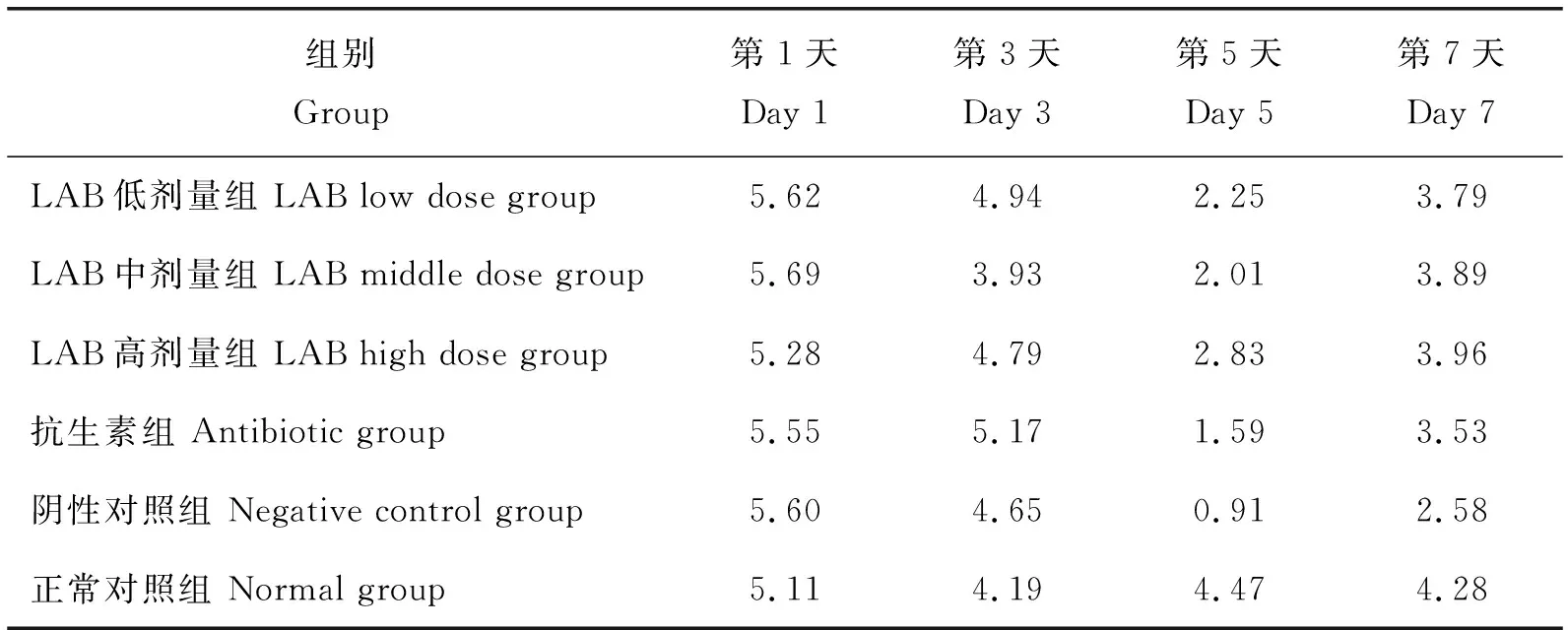
组别Group第1天Day 1第3天Day 3第5天Day 5第7天Day 7LAB低剂量组 LAB low dose group5.624.942.253.79LAB中剂量组 LAB middle dose group5.693.932.013.89LAB高剂量组 LAB high dose group5.284.792.833.96抗生素组 Antibiotic group5.555.171.593.53阴性对照组 Negative control group5.604.650.912.58正常对照组 Normal group5.114.194.474.28
2.3 LAB对小鼠免疫器官指数的影响
将不同处理中腹泻模型小鼠脾脏指数和胸腺指数进行组间比较: LAB高剂量组的小鼠脾脏指数显著高于阴性对照组(P<0.05),其他组有所提高,但未至显著程度(P>0.05);正常对照组的小鼠胸腺指数显著高于阴性对照组(P<0.05),其他组有所提高,但不具有显著性(P>0.05)(表4)。
2.4 LAB对小鼠血清细胞因子水平的影响
将不同处理中腹泻模型小鼠血清细胞因子进行组间比较:与正常对照组相比,阴性对照组IL-4、IL-10 和 TGF-β水平明显降低,而促炎细胞因子IL-6和IFN-γ水平明显提高,且差异具有统计学意义(P<0.01)(表5)。
表4 LAB对小鼠脾脏指数和胸腺指数的影响
Table 4 Effect of LAB on spleen index and thymus index of mice mg/g

组别Group脾脏指数Spleen index胸腺指数Thymus indexLAB低剂量组 LAB low dose group4.28±0.53 ab1.33±0.06 abLAB中剂量组 LAB middle dose group4.62±0.13 ab1.40±0.07 abLAB高剂量组 LAB high dose group5.32±0.30 a1.53±0.11 ab抗生素组 Antibiotic group4.18±0.37 ab1.49±0.09 ab阴性对照组 Negative control group3.46±0.14 b1.24±0.10 b正常对照组 Normal group4.21±0.59 ab1.61±0.12 a

表5 LAB对小鼠血清细胞因子水平的影响Table 5 Effect of LAB on the serum cytokine levels of mice pg/mL
与阴性对照组相比:LAB低、中剂量组IL-4和 TGF-β均显著提高(P<0.05),LAB高剂量组 IL-10极显著提高(P<0.01),抗生素组IL-4、IL-10显著提高(P<0.05),TGF-β极显著提高(P<0.01);与抗生素组相比,LAB高剂量组IL-4无显著性差异(P>0.05),IL-10显著降低(P<0.05),TGF-β显著提高(P<0.05)。与阴性对照组相比:LAB低剂量组IL-6显著降低(P<0.05),LAB低、中剂量组IFN-γ显著降低(P<0.05),LAB中、高剂量组和抗生素组IL-6极显著降低(P<0.01),LAB高剂量组和抗生素组IFN-γ极显著降低(P<0.01);与抗生素组相比,LAB高剂量组IL-6显著提高(P<0.05),IFN-γ无显著性差异(P>0.05)。
上述结果表明:LAB对腹泻小鼠血清中IL-4、IL-10和TGF-β水平影响是随着剂量的增大而提高,IL-6和IFN-γ水平随着剂量的增大而降低;LAB高剂量组可极显著提高IL-4、IL-10、TGF-β(P<0.01),极显著降低IL-6、IFN-γ(P<0.01),较阴性对照组分别提高了51.53%、41.78%、50.47%,分别降低了27.83%、47.12%。因此,LAB对腹泻小鼠血清免疫水平起调节作用。
2.5 LAB对小鼠血清抗氧化指标的影响
将不同处理中腹泻模型小鼠血清抗氧化能力进行组间比较,LAB对小鼠血清中抗氧化指标的影响见表6。由表6可知,与正常对照组相比,阴性对照组小鼠血清中CAT、T-AOC、SOD和GSH-Px活力明显下降,MDA含量明显升高,且差异具有统计学意义(P<0.01)。
与阴性对照组相比:LAB低、中剂量组CAT、SOD和GSH-Px均显著提高(P<0.05),LAB高剂量组极显著提高(P<0.01);不同剂量LAB组 T-AOC 显著提高(P<0.05),抗生素组CAT和GSH-Px显著提高(P<0.05),T-AOC和SOD极显著提高(P<0.01)。与抗生素组相比:LAB高剂量组CAT、T-AOC和SOD无显著性差异(P>0.05);GSH-Px显著提高(P<0.05)。
与阴性对照组相比:不同剂量LAB组MDA显著降低(P<0.05),抗生素组极显著降低(P<0.01);LAB高剂量组与抗生素组无显著性差异(P>0.05)。
上述结果表明,致病性E.coliO8所致腹泻小鼠灌胃LAB对血清CAT、T-AOC、SOD和GSH-Px活力起到了提高的作用,对MDA含量起到了降低作用。LAB高剂量组可极显著提高CAT、T-AOC、SOD和GSH-Px活力(P<0.01),显著降低MDA含量(P<0.05),较阴性对照组分别提高了44.43%、24.69%、39.57%、53.24%,MDA含量下降了24.78%。
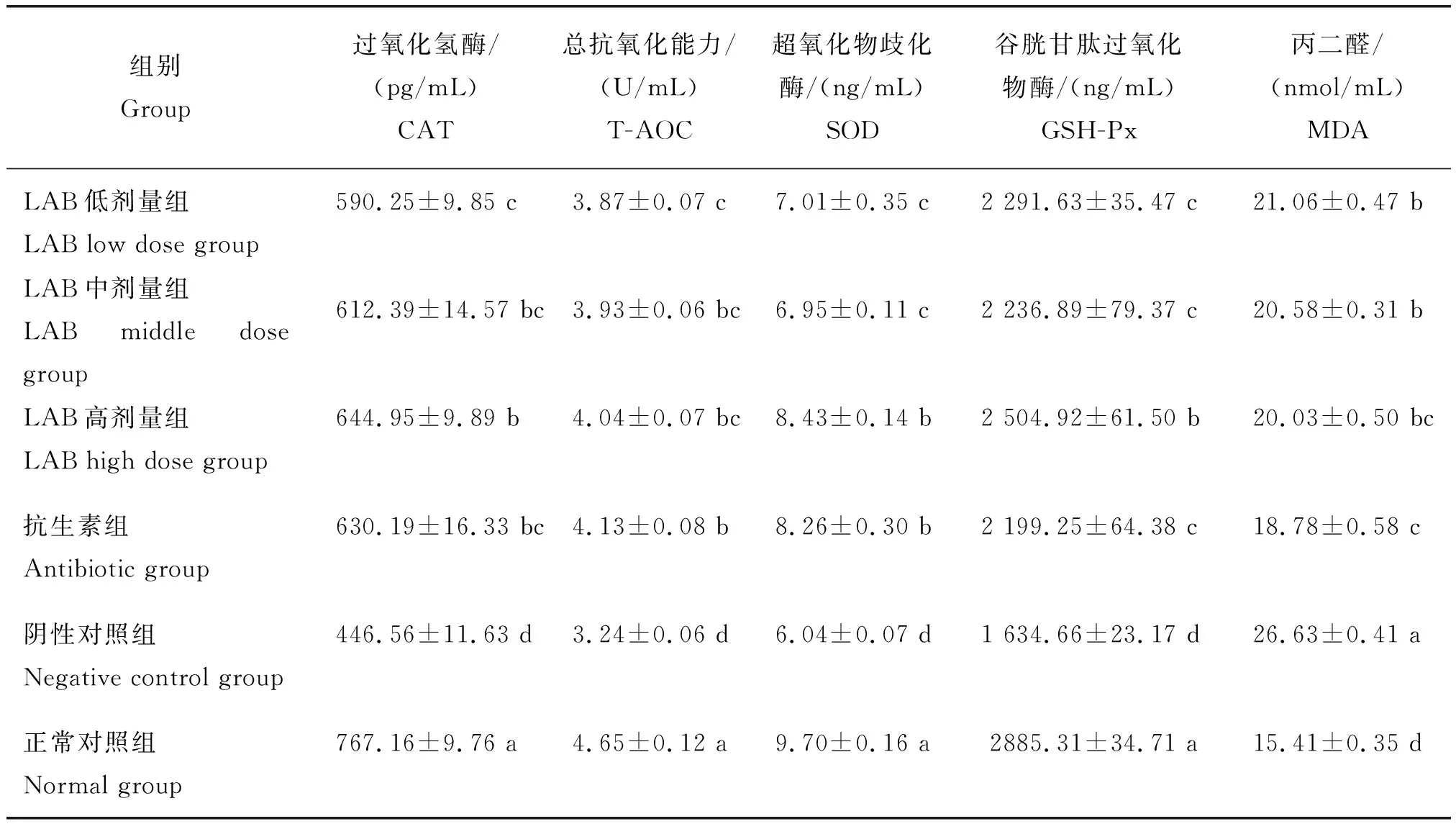
表6 LAB对小鼠血清抗氧化指标的影响Table 6 Effect of LAB on serum antioxidant index of mice
3 讨 论
3.1 LAB对腹泻小鼠生长性能的影响
已有研究表明使用发酵乳可降低犊牛的死亡率和腹泻发病率,并改善了其生长特性、体内微生物及血液的指标表现[13]。饲粮中添加1 000 mg/kg LAB能够显著提高肉鸡的增重并降低死亡率, LAB改善了肉鸡肠道健康状况,导致犊牛采食量增大,体重增加[14]。本试验结果显示:试验前期或预防期(处理后的前3 d),各组小鼠体重均有缓慢增加,但组间差异不显著;在试验第5天,LAB中剂量组小鼠体重与正常对照组相比差异不显著,其他组显著降低,阴性对照组极显著降低;试验第7天,与阴性对照组相比,其他组显著提高(P<0.05),说明LAB对腹泻小鼠的生长性能具有恢复作用。另外,注射致病性大肠杆菌可能导致小鼠肠道菌群失调,引致小鼠采食量下降。
3.2 LAB对腹泻小鼠免疫器官指数的影响
动物免疫器官包括外周免疫器官和中枢免疫器官2类:外周免疫器官包括脾脏、淋巴结和黏膜相关淋巴组织;中枢免疫器官包括胸腺和骨髓等,其中胸腺是生物体最重要的中枢免疫器官[15]。哺乳动物免疫细胞主要分布在脾脏和胸腺,脾脏是成年动物最大的免疫器官,在机体细胞免疫和体液免疫中发挥着至关重要的作用;胸腺是诱导淋巴细胞增殖分化成免疫活性细胞的场所,是构建细胞免疫功能的车间[16]。因此,以脾脏指数和胸腺指数作为基本的免疫指标可在一定程度上反映机体的免疫功能。当免疫功能受到抑制或激发时,脾脏细胞和胸腺细胞会相应萎缩或增殖[17]。已有研究表明LAB对免疫器官发育存在着一定促进作用,能够促进免疫细胞和器官的生长发育,刺激机体产生抗体,加强巨噬细胞的作用,从而加强肠道与其他组织对病原体的抵抗力,提高动物免疫机能[18]。本试验结果显示,灌胃0.3 mL活菌数为1×1010CFU/mL的LAB可显著提高脾脏指数,对腹泻小鼠胸腺指数具有随着LAB剂量的增加而提高趋势。因此,推断LAB可能是促进腹泻小鼠脾脏内组织细胞和胸腺中淋巴细胞的生长发育,进而提高细胞数目,增强机体免疫力。
3.3 LAB对腹泻小鼠血清细胞因子水平的影响
益生菌可不同程度地诱导T细胞分化和细胞因子产生[19]。某些益生菌可诱导Th2细胞的分化,引起抗炎细胞因子IL-10、IL-4和转化生长因子TGF-β的表达[20]。LAB对抗炎细胞因子和促炎细胞因子具有不同调节能力以及辅助性T细胞Th1和Th2平衡的能力[21]:Th1的免疫应答产生促炎细胞因子,并参与对细胞内感染的细胞免疫;Th2型的免疫应答产生多种抗炎细胞因子并促进对细胞外病原体的体液免疫[22];益生菌与美沙拉嗪联合应用时大鼠血清中IL-6和IFN-γ等促炎因子显著降低[23]。本试验结果表明,与阴性对照组相比,正常组血清中IFN-γ和IL-6水平极显著降低,LAB各剂量组相对于正常对照组上升,但极显著低于阴性对照组,说明LAB各剂量组腹泻小鼠的免疫功能有所提高。di Giacinto等[24]研究发现,在小鼠模型试验中,益生菌通过诱导固有层单核细胞产生IL-10来改善结肠炎。IL-10是重要的抗炎性细胞因子,能抑制T细胞过量产生IFN-γ、IL-6等促炎性细胞因子,因而防止过度免疫应答对机体引起的危害。本试验中,与阴性对照组相比,正常对照组组小鼠血清中IL-4、IL-10和TGF-β水平极显著提高,LAB各剂量组相对于正常对照组下降,但显著高于阴性对照组,说明LAB可以减少IL-4、IL-10和TGF-β水平的下降,与di Giacinto研究发现益生菌促进血清IL-10水平的提高相一致。因此,E.coliO8腹泻模型紊乱了小鼠Th1和Th2细胞的平衡,通过LAB干预治疗可抑制Th1类细胞生成过量的炎性细胞因子,促进Th2细胞生成大量抗炎细胞因子,从而维持腹泻小鼠体内Th1和Th2细胞平衡状态。
3.4 LAB对腹泻小鼠血清抗氧化指标的影响
近年来,LAB抗氧化性能的研究引起广泛重视,但相关研究报道并不多。LAB抗氧化性能的研究包括体内和体外抗氧化试验,体内抗氧化试验主要是饲喂抗氧化剂,检测其组织和血清中的抗氧化酶。体外抗氧化试验主要通过检测LAB的自由基清除能力等试验来评价LAB的抗氧化活性。T-AOC 抗氧化能力包括酶促与非酶促2 个体系,这2 个体系之间相互协同,发挥抗氧化的作用[25]。SOD、GSH-Px和CAT是抵抗氧化应激的第一道防线,可以抑制自由基的形成,防止活性氧(ROS)的氧化损伤[26]。SOD能够将超氧自由基转化为H2O2,H2O2可被CAT和GSH-Px分解为O2[27]。MDA是一种脂质过氧化物,可以反映脂质过氧化水平,是引起氧化应激的最重要机制之一,MDA作为有毒脂质过氧化终产物一直被认为是检测脂质过氧化水平的指标[28]。因此,MDA含量可以反映氧化损伤最为经典也是最为有效的指标。因此,本试验分别测定了LAB对腹泻小鼠血清中T-AOC、SOD、GSH-Px和CAT活性和MDA含量的影响,结果表明:与正常对照组相比,腹腔注射致病性E.coliO8后小鼠血清中T-AOC、SOD、GSH-Px和CAT活性极显著降低,MDA含量极显著上升;LAB可显著减少T-AOC、SOD、GSH-Px和CAT活性的降低,显著减少MDA含量的上升。LAB水解蛋白质主要原理是它在发酵过程中产生酶类,使底物蛋白等大分子得以降解,从而可以改善品质、营养、抗氧化性能[29]。黄珊珊等[30]研究发现,与衰老模型对照组相比,灌胃LAB及正常组的小鼠血清和肝脏中T-AOC、SOD、GSH-Px和CAT活性明显升高,MDA含量明显降低,表明LAB可能通过提高小鼠抗氧化能力而改善机体健康状况,与本试验结果一致。另有研究显示饲粮中添加0.1%的LAB和酵母菌复合制剂可显著提高肉仔鸡的抗氧化能力[31]。本试验LAB组腹泻小鼠体内抗氧化效果明显优于抗生素组,因此,推测LAB可通过小鼠的氧化还原状态,维持良好的健康状况。此外,LAB显著降低了血清中MDA含量,说明小鼠体内脂质过氧化程度降低,因而维持机体内环境的相对稳定。
4 结 论
本试验利用LAB灌胃E.coliO8所致腹泻小鼠,探讨了LAB对腹泻小鼠生长性能、免疫机能及抗氧化能力的影响。试验结果显示,灌胃0.3 mL活菌数为1×1010CFU/mL的LAB菌液对腹泻小鼠生长性能具有恢复作用,且可显著提高脾脏指数,胸腺指数有增加趋势,并通过维持Th1和Th2细胞的平衡来调节血清免疫指标,还能缓解致病菌引起的机体氧化损伤。

