氮掺杂Cu2O的制备及其可见光催化性能
强义凯,王新智,杨迎春,叶芝祥
(成都信息工程大学 资源环境学院,成都 610225)
0 引 言
近年来, 半导体光催化氧化因其操作简便、反应条件温和、可减少二次污染等特点在环境治理领域日益受到人们的重视[1-2].Cu2O材料很早应用于半导体材料,其禁带宽度范围为 2~2.2 eV[3],能吸收波长小于600 nm的可见光[4],在光催化材料方面受到人们的广泛关注[5-6]。近年来对其改性研究的相关文献也逐渐增多。
蒋耀[7]对掺杂B、C、N非金属元素和Sn、Ag等金属元素氧化亚铜的改性进行了理论分析,非金属元素掺杂会在价带顶引入较大的p电子,能够解决Cu2O直接跃迁的问题,而Ag的掺杂不会引入杂质能级,还会减小其禁带宽度。王冉[8]等通过沉积-沉淀法制备出Cu2O-Ag-AgBr/MA等离子体的诱导可见光催化材料,提高Cu2O-Ag-AgBr/MA催化性能。在元素周期表中N与O位置相邻,N元素替换Cu2O中O的位置后对其晶格变动的影响较小。濮春英[9]等也采用射频磁控溅射的方法于不同温度条件下制备氮掺杂的氧化亚铜薄膜,并认为在氧化亚铜中掺杂N能使价带顶下移、导带底上移,从而大幅度增加其禁带宽度,并指出N在价带顶附近的2p态密度大导致氮掺杂氧化亚铜薄膜的允许的带隙直接跃迁。李洪婧等[10]在无氧环境中制备出氮掺杂氧化亚铜,反应过程中氧原子均来自溅射靶,可以有效的避免氧化铜的产生。
本工作以提高Cu2O的光催化性能为目的,通过水合肼还原Cu2+的方法制备了N掺杂Cu2O的光催化材料,利用多种方法对其进行表征,并通过降解甲基橙模拟废水对其光催化活性进行研究。
1 实 验
1.1 N掺杂Cu2O的制备
向50 mL 0.1mol/L CuSO4·5H2O溶液中加入一定量0.01 mol/L CO(NH2)2,磁力搅拌下混合均匀;再加入10mL 1 mol/L NaOH,继续搅拌,溶液由蓝色变为蓝绿色絮状沉淀,直至变成墨绿色沉淀;再加入5mL 1 mol/L N2H4·H2O进行还原,磁力搅拌下溶液迅速变成浅绿色,然后变成黄绿色,继续搅拌直至溶液完全变成红棕色悬浊液;抽滤并洗涤沉淀,将沉淀在氮气保护下干燥,经研磨后即得成品。由于掺杂量的多少对光催化活性有较大的影响[11-12],故根据上述的流程,按照N元素与Cu元素摩尔比为0.8%、1.6%、2.8%、3.2%和5.2%将尿素与硫酸铜溶液混合均匀,制备不同掺N量的改性Cu2O光催化剂材料。分别记为NC0.8%、NC1.6%、NC2.8%、NC3.2%和NC5.2%。
1.2 样品的表征
采用岛津UV-2550型紫外-可见分光光度计,以BaSO4为参比,获得样品的固体紫外可见漫反射光谱。采用岛津RF-5301PC型分子荧光光度计获得了样品的光致发光光谱。测试时将样品铺满粉末样品盘,用石英玻璃板压平。使用岛津XRD-6100型X射线衍射仪对样品的晶型和粒径进行分析。工作条件如下:铜靶X射线源(Cu Kα,λ=0.154056 nm)电压40.0 kV,电流40.0 mA,步长0.02°,扫描速度为4.0000°/min,2θ扫描范围为10.0~80.0°。采用岛津英国KRATOS ANALYTICAL公司生产的AXIS Ultra DLD型X射线光电子能谱分析仪分了样品的表面元素状态。采用Thermo Fisher Scientific公司生产的FTIR-Nicolet is50型傅里叶变换红外光谱仪,以KBr为载体压片,得到样品的红外光谱图。
1.3 光催化活性评价
采用功率为500 W,波长为400~700 nm的卤钨灯作为可见光光源,以甲基橙作为目标降解物,加入夹层圆柱形玻璃反应器中,光反应过程中在夹层玻璃中通入冷凝水,以使反应液的温度保持衡定。具体步骤为:将50 mL一定浓度的甲基橙溶液置于反应器中,加入0.04g催化剂样品,磁力搅拌构成悬浮体系,避光搅拌1h达到吸附平衡后开启光源,反应每隔一定时间取样,用0.45微米滤膜过滤后取滤液进行检测。用UV-2550型紫外可见分光光度计测定溶液在330~660 nm范围内的吸光度值,读取其最大吸收值并计算脱色率;用耶拿Muliti 2100型TC/TN分析仪,计算溶液有机碳(TOC)值,测定TOC去除率。通过脱色率和TOC去除率来反映催化剂在可见光下的光催化活性。
2 结果与讨论
2.1 UV-vis DRS吸收光谱
图1为未掺杂和N掺杂Cu2O的吸收光谱吸收光谱图。由图1可见,Cu2O对500~600 nm之间的可见光有很强的吸收,氮掺杂Cu2O的吸收边带均发生了明显的蓝移,且对400~500 nm范围的光的吸收也得到增强。根据(ahv)2对光量子能量(hv)变化关系[13]得到图1(b),估算出Cu2O的禁带宽度为2.03 eV,而氮掺杂Cu2O材料的禁带宽度为(2.27±0.12)eV,其中NC1.6%样品禁带宽度增加了约0.33 eV。说明氮掺杂会使Cu2O的禁带宽度增加,从而引起空穴载流子的有效质量增加。
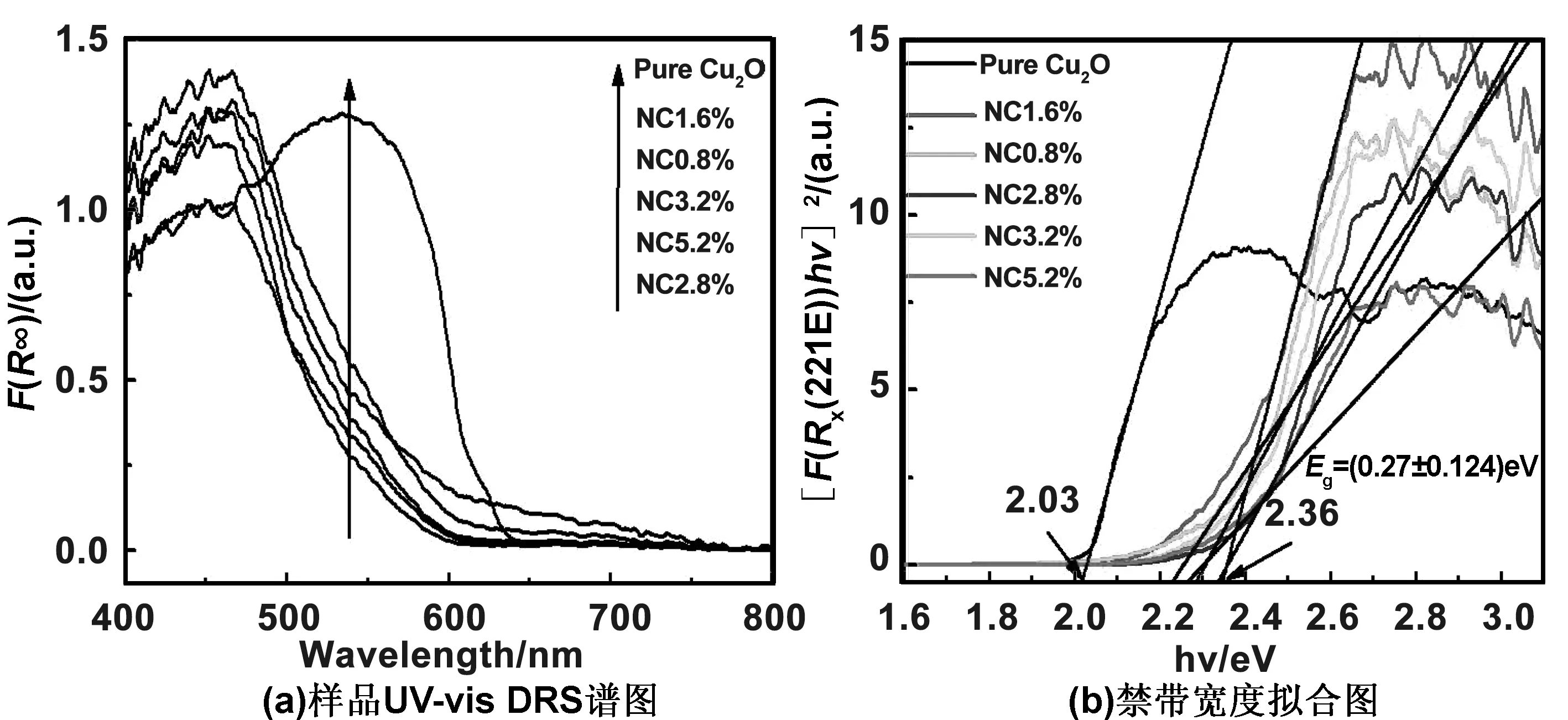
图1 (a)样品UV-vis DRS谱图和(b)禁带宽度拟合图
2.2 PL分析
图2为各样品荧光发射(PL)光谱图。由图可知,在激发波长下各样品在470 nm附近均出现一个较强的发光峰,且N掺杂Cu2O材料的发光峰强度较纯Cu2O弱。相同激发光条件下,发光峰的强度越弱表明晶体缺陷态水平越低。说明N掺杂后,能够促使光生载流子(光生电子和光生空穴)的有效分离[14],从而提高其光催化活性。
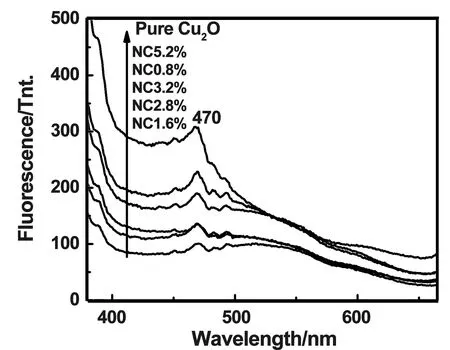
图2 样品PL谱图
2.3 XRD分析
图3为NC0.8%、NC1.6%与纯Cu2O的XRD结果。由图可知,Cu2O的特征峰与标准pdf卡片基本一致,且峰形尖锐,未出现Cu或CuO的衍射峰。而N掺入后,衍射峰强度明显降低,且存在宽化现象,说明氮的掺入降低了Cu2O的晶化程度。由谢乐公式[15]和晶格畸变系数公式计算出,掺N前后Cu2O粒径减少了约13 nm,晶格畸变系数增加了约0.1。这是N替代O的位置引起Cu2O晶格畸变而影响了材料的结晶行为[16]。
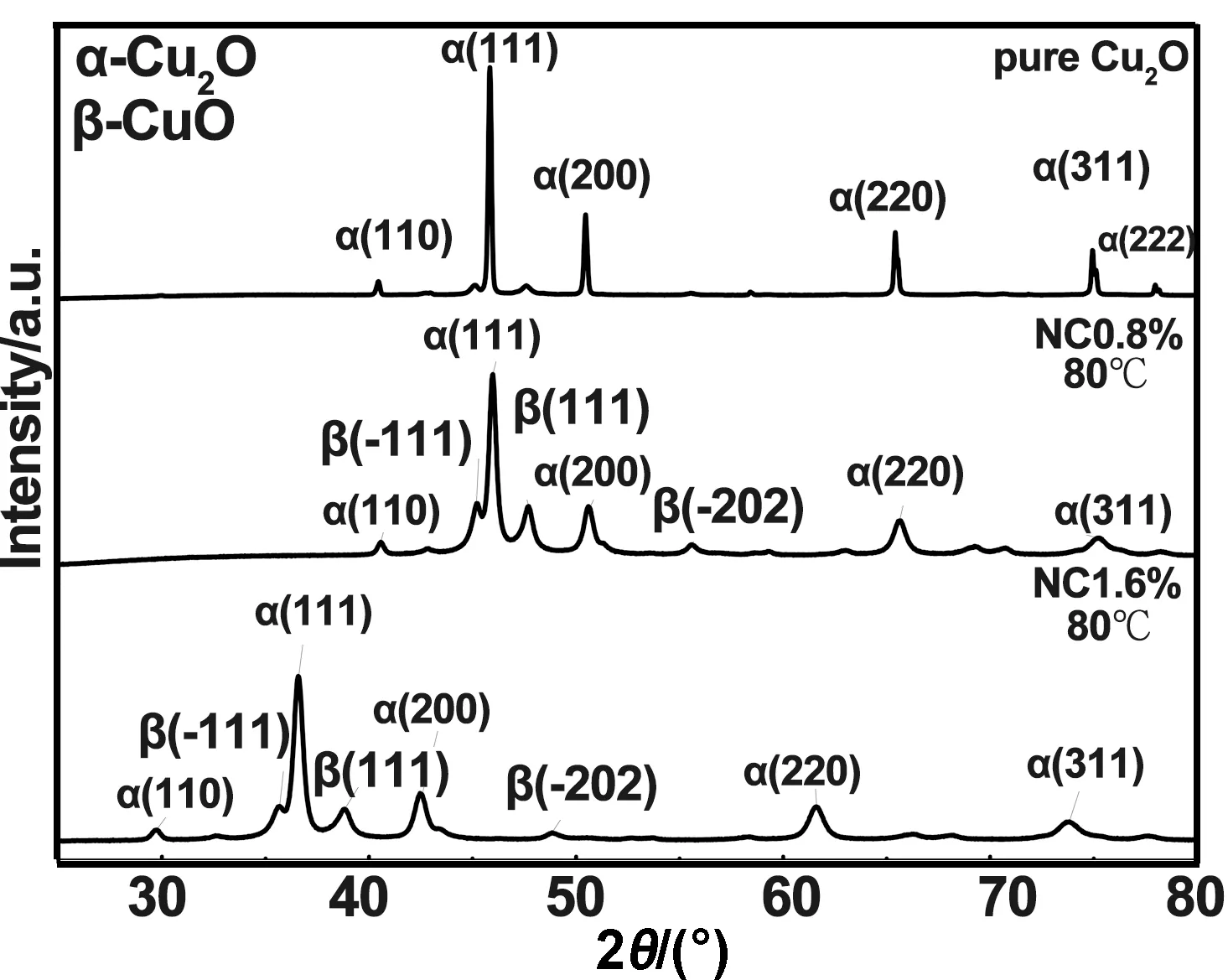
图3 样品XRD图
2.4 FT-IR分析
对未掺杂及N掺杂Cu2O进行傅里叶变换红外光谱分析,结果如图4。纯Cu2O在500~750 cm-1间出现了特征吸收峰[18],掺氮Cu2O出现四个吸收峰。其中3 250~3 500 cm-1特征吸收峰为催化材料表面的水分子伸缩振动产生的O-H键峰;1 500~1 750 cm-1出现峰是水合肼反应后产生的N-H键伸缩振动峰;1 000~1 250 cm-1的吸收峰是N-Cu键伸缩振动引起的;750~1 000 cm-1的特征吸收峰为Cu-N-O间的伸缩振动峰产生的[19]。
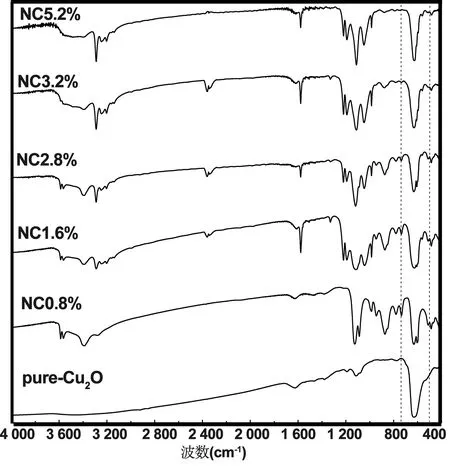
图4 样品FT-IR谱图
2.5 XPS分析
图5为Cu 2p、O 1s、N 1s与标准C 1s峰位(284.6 eV)校正后的XPS能谱。从图5可知,样品表面主要存在Cu、O、N、C、S这五种元素。可以判断Cu和O元素来源于Cu2O和CuO;N、C元素主要来源于尿素;S元素则是由原料CuSO4引入。由图6可知,Cu 2p轨道电子的XPS能谱出现5个峰,对应的电子结合能由高到低依次为962.5、954、944、941.2和934 eV,其中962.5 eV和944 ev的结合能分别归属于Cu(Ⅱ)中Cu 2p1/2和Cu 2p3/2,954 eV和934 eV的结合能分别归属于Cu(Ⅰ)中Cu 2p1/2和Cu 2p3/2。O 1s轨道电子的XPS能谱出现两个峰,对应结合能分别为531.7、529.9 eV,说明材料中O元素除了氧化物中负二价的存在形式外还有另一种存在形式。在N 1s轨道电子的XPS能谱中出现401.6 eV和399.2 eV两个峰。通过以上元素结合能峰位可以分析,送样时材料已有部分被氧化成了CuO,且N的掺杂引起了氧化物中O元素产生了新的化合价,推断N可能是以氧化取代型掺杂进入氧化物中[17]。
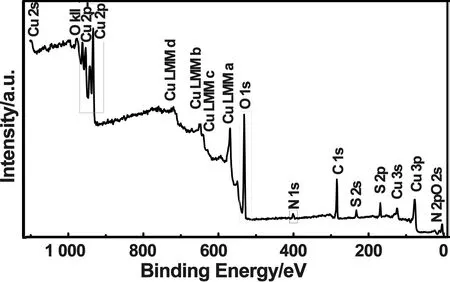
图5 样品XPS谱图
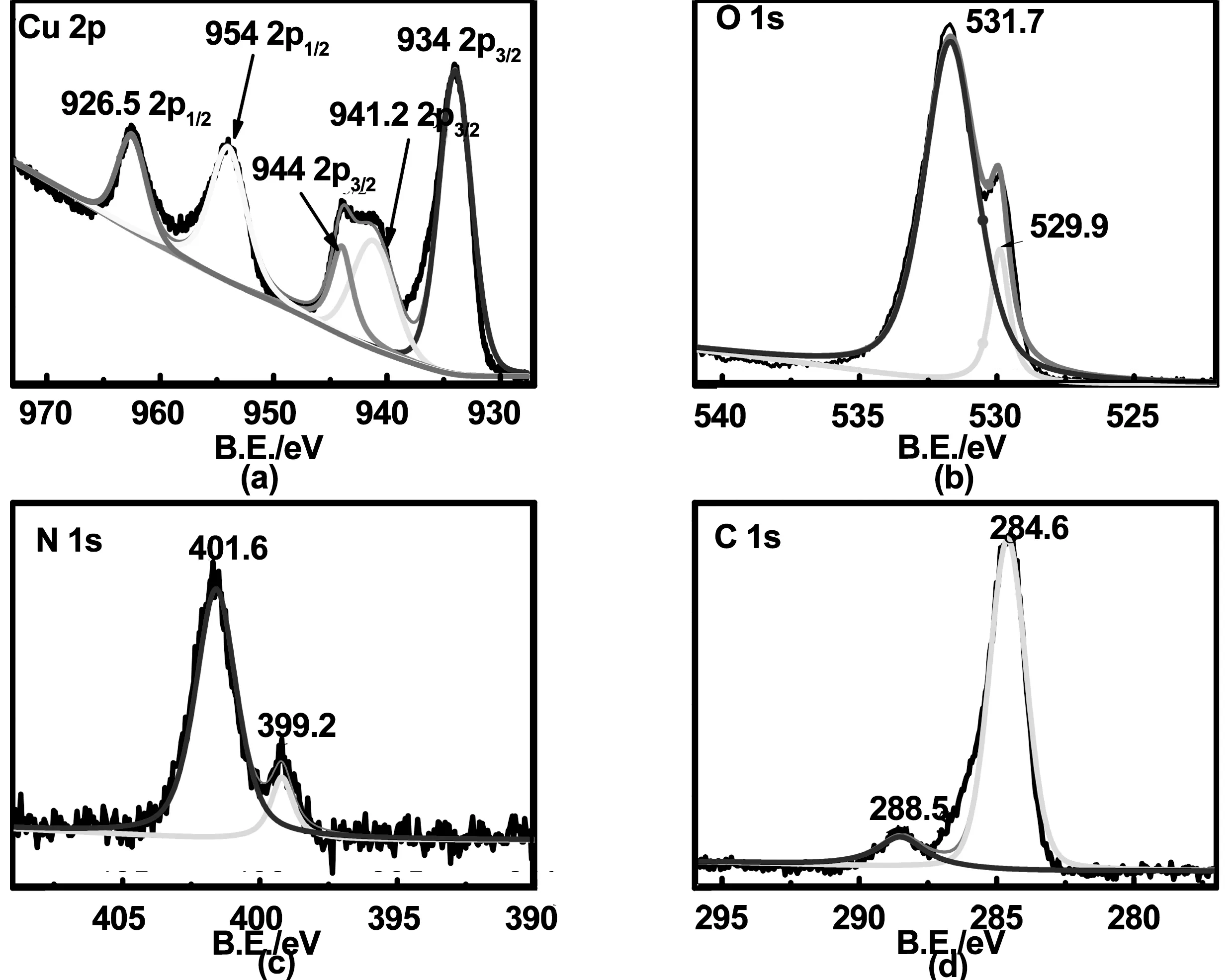
图6 样品表面主要元素XPS能谱
2.6 可见光催化性能
未掺杂和N掺杂Cu2O样品的可见光催化活性测试结果如图7、8所示。从图中可以看出,甲基橙在光照条件下具有一定稳定性。N掺杂Cu2O的催化活性明显高于纯Cu2O,其中NC1.6%的样品效果最好,3h后脱色率达到94.8%,TOC去除率达75.7%。但掺氮量高于1.6%的样品却表现了相对较低的催化效率。这是由于过量的杂质离子在合适的情况下也能变成光生电子-空穴的复合中心[20],使Cu2O材料表面的复合率升高,导致载流子向界面的传送过程受阻,抑制了Cu2O的光催化性能。因此后续试验将选择NC1.6%的材料进行。
将催化材料循环使用7次后通过微孔滤膜过滤回收,并用无水乙醇、去离子水洗涤数次,放入干燥器中自然烘干,进行重复实验,得到图9。从图中可以看出,材料使用7次之后,脱色率和TOC去除率都有所下降,但保持了一定的光催化活性。催化剂失活有几个原因[21],光催化产生的中间产物或终产物沉积在材料表面,或中间产物的吸附性能优于反应物造成竞争吸附,降低了底物浓度,消耗活性自由基,甚至在悬浆体系中催化剂微粒经过长时间的使用后,微晶粒子聚合引起催化剂尺寸变大、比表面积减小等原因都将导致导致催化剂活性下降或失活。
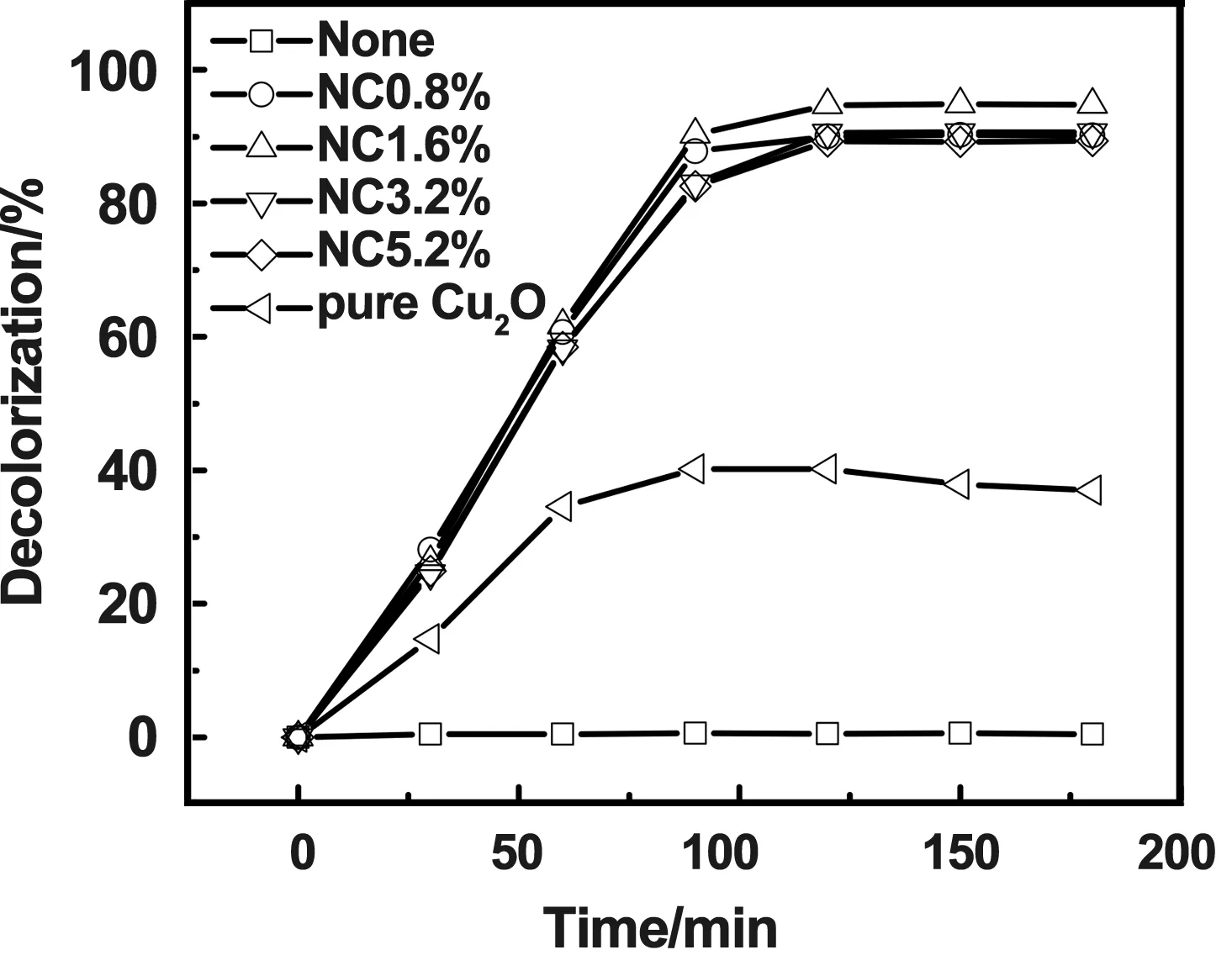
图7 掺氮量对脱色率的影响
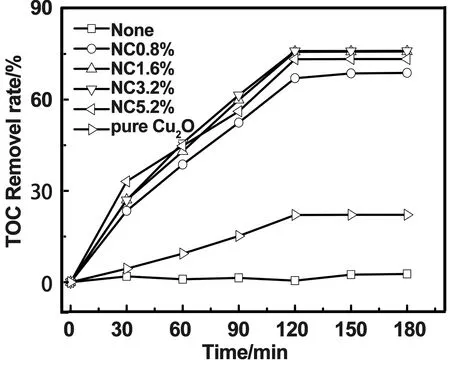
图8 掺氮量对TOC去除率的影响
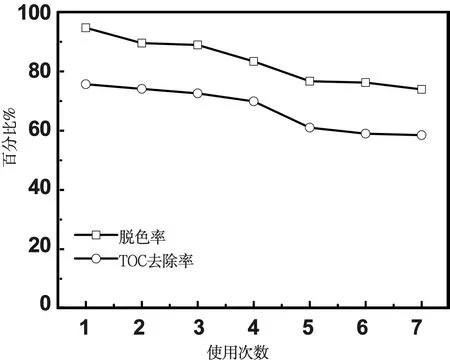
图9 材料循环使用对脱色率和TOC去除率的影响
3 结 论
通过水合肼在碱性条件下还原硫酸铜-尿素混合物的方法成功制备了N掺杂Cu2O光催化剂材料。光催化降解甲基橙模拟废水表明,N掺杂Cu2O均表现出比未掺杂Cu2O更高的可见光催化活性。并且,N的摩尔掺杂量为1.6%的材料表现出色。通过一系列表征手段分析,N的引入能够改变Cu2O对光的吸收特性,导致带隙能增加,可以有效促使光生载流子的分离,降低光生电子-空穴对的复合几率,有效提高材料的光催化活性。对材料进行重复使用实验发现材料在使用数次后,仍保持一定的催化活性。

