我国典型土壤中铜对白符跳(Folsomia candida)的毒性阈值及其预测模型
李 星, 林祥龙, 孙在金, 赵 龙, 何 飞, 韩 颖*, 侯 红*
1.西南科技大学生命科学与工程学院, 四川 绵阳 621010 2.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 3.云南农业大学资源与环境学院, 云南 昆明 650201
Cu是广泛存在于自然界中的重金属元素之一,是生物生命活动的必需元素,但过量的Cu会对生态受体的生长发育造成威胁,甚至导致其死亡[1-2]. 随着采矿冶炼、污泥倾倒、农药化肥的使用、电子废弃物拆解和畜粪入田等人类活动的加剧,土壤Cu污染日益严重[1]. 2014年《全国土壤污染状况调查公报》显示,Cu的点位超标率为2.1%[3].
跳虫是典型的土壤无脊椎动物,广泛分布于土壤中,在土壤生态系统中扮演关键角色(分解有机质和促进养分循环等)[4-5]. 在污染土壤中白符跳的暴露途径也可指示土壤环境的质量,是一种重要指示性动物之一[6]. 研究表明,与蚯蚓相比,跳虫对污染物毒性响应更敏感[5]. 跳虫种类繁多,其中,白符跳(Folsomiacandida)具有生长周期短、繁殖快等优势,在生态毒理试验中应用较为广泛且技术较为成熟,而且已被国际标准化组织(ISO)规定为模式生物[6].
重金属毒性阈值的研究可以为土壤重金属生态基准值的建立提供科学依据. 目前,为建立我国土壤Cu的生态基准值,学者们[1,3,7]已经广泛开展了关于我国土壤中Cu对植物(西红柿、白菜、小麦、油菜等)、无脊椎动物(赤子爱胜蚓)和微生物(发光细菌和硝化细菌等)毒性阈值的研究,积累了大量Cu的毒理数据. 但国内有关Cu对白符跳毒性阈值的研究非常缺乏,并且已有研究多采用单一类型的土壤,没有考虑土壤理化性质的影响[8]. 众所周知,自然界土壤类型复杂多样,土壤理化性质(pH、有机质、土壤质地、阳离子交换量和铁锰铝氧化物等)是影响重金属毒性阈值的关键因子[1,9],研究不同类型土壤中重金属毒性阈值差异并基于土壤理化性质特征建立重金属毒性阈值的预测模型是科学建立土壤重金属生态基准值的关键[1]. 虽然国外学者已经开展了较多的关于Cu对土壤白符跳毒性阈值的研究[10-13],但研究[2,14-15]表明,由于土壤理化性质的巨大差异(如土壤有机质含量和矿物类型等),导致基于国外土壤开展毒性试验获得的毒性阈值数据和预测模型无法直接应用到我国.
该研究以白符跳为受试生物,参照ISO标准方法指南[6],以个体水平的死亡率和繁殖率为试验终点,选取我国9种有代表性的理化性质差异明显的土壤作为供试土壤,研究土壤外源添加Cu对白符跳的毒性阈值并建立毒性的预测模型,以期为我国土壤Cu生态基准和环境质量标准的制订完善提供依据和参考.
1 材料与方法
1.1 供试土壤
选取并采集9种理化性质各异的0~20 cm表层农田土壤作为供试土壤:江西红壤、安徽黄棕壤、重庆紫色土、云南黄红壤、湖南水稻土、山东潮土、黑龙江黑土、新疆灰漠土、陕西垆土. 采集的土壤经室内自然风干、剔除植物根系及石块后,过2 mm筛,进行土壤农化分析[16-17]:采用pH计测定土壤pH(土水比为1∶2.5);采用重铬酸钾氧化-外加热法测定土壤中w(OM);采用EDTA-铵盐快速法测定阳离子交换量(CEC);采用中和滴定法测定w(CaCO3);采用吸管法测定土壤中w(黏粒);经湿式消解法(HCl-HNO3-HF-H2O2)前处理后,测定w(TFe)(TFe为总Fe)、w(TMn)(TMn为总Mn)、w(TAl)(TAl为总Al)和w(CuBT)(CuBT为背景总Cu);采用草酸-草酸铵浸提-邻菲罗林比色法测定土壤中w(FeOX)(FeOX为非晶质氧化铁)、w(MnOX) (MnOX为非晶质氧化锰)和w(AlOX)(AlOX为非晶质氧化铝).
1.2 供试白符跳
白符跳由中国科学院南京土壤研究所提供,已在笔者所在课题组实验室饲养驯化超过3 a.
参照ISO标准指南[6],白符跳饲养在培养皿(90 mm×13 mm)中,其底部铺有约0.5 cm厚的培养基(活性炭与熟石膏质量比为1∶9,加去离子水搅拌均匀待其凝固成形,放置3 d后使用). 利用安琪干酵母作为白符跳的食物,使用人工气候箱控制饲养温度为(20±1)℃,光照与黑暗比为16 h∶8 h(光照强度为400~800 lx),空气湿度为75%. 每隔1周打开盖子补足空气,必要时为培养基补充适量去离子水和适量食物. 饲养期间每隔两个月更换一次培养基,而且要及时清除培养基表面的发霉食物残渣和死亡的白符跳尸体,保持培养基表面清洁湿润.
为降低不同白符跳虫龄和个体大小差异对试验的影响,试验前白符跳需进行同龄化培养. 参照ISO标准指南[6],将培养皿中的白符跳成虫移入新制备的培养皿中,加入少量(约5 mg)干酵母,在人工气候箱中培养,待白符跳在培养基表面产卵并孵化出幼虫后,移走成虫,3 d后将幼虫转移到新培养皿中,继续培养7~9 d,得到可用于正式毒理试验的10~12 d大小的白符跳. 同龄化期间培养条件与饲养条件相同.
1.3 土壤外源Cu添加
土壤中外源Cu以二水合氯化Cu(CuCl2·2H2O,优级纯)水溶液的方式添加,以只添加去离子水的土壤为对照组. 根据pH和w(OM)的差异设置浓度组,每个浓度组用土200 g. 江西红壤、安徽黄棕壤、重庆紫色土、云南黄红壤中添加的w(TCu)(TCu为土壤总Cu)分别为50、100、200、400和800 mgkg,湖南水稻土、山东潮土、黑龙江黑土、新疆灰漠土和陕西垆土中分别为100、200、400、800和 1 600 mgkg. 将土壤充分搅拌均匀,以去离子水将土壤水分调整到最大可持水量的55%~60%. 将制备的土壤盛于开口的自封袋中,在温室内进行为期3周的老化(25 ℃,黑暗条件),期间通过称重法每隔3 d补充去离子水以维持土壤湿度.
1.4 白符跳毒性试验
称取30 g老化后的湿土置于100 mL的有机玻璃杯中,加入10只10~12 d大小的白符跳和2 mg干酵母,盖上盖子放在人工气候箱中培养28 d,培养条件与白符跳饲养条件相同. 试验期间,从第2周起每周添加1次2 mg干酵母(开盖添加食物的过程中玻璃杯中的空气也得到更新),并通过称重法补充少量去离子水. 试验结束后,将玻璃杯中的土倒入200 mL的烧杯,加入150 mL自来水和几滴英雄牌蓝色墨水,用玻璃棒轻轻搅动土壤,待存活的白符跳成虫和繁殖的幼虫浮到水面后用相机拍照,然后利用Image J软件[18]中的细胞计数功能对照片中的白符跳存活和繁殖数量进行计数.
1.5 土壤中w(Cu)的测定
采取老化土样,风干后过0.25 mm筛备用.w(CuCa)(CuCa为CaCI2溶液提取的Cu)的分析测定:参考Bur等[19]的方法,称取2 g过0.25 mm筛的土壤置于50 mL塑料离心管中,加入20 mL 0.01 molL的CaCI2溶液,水浴振荡2 h (25 ℃,200 rmin)后,3 000 rmin下离心10 min. 将上清液用0.45 μm的醋酸纤维滤膜过滤后,用1%的稀硝酸稀释,采用电感耦合等离子体质谱仪(ICP-MS,Agilent7500,美国安捷伦科技有限公司)测定滤液中ρ(Cu).w(TCu)的测定:参考FAN等[17]的方法,称取0.1 g土样,加入HF-HClO4-HNO3(体积比为3∶1∶1)后进行微波消解(180 ℃,45 min),采用电感耦合等离子体发射光谱仪(ICP-OES,RIS Advantage,美国安捷伦科技有限公司)测定溶液中ρ(Cu),该消解和测定过程使用国家一级标准物质(GBW-07410)作为质控.
1.6 数据处理与分析
采用SigmaPlot 12.5软件中的Logistic曲线方程[20]推导白符跳存活的半致死浓度(LC50)、白符跳繁殖的半数效应浓度(EC50)和上述阈值的95%置信区间:
y=k[1+(xx0)s]
式中:y为白符跳幼虫数量或成虫数量,只;x为w(TCu)实测值或w(CuCa),mg/kg;k为对照组中白符跳幼虫数量或成虫数量,只;s为斜率参数;x0为LC50或EC50值,mg/kg. 使用SPSS 22.0软件,利用皮尔逊相关性分析确定土壤理化性质与Cu毒性阈值间的关系,利用简单和多元逐步回归分析方法建立基于土壤理化性质的Cu对白符跳毒性阈值的回归方程(即预测模型),利用单因素方差分析比较试验组和对照组间白符跳存活和繁殖的显著性差异. 采用OriginPro 8.5和Excel 2013软件进行图表制作.
2 结果与分析
2.1 土壤理化性质
9种受试土壤的理化性质如表1所示. 由表1可见,9种土壤的w(CuBT)范围为10.8~29.3 mgkg,参照GB 15618—2018《土壤环境质量 农用地土壤污染风险管控标准(试行)》[21]可知,9种受试土壤均未受Cu的污染;土壤pH变化范围为4.91~8.25,w(OM)为8.04~54.71 gkg,CEC为5.4~33.4 cmolkg;w(黏粒)为5.3%~38.6%;w(FeOX)、w(MnOX)和w(AlOX)也有较大差异.
2.2 不同土壤中Cu对白符跳毒性效应和阈值的比较
28 d暴露试验后,各对照组土壤中成虫存活率均高于80%,繁殖的幼虫数均高于100只且不同重复间变异系数均低于35%,符合ISO标准指南[6]中关于试验有效性的标准. 仅当土壤外源添加的w(TCu)达到最高时,江西红壤和安徽黄棕壤中白符跳存活数较对照组显著降低(P<0.05),但存活率依然高于50%,其他7种土壤中白符跳成虫存活数均未出现随w(TCu)的升高而明显减少的现象(P>0.05,数据未展示),因此无法计算Cu对白符跳存活的LC50值. 由图1可见,整体而言,不同土壤中白符跳繁殖的幼虫数量与外源添加的w(TCu)之间的剂量-效应关系明显,但变化趋势不同. 如当土壤中w(TCu)为200 mg/kg 时,陕西垆土和新疆灰漠土中白符跳繁殖率与
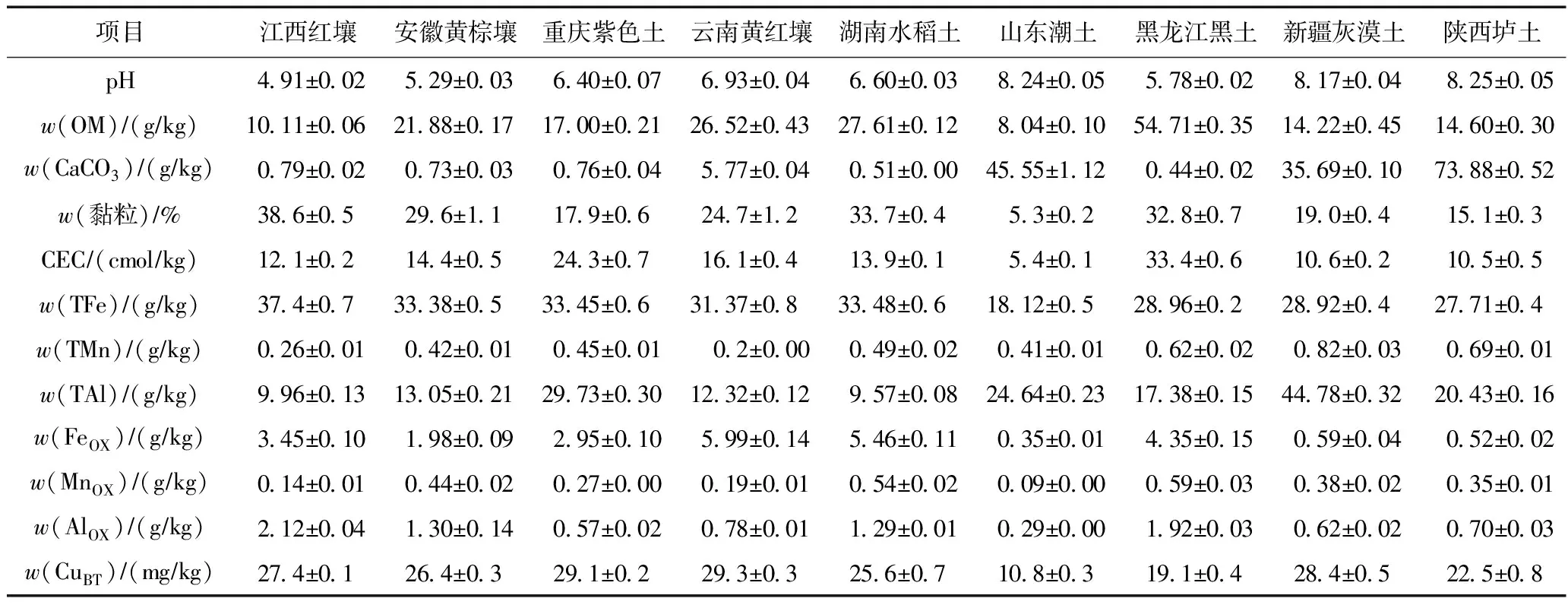
表1 9种受试土壤的理化性质
注:数据以平均值±相对标准偏差表示(n=3).

图1 暴露28 d后不同土壤中Cu对白符跳繁殖毒性效应的差异Fig.1 The reproduction toxicity effects of Cu on Folsomia candida in different soils after 28 days of exposure
对照组相比未受明显影响(P>0.05),其余土壤中白符跳繁殖率显著降低(P<0.05),并且在安徽黄棕壤和江西红壤中甚至已几乎观察不到幼虫. 基于w(TCu)实测值推导的Cu对白符跳繁殖的EC50值的变化范围为65~668 mg/kg(见表2),最大值是最小值的10.3倍.
2.3 基于土壤理化性质的Cu对白符跳繁殖的EC50的预测模型
利用皮尔逊相关分析,将基于w(TCu)实测值推导的Cu对白符跳繁殖的EC50值与土壤理化性质进行分析发现,EC50值与土壤pH、w(CaCO3)均呈显著正相关,相关系数分别达到0.801(P<0.01)和0.670(P<0.05). EC50值与其他理化性质间的相关性均未达到显著水平. 进一步利用回归分析建立回归方程

表2 基于w(TCu)实测值和w(CuCa)推导的Cu对白符跳繁殖的EC50值
注:括号内数值为毒性阈值的95%置信区间.
(即毒性预测模型)(见表3),发现土壤pH是影响Cu对白符跳繁殖的EC50的最重要的单一因子,解释了不同土壤之间EC50值58.0%的差异. 进一步引入w(OM)因子后,预测模型的决定系数显著提高,pH和w(OM)可解释EC50值92.7%的差异. 由图2可见,基于w(TCu)实测值推导的Cu的EC50值与基于pH、w(OM)建立的模型预测的EC50值之间相关性很好(R2=0.93).

表3 基于土壤理化性质建立的Cu对白符跳繁殖的EC50的预测模型
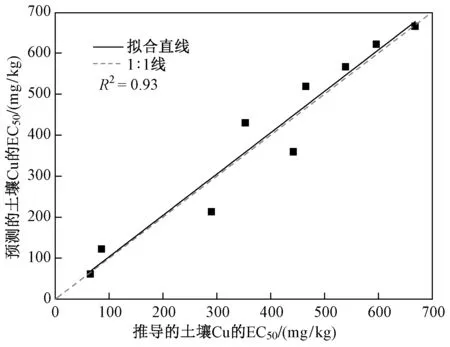
注: 所用模型为lg(EC50)=0.213+0.288pH+0.016w(OM).图2 基于w(TCu)实测值推导的Cu对白符跳繁殖的EC50值与利用模型预测的EC50值间的相关关系Fig.2 The correlation relationship between calculated EC50 values based on measured total Cu and predicted EC50 for the reproduction of Folsomia candida
3 讨论
污染物对生态受体的毒性阈值大小与选取的评价终点有关[9,22]. 存活率和繁殖率是白符跳毒性阈值研究中最常用的评价指标[5-6]. 该研究表明,土壤Cu对白符跳繁殖率的影响远高于存活率,在所有受试土壤中白符跳的存活率与w(TCu)之间没有明显的剂量-效应关系,与之前有关土壤Cu对白符跳毒性阈值的研究发现一致[11,13]. 这可能与白符跳遇到胁迫时往往会通过放弃生殖繁衍来优先适应环境,维持自身存活的生理特征有关[23-24]. 此外也有研究[25]认为,白符跳在土壤中产卵后,无法移动的虫卵与金属污染物充分接触,更容易受到金属毒性胁迫. 因此,该研究主要针对我国典型土壤的理化性质与Cu对白符跳繁殖的EC50值之间的关系进行讨论.
土壤理化性质影响重金属的生物有效性,进而影响其在土壤固相与液相之间的分配比、移动性、和毒性[9-10]. 研究不同类型土壤中重金属的毒性阈值差异,对于土壤生态基准的建立和场地的生态风险评价都具有重要意义[1,26]. 已有许多研究报道了我国不同土壤中Cu毒性阈值的差异和土壤理化性质对Cu毒性阈值的影响[1,7],与此类似,笔者发现,不同土壤中Cu对白符跳繁殖的EC50值的差异明显. 由于通过皮肤接触和吸收土壤溶液中的重金属是白符跳非常重要的暴露途径[27-28],因此Cu对白符跳繁殖的EC50值的差异与不同土壤中w(CuCa)(常用来表征土壤金属生物有效态浓度)有关(见图3). 如该研究发现,陕西垆土中Cu毒性最小〔土壤中w(CuCa)最低〕,而江西红壤中Cu毒性最大〔土壤中w(CuCa)最高〕(见图3);进一步基于w(CuCa)推导Cu对白符跳繁殖的EC50值后发现,不同土壤中Cu的EC50最大值与最小值之比由10.3降至8.8(见表2),表明氯化钙提取态Cu可在一定程度上预测和解释不同土壤中Cu对白符跳繁殖的EC50值的差异. 虽然已有研究鲜见报道基于w(CuCa)推导的Cu对白符跳繁殖的EC50值,但有关锌对白符跳毒性阈值的研究[28-29]得到了与笔者类似的结论.

图3 不同土壤中测定的w(CuCa)与添加的w(TCu)的关系Fig.3 Relationship between measured CaCl2-extracted Cu and added total Cu concentrations in different soils
目前,国外已经建立了Cu、Zn和Cd对白符跳毒性阈值的预测模型[10,28,30]. 笔者在该研究中建立了基于我国土壤理化性质的Cu对白符跳繁殖的EC50值的预测模型,结果表明,pH和w(OM)可较好地解释不同土壤中Cu的EC50值的差异,其中pH是预测我国典型土壤中Cu的EC50值的最重要的单一因子,可解释不同土壤中EC50值58.0%的差异. 基于其他土壤理化性质建立的模型的P值均大于0.05,说明这些理化性质对土壤铜毒性的贡献在统计学上均不显著. Criel等[10]研究也发现,pH和w(OM)可较好地解释国外不同土壤中Cu对白符跳繁殖毒性的差异. 事实上,许多研究表明,pH和w(OM)也是影响和预测Cu对其他物种毒性阈值的关键因素. 如LI等[14]发现,pH和w(OM)可较好地解释不同土壤中Cu对大麦根伸长的毒性阈值的差异. 这是因为Cu在土壤溶液中以阳离子形态存在,pH较低时,带有可变电荷的土壤表面正电荷数随之增加,这会与Cu2+竞争吸附点位,造成土壤对Cu的吸附强度和能力减弱[14,31-32],从而导致土壤溶液中Cu2+的浓度较高,容易进入生物体内对其产生毒性效应. 此外,研究表明,Cu在含有较高w(CaCO3)的碱性土壤中会形成Cu2(OH)2CO3沉淀[32],降低土壤溶液中Cu2+浓度,这也能解释碱性土壤中Cu对白符跳较低的毒性,同时也是w(CaCO3)与Cu的EC50值间呈显著正相关的重要原因. 此外,土壤有机质作为一种高分子化合物,本身存在大量的含氧活性功能团(如羧基、酚羟基和醇羟基等),可以通过金属桥接作用与Cu形成络合物[1,33],从而促进土壤对Cu的吸附,降低土壤溶液中Cu2+的浓度,减轻Cu对生物的毒性效应.
理论上,建立土壤重金属生态基准旨在保护包括植物、无脊椎动物和微生物在内的不同土壤生态受体,当前国内学者虽然已经建立了我国土壤中Cu的生态基准,但主要是基于Cu对不同植物的毒性阈值[34-35]. 因此,该研究获得的我国典型土壤中Cu对无脊椎动物白符跳的毒性阈值和基于理化性质建立的毒性阈值的预测模型将有助于后续我国土壤Cu生态基准值的提高与完善.
4 结论
a) 白符跳的繁殖率对土壤Cu毒性响应较存活率更为敏感.
b) 9种土壤中Cu对白符跳繁殖的EC50的差异明显,最高值是最低值的10.3倍,土壤中氯化钙提取态Cu可在一定程度上解释上述差异.
c) 土壤pH是影响不同土壤中Cu对白符跳EC50的最重要的单一因子,可解释不同土壤中EC50值58.0%的差异,且与w(OM)结合后能够更好地预测土壤Cu的EC50值.
参考文献(References):
[1] WANG X Q,WEI D P,MA Y B,etal.Derivation of soil ecological criteria for copper in Chinese soils[J].Plos One,2015,10(7):0133941.
[2] DUAN X M,XU M,ZHOU Y Y,etal.Effects of soil properties on copper toxicity to earthwormEiseniafetidain 15 Chinese soils[J].Chemosphere,2016,145:185-192.
[3] 顾瑞珍,吴晶晶.全国土壤污染状况调查公报发布[EBOL].北京:解放军报,2014-04-18[2014-04-18].http:news.163.com140418049Q3A5LI700014AED.html.
[4] BUCH A C,NIEMEYER J C,CORREIA M E F,etal.Toxicity of mercury toFolsomiacandidaandProisotomaminuta(Collembola:Isotomidae) in tropical soils:baseline for ecological risk assessment[J].Ecotoxicology and Environmental Safety,2016,127:22-29.
[5] FOUNTAIN M T,HOPKIN S P.Folsomiacandida(Collembola):a ‘standard’ soil arthropod[J].Annual Review of Entomology,2005,50(1):201-222.
[6] International Organization for Standardization.ISO 11267,soil quality-inhibition of reproduction ofCollembolan(Folsomiacandida) by soil pollutants[S].Geneva,Switzerland:International Organization for Standardization,2014.
[7] 周娟,颜增光,蒋金炜,等.几种典型土壤中铜对赤子爱胜蚓的毒性差异比较研究[J].生态毒理学报,2008,3(4):394-402.
ZHOU Juan,YAN Zengguang,JIANG Jinwei,etal.Comparative study on toxicity differences of copper to earthwormEiseniafetidain four typical soils[J].Asian Journal of Ecotoxicolog,2008,3(4):394-402.
[8] DAI W C,KE X,LI Z,etal.Antioxidant enzyme activities ofFolsomiacandidaand avoidance of soil metal contamination[J].Environmental Science and Pollution Research,2018,25(3):2889-2898.
[9] 林祥龙,孙在金,陈卫玉,等.锑对土壤跳虫(Folsomiacandida)的毒性效应[J].环境科学研究,2017,30(7):1089-1097.
LIN Xianglong,SUN Zaijin,CHEN Weiyu,etal.Toxicity effect of antimony to soil-dwelling springtail (Folsomiacandida)[J].Research of Environmental Sciences,2017,30(7):1089-1097.
[10] CRIEL P,LOCK K,ECKHOUT H V,etal.Influence of soil properties on copper toxicity for two soil invertebrates[J].Environmental Toxicology Chemistry,2008,27(8):1748-1755.
[11] AMORIM M J D B,ROMBKE J,SCHALLNAß H G,etal.Effect of soil properties and aging on the toxicity of copper forEnchytraeusalbidus,Enchytraeusluxuriosus,andFolsomiacandida[J].Environmental Toxicology and Chemistry,2005,24:1875-1885.
[12] SANDIFER R D,HOPKIN S P.Effects of pH on the toxicity of cadmium,copper,lead and zinc toFolsomiacandida,Willem,1902 (Collembola) in a standard laboratory test system[J].Chemosphere,1996,33:2475-2486.
[13] SANDIFER R D,HOPKIN S P.Effects of temperature on the relative toxicities of Cd,Cu,Pb,and Zn toFolsomiacandida(Collembola)[J].Ecotoxicology and Environmental Safety,1997,37:125-130.
[14] LI B,MA Y B,MCLAUGHLIN M J,etal.Influences of soil properties and leaching on copper toxicity to barley root elongation[J].Environmental Toxicology and Chemistry,2010,29(4):835-842.
[15] LI B,ZHANG H T,MA Y B,etal.Relationships between soil properties and toxicity of copper and nickel to bok choy and tomato in Chinese soils[J].Environmental Toxicology and Chemistry,2013(32):2372-2378.
[16] 鲁如坤.土壤农化分析方法[M].北京:中国农业科学技术出版社,2000.
[17] FAN J X,WANG Y J,CUI X D,etal.Sorption isotherms and kinetics of Sb(V) on several Chinese soils with different physicochemical properties[J].Journal of Soils and Sediments,2013,13:344-353.
[18] CROUAU Y,MOIA C.The relative sensitivity of growth and reproduction in the springtail,Folsomiacandida,exposed to xenobiotics in the laboratory:an indicator of soil toxicity[J].Ecotoxicology and Environmental Safety,2006,64:115-121.
[19] BUR T,PROBST A,BIANCO A,etal.Determining cadmium critical concentrations in natural soils by assessingCollembolamortality,reproduction and growth[J].Ecotoxicology and Environmental Safety,2010,73:415-422.
[20] VANEWIJK P H,HOEKSTRA J A.Calculation of the EC50and its confidence interval when subtoxic stimulus is present[J].Ecotoxicology and Environmental Safety,1993,25:25-32.
[21] 生态环境部.土壤环境质量 农用地土壤污染风险管控标准(试行)》[R].北京:生态环境部,2018.
[22] CEDERGREEN N,STREIBIG J C.Can the choice of endpoint lead to contradictory results of mixture-toxicity experiments[J].Environmental Toxicology and Chemistry,2005,24:1676-1683.
[23] WOIN P,BRONMARK C.Effect of DDT and MCPA (4-chloro-2-methylphenoxyacetic acid) on reproduction of the pond snail,LymnaeastagnalisL[J].Bulletin of Environmental Contamination and Toxicology,1992,48:7-13.
[24] CHOI W I,NEHER D A,RYOO I M,etal.Life-history trade-offs ofParonychiuruskimi(Lee) populations exposed to paraquat[J].Ecotoxicology and Environmental Safety,2008,69(2):227-232.
[25] XU J,WANG Y,LUO Y M,etal.Effects of copper,lead and zinc in soil on egg development and hatching ofFolsomiacandida[J].Insect Science,2009,16(1):51-55.
[26] 孙在金,赵淑婷,林祥龙,等.基于物种敏感度分布法建立中国土壤中锑的环境基准[J].环境科学研究,2018,31(4):774-781.
SUN Zaijin,ZHAO Shuting,LIN Xianglong,etal.Deriving soils environmental criteria of antimony in China by species sensitivity distributions[J].Research of Environmental Sciences,2018,31(4):774-781.
[27] PEDERSEN M B,GESTEL C A M,ELMEGAARD N.Effects of copper on reproduction of twoCollembolanspecies exposed through soil,food and water[J].Environmental Toxicology and Chemistry,2000,19(10):2579-2588.
[28] LOCK K,JANSSEN C R.Toxicity of zinc in spiked artificial soils versus contaminated field soils[J].Environmental Science & Technology,2001,35(21):4295-4300.
[29] SMIT C E,VAN-GESTEL C A M.Effects of soil type,prepercolation,and ageing on bioaccumulation and toxicity of zinc for the springtailFolsomiacandida[J].Environmental Toxicology and Chemistry,1998,17(6):1132-1141.
[30] LOCK K,JANSSEN C R.Cadmium toxicity for terrestrial invertebrates:taking soil parameters affecting bioavailability into account[J].Ecotoxicology,2001,10:315-322.
[31] LI X F,SUN J W,HUANG Y Z,etal.Copper toxicity thresholds in Chinese soils based on substrate-induced nitrification assay[J].Environmental Toxicology and Chemistry,2010,29(2):294-300.
[32] MA Y B,LOMBI E,OLIVER I W,etal.Long-term aging of copper added to soils[J].Environmental Science & Technology,2006,40(20):6310-6317.
[33] 上官宇先,秦晓鹏,赵冬安,等.利用大型土柱自然淋溶条件下研究土壤重金属的迁移及形态转化[J].环境科学研究,2015,28(7):1015-1024.
SHANGGUAN Yuxian,QIN Xiaopeng,ZHAO Dong′an,etal.Migration and transformation of heavy metals in soils by lysimeter study with field condition[J].Research of Environmental Sciences,2015,28(7):1015-1024.
[34] 王小庆,李菊梅,韦东普,等.土壤中铜生态阈值的影响因素及其预测模型[J].中国环境科学,2014,34(2):445-451.
WANG Xiaoqing,LI Jumei,WEI Dongpu,etal.Major soil factors affecting ecological threshold for copper and the predictable models[J].China Environmental Science,2014,34(2):445-451.
[35] 王小庆,韦东普,黄占斌,等.物种敏感性分布法在土壤中铜生态阈值建立中的应用研究[J].环境科学学报,2013,33(6):1787-1794.
WANG Xiaoqing,WEI Dongpu,HUANG Zhanbin,etal.Application of species sensitivity distribution in deriving of ecological thresholds for copper in soils[J].Acta Scientiae Circumstantiae,2013,33(6):1787-1794.

