纳米卟啉金属有机骨架对斑马鱼神经系统发育的作用*
王亚洁, 袁 博,2, 刘 伟, 李玉皓, 苑晓勇△
(1. 天津市眼科医院, 天津 300020; 2. 南开大学医学院, 天津 300071; 3. 天津大学理学院, 天津 300072)
金属有机骨架(metal-organic frameworks,MOFs),是一种由金属离子与有机配体形成的新型杂化多孔材料,兼具有无机材料和有机材料的特性[1]。纳米级MOFs(nMOFs),是纳米技术与MOFs的结合,不仅应用于催化、分离、储能、传感、光学等领域,而且在药物递送、生物成像和生物治疗等方面的作用也日益受到重视[2]。nMOFs作为一种载药体系,可以实现靶向分布,提高治疗效果[3]。此外,由于nMOFs有很好的生物相容性、化学和热稳定性,其组成、结构和性质也可以自由调节,通过控制合成或合成后修饰等方法,nMOFs不仅能应用于光动力-化疗,光热-化疗和免疫疗法中[4,5],同时还可以被磁共振成像(MRI)和正电子发射断层显像术(PET)等医学成像技术实时监测[6]。随着越来越多的证据表明nMOFs在疾病的诊断和治疗上具有良好的应用前景[7],明确nMOFs对有机体是否有诊疗外的作用成为目前亟需解决的问题。
斑马鱼具有产卵量多、繁殖周期短、胚胎透明、发育快和阶段特征明显等优势,是研究神经发育和药物筛选的重要模式生物。此外,斑马鱼神经系统的结构和发育过程与哺乳动物高度相似[8],适用于作为实验对象以评估各类药物对神经发育的影响。
本研究以卟啉为主要原料合成纳米卟啉金属有机骨架(zirconium-porphyrin metal-organic framework,NPMOF)。经NPMOF暴露后,斑马鱼神经元和神经胶质细胞的发育情况、神经发育相关基因的表达以及运动能力被用于评价其对脊椎动物神经系统发育的作用。本研究将为NPMOF在生物医学领域的应用提供进一步的证据。
1 材料与方法
1.1 试剂、材料与NPMOF的制备
NPMOF经过调整的溶剂热法制备[9]。主要成分为:10 mg 四羧基苯卟啉(5,10,15,20-tetrakis(4-carboxyl)-21H,23H-porphine,TCPP;TCI化工发展有限公司中国部),30 mg 四氯化锆(zirconium chloride,ZrCl4;阿尔法-亚沙),200 mg 苯甲酸(Benzoic acid,BA,98.5%;天津光复精细化工研究所),100 mg十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB;福晨试剂有限公司),200 mg 聚乙二醇 (polyethylene glycol M.W. 6000,PEG-6000;福晨试剂有限公司)和10 ml N,N-二甲基甲酰胺(dimethylformamide,DMF;康科德试剂有限公司)。
NPMOF的形貌和微观结构通过透射电镜(TEM,Tecnai G2 F20,加速电压200 kV;FEI,Hillsboro,USA)测定。其光学特性由紫外分光光度计(UV-3900-visible spectrophotometer,UV-Vis;Shimadzu,Japan)和荧光光谱仪(FL-4600 Fluorescence Spectrometer;Hitachi,Japan)测定。
1.2 实验动物
本研究所用斑马鱼为野生AB型和转基因型Tg (mbp:nfsB-EGFP)。养殖条件为28.5℃,10/14 h亮/暗循环照明[10]。收集胚胎,孵化于E3培养液(60 mmol/L NaCl,0.67 mmol/L KCl,0.3 mmol/L NaHCO3,0.9 mmol/L CaCl2,pH 7.2),以时龄(hpf)标记发育阶段。所有操作均符合南开大学有关实验动物的相关规定。
1.3 水体暴露
收集6 hpf正常发育的胚胎,放置于六孔板中,每孔50枚卵,每组重复10孔。使其持续暴露在浓度为100 mg/L的 NPMOF-E3溶液中,该组为暴露组(实验组)。另取相同数目的胚胎孵化于E3溶液中作为对照组。实验组和暴露组每12 h更换一次相应的新鲜溶液。从6 hpf开始,斑马鱼胚胎持续暴露于E3或NPMOF-E3溶液中,在28、48、72、96和120 hpf,每组分别取60条鱼用于RT-PCR;在120 hpf,每组取20条鱼用于整体胚胎原位杂交,150条用于免疫荧光染色,30条用于行为学测试。
1.4 荧光定量PCR
在28、48、72、96和120 hpf分别提取实验组和对照组的总RNA并反转录为cDNA。实时荧光定量PCR以β-actin为内参,相关基因表达水平的计算采用2-△△Ct法。生物学重复三次。引物序列见表1。

Tab. 1 Primers of quantitative real-time polymerase chain reaction
1.5 整体原位杂交
为了消除色素的影响,以0.003% 1-phenyl-2-thiourea(PTU, Sigma)处理胚胎至120 hpf。斑马鱼幼鱼用1×三卡因(tricaine methanesulfonate,0.1% MS-222;Sigma)麻醉,待安乐死后固定在4%多聚甲醛(paraformaldehyde,PFA)中。神经元可被activatedleukocytecelladhesionmoleculea(alcama, GeneBank NM_131000) mRNA 探针特异性标记,用于扩增alcama的引物序列为forward 5′-TCGGTGCCTTCATAG-3′ 和reverse 5′-CCTTCTCAGTGGGATAG-3′,编码alcama的cDNA用SacII线性化,用Sp6聚合酶合成。原位杂交方法如文献[11]。alcama探针的浓度为2 ng/μl。每组处理二十个样本。
1.6 免疫荧光染色
120 hpf的斑马鱼幼鱼用0.1% MS-222麻醉后固定在4% PFA中,免疫荧光染色采用标准程序[12]。冰冻切片厚度为12 μm。其中一抗有3种,分别为Zn-12(稀释浓度为1∶200;Zebrafish International Resource Center,ZIRC;USA)、Zrf-1(1∶200;ZIRC)和EGFP(1∶500;ab6556,Abcam)。荧光二抗为Cy3(1∶500;Millipore)和Alexa Fluor 488 (1∶1 000;ab150077,Abcam)。细胞核以DAPI(4’,6-diamidino-2-phenylindole,1∶1 000;Sigma)衬染。
1.7 行为学测试
行为学测试通过斑马鱼行为轨迹跟踪系统(DVOL-0040,Noldus Information Technology,The Netherlands)同时对120 hpf对照组和100 mg/L NPMOF暴露组的幼鱼的运动能力进行评估。幼鱼收集后放置于24孔板中,每孔放1条鱼,8鱼每组。静止15 min,待斑马鱼对新环境完全适应后持续监测20 min。Ethovision XT软件(Noldus Information Technology)用于导出热图以及运动轨迹分析,其中包含9个运动参数:总运动距离、总运动时间、总静止时间、慢速运动时间(速度<7.5 mm/s)、中速运动时间(≥7.5 mm/s,≤15 mm/s)、快速运动时间(>15 mm/s)、运动速度、角速度和加速度。上述运动试验被重复3次。
1.8 图像采集与分析
免疫荧光染色的图像由FV 1000共聚焦显微镜采集(Olympus,Japan),原位杂交的图像由SXZ10体式显微镜(Olympus)采集。Image J软件(1.49X,NIH,http://rsb.info.nih.gov/ij/)用于将荧光图转化为8-bit的灰度图像,设定阈值,得出每组中Zn-12,Zrf-1和EGFP-阳性细胞的面积。
1.9 统计学处理
2 结果
2.1 NPMOF的光学与物理性质
TEM结果显示制备出的NPMOF的形貌为长径335 nm和短径90 nm的纺锤体(图1A)。高分辨率透射电子显微镜(HR-TEM)显示其表面是无定形的(图1B)。NPMOF的光学特性由紫外吸收光谱法和稳态荧光法测定。图1C显示,NPMOF的紫外吸收具有卟啉的独特类型,S带在414.5 nm处有一个强吸收峰,Q带在500 nm到700 nm之间有四个较弱的吸收峰。在三维荧光图像(图1D)中,纵然激发波长各异,但荧光发射范围大都聚集在660 nm附近,这表明NPMOF与其主要成分卟啉具有相同的能级跃迁特性,经一定波长的光激发后可发射出红色荧光。
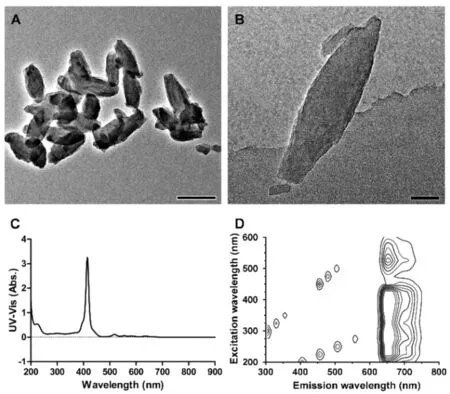
Fig. 1 Physical and chemical characterizations of NPMOF
2.2 NPMOF暴露后视网膜神经节细胞与脑中神经元的发育
为了评价NPMOF暴露后神经系统发育的改变,在28 hpf,6个调控神经发育的基因(msi1、ngn1、neurod1、atoh7、brn3b和sox10)的表达被验证(表2)。相比于对照组,NPMOF暴露组中除了neurod1,其他5个基因的mRNA表达水平都有明显的提高(P<0.05,表2)。
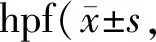
Tab. 2 The mRNA expression levels of neurodevelopment-related genes at 28 n=3)
本研究选用神经元相关基因(alcama、reln和map2)的表达作为评价神经元发育情况的指标。实验组中,在48 hpf,alcama的表达开始显著上调,而reln和map2表达的上调则分别始于72 hpf和96 hpf(P<0.05,表3)。alcamamRNA探针和Zn-12抗体可以特异性识别位于视网膜的神经节细胞和位于脑中的神经元。原位杂交和染色结果显示,在120 hpf,NPMOF暴露组和非暴露组都在神经节细胞层(ganglion cell layer,GCL)检测到了alcama的表达(图2A,箭头),视网膜节细胞与脑中的神经元分化成熟(图2A)。分别对视网膜和脑中Zn-12阳性细胞的面积进行统计,NPMOF暴露组和非暴露组的结果并未显示出差异(P>0.05,图2B)。以上结果表明,NPMOF的暴露对神经元发育的促进作用不明显。

Fig. 2 Neurodevelopment and neuron development following NPMOF exposure
2.3 NPMOF暴露后神经胶质细胞的发育
经NPMOF暴露后,gfap的表达从72 hpf至120 hpf出现了明显的上调,而s100b则在48 hpf到120 hpf上调显著(P<0.05,表3)。在120 hpf,可特异性识别星形胶质细胞和müller细胞的Zrf-1抗体被用于检测此类胶质细胞的分布和形态改变,Zrf-1阳性细胞大量分布于斑马鱼视网膜、前脑与后脑中,细胞的分布和形态在NPMOF暴露组和非暴露组中并未有明显不同(图3A)。然而,在Zrf-1阳性细胞面积的统计结果中,NPMOF暴露组视网膜中的müller细胞和前脑中的星形胶质细胞明显增多(P<0.05,图3B),后脑中星形胶质细胞的面积在两组中未显示出差异(P>0.05,图3B)。
Mbp和Olig2特异性表达于中枢神经系统的少突胶质神经细胞中。本研究不仅对mbp和olig2的表达进行了检测,还利用转基因斑马鱼Tg (mbp:nfsB-EGFP)和EGFP抗体指示少突胶质细胞的发育。相比于对照组,暴露组的mbp在48、96和120 hpf表达明显上调,olig2的表达则在受精后72到120 h有明显上调(P<0.05,表3)。NPMOF暴露组和对照组中,EGFP阳性细胞(少突胶质细胞)主要分布在脑和脊髓中(图3C,箭头)。不论在脑还是脊髓中,髓鞘围绕轴突成同心圆状(图3C,箭头)。为了对少突胶质细胞进行量化,EGFP阳性细胞的面积同样被计数分析,然而两组对比并没有统计学上的差异(P>0.05,图3D)。以上结果表明,NPMOF暴露可以促进神经胶质细胞的发育,特别是müller细胞和星形胶质细胞的发育。

Tab. 3 The mRNA expression levels of neuron-related and neuroglia-related n=3)
Fig. 3 Neuroglia cell development following NPMOF exposure
2.4 NPMOF暴露后斑马鱼运动能力的改变
为了进一步明确NPMOF暴露对神经系统发育的作用是否会体现在功能上,我们对120 hpf的斑马鱼幼鱼进行了行为学测试。图4A为运动的轨迹图和热图。应用行为学分析软件Ethovision XT,对轨迹图中的9项参数进行统计分析,分别为:总运动距离、总运动时间、总静止时间、慢速运动时间(速度<7.5 mm/s)、中速运动时间(≥7.5 mm/s,≤15 mm/s)、快速运动时间(>15 mm/s)、运动速度、角速度和加速度。与对照组相比,100 mg/L NPMOF暴露组的斑马鱼总运动距离更长、快速运动时间更久以及运动速度更快,而且总静止时间较少(P<0.05,图4B)。然而,两组在总运动时间、慢速运动时间、中速运动时间、角速度和加速度上无显著差异(P> 0.05,图4B)。这些数据表明,经NPMOF暴露后,斑马鱼幼鱼的运动能力有所提高。
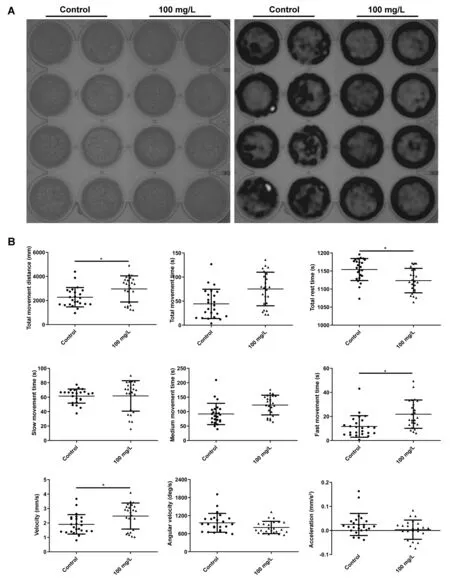
Fig. 4 Locomotor behavior following NPMOF exposure
3 讨论
神经元、星形胶质细胞和少突胶质神经细胞是神经系统不可或缺的组成部分[13]。神经元是神经系统的形态和功能单位,在神经肌肉传导中起着重要作用,而星形胶质细胞和少突胶质细胞不仅可以对神经元起到支持、保护和营养等作用,还对脑的生理和病理过程有重要影响[14]。这些神经细胞或神经胶质细胞一旦损伤或功能障碍将会导致严重的疾病,比如运动神经元病、中枢神经系统脱髓鞘疾病和癫痫等[15]。近年来,大量实验证据表明NPMOF在生物医学的诊断与治疗领域具有广阔的应用前景[9]。然而, NPMOF的持续暴露是否会改变神经组织的发育仍旧未知。基于此,本研究着重探讨了NPMOF对斑马鱼神经系统发育的作用,并发现短时间的NPMOF暴露可以促进斑马鱼神经元和神经胶质细胞的发育并改善斑马鱼的运动能力。
在本研究中,斑马鱼幼鱼经100 mg/L NPMOF暴露后,神经元与少突胶质细胞显示出相似的生物学行为:发育相关基因的表达都有所上调,而在细胞分布、形态以及指征发育成熟的蛋白(Zn-12和Mbp)的表达上却未见明显差异。不同的是,与对照组相比,NPMOF实验组中不仅星形胶质细胞相关基因的表达出现上调,而且在视网膜和前脑中有更多的Zrf-1阳性细胞。造成这种结果的原因可能是NPMOF的主要组成部分为卟啉。卟啉作为血红蛋白和细胞色素的主要成分之一,参与到许多的生命过程中,例如红细胞生成和氧的运输[16]。NPMOF对神经发育的积极作用或可归因于卟啉能够促进血红蛋白的合成、保障供氧而起到营养神经的作用。此外,星形胶质细胞的提前分化可以诱导神经元的迁移[17]。在实验组中,神经元和少突胶质细胞的改变或许会随着NPMOF暴露时间的延长而出现,这需要进一步的研究。
运动能力是评价斑马鱼神经发育的功能指标。NPMOF暴露组中的斑马鱼在总运动距离、快速运动时间和速度上有所提高,而且静止时间减少,表明实验组斑马鱼幼鱼的运动行为比对照组更为活跃,运动能力更强,这和形态学的结果一致,两者共同说明了NPMOF对神经系统发育的促进作用。对神经元的促进作用有利于神经肌肉间的传导,对神经胶质细胞发育的促进作用则可进一步保证内环境的稳定和冲动传导的有效进行[18]。

