LncRNA UNC5B-AS1对肺癌细胞黏附、侵袭及迁移的影响及其机制*
谭建军, 隆姝孜, 张 涛△
(1. 重庆三峡中心医院肿瘤科, 重庆 404000; 2. 重庆医科大学第一附属医院肿瘤科, 重庆 404000)
肺癌是世界上最常见的恶性肿瘤之一,其发病率和死亡率较高,且呈逐年上升的趋势[1]。由于肺癌是一种多基因疾病,所以肺癌发生过程中涉及的生物学过程很复杂[2]。因此,详细了解肺癌发生和进展的机制和分子途径对于改善肺癌患者的诊断和治疗至关重要。长的非编码RNA(Long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的非编码转录物。近年来,lncRNA作为潜在的生物调节因子参与细胞增殖、分化、侵袭和迁移等细胞活动而备受研究者关注[3]。lncRNA的作用机制多种多样,包括作为与微小RNA(microRNA,miRNA)相似的竞争性内源RNA(competing endogenous RNA,ceRNA)海绵分子,参与基因转录或转录后调控,参与基因表观遗传调控等。越来越多的研究表明,lncRNA在肺癌的生长、转移和侵袭中发挥作用[4]。王亚芳等人[5]利用高通量测序分析了3例发生转移及未发生转移的肺癌组织中lncRNA表达谱的变化,结果显示lncRNA UNC5B-AS1在转移的肺癌组织中表达上调,提示其可能与肺癌的转移相关。然而,UNC5B-AS1对肺癌细胞黏附、侵袭和迁移的影响及可能的机制仍有待阐明。最近,据报道,miR-218-5p在许多人类癌症中起着抑癌作用,如肺癌、肝细胞癌和肾细胞癌[6-8]。本实验前期通过生物信息学手段预测发现,UNC5B-AS1和miR-218-5p之间存在特异性碱基互补结合位点,提示二者可能存在靶向关系。本研究首先检测了UNC5B-AS1在肺癌组织和细胞系中的表达情况,且过表达UNC5B-AS1可抑制肺癌细胞黏附、侵袭和迁移能力,并可作为miR-218-5p的分子海绵。这些研究将有助于阐明UNC5B-AS1在肺癌进展中的作用及其作为治疗靶点的潜力。
1 材料与方法
1.1 标本、细胞系和主要试剂
收集重庆三峡中心医院肿瘤科2017年6月至2019年6月行手术切除的20例肺癌组织及对应癌旁组织标本,资料完整且经病理学确诊为肺癌。所有研究对象均知情同意并签署知情同意书,本研究经重庆三峡中心医院伦理委员会批准。人支气管上皮细胞系HBE和不同肺癌细胞系A549、H1437、H1975、H1299和H460均从中国科学院上海细胞研究所获得。DMEM培养基从美国Biological Industries公司获得;胎牛血清和青-链霉素双抗从美国Gibco公司获得;胰蛋白酶从美国Abcam公司获得;UNC5B-AS1 siRNA及非特异性siRNA由上海吉凯制药技术有限公司合成提供;miR-218-5p mimics和mimics对照购于广州市锐博生物科技有限公司;LipofectamineTM2000试剂从日本TaKaRa公司获得;Trizol试剂从北京康为世纪生物科技有限公司获得;M-MLV逆转录试剂盒从大连宝生物工程有限公司获得;SYBR Green PCR Master Mix检测试剂盒从赛默飞世尔科技有限公司获得;Transwell小室从美国Coring公司获得;Matrigel基质胶从美国BD公司获得;双荧光素酶报告基因检测试剂盒从美国Promega公司获得;UNC5B-AS1-Wt和UNC5B-AS1-Mut荧光素酶报告基因重组载体由上海吉玛基因有限公司完成;Western blotting检测相关试剂从上海碧云天生物技术研究所获得;E-cadherin、Vimentin、Twist抗体及二抗从美国CST公司获得。
1.2 细胞培养
HBE、A549、H1437、H1975、H1299和H460细胞均培养在含10%胎牛血清、1%青-链霉素双抗的DMEM培养液中,接种密度为1×105cells/ml,在体积分数为CO2、饱和湿度、37℃恒温箱中培养。细胞贴壁生长,待生长汇合度达90%以上时使用胰蛋白酶消化细胞,按照1∶3或1∶4的比例进行传代。取对数增殖期的细胞用于后续实验。
1.3 细胞转染和分组
对数生长期的肺癌A549细胞以胰酶消化,取2 ml细胞悬液接种到6孔板中,接种密度为1×105cells/ml,放置在37℃培养箱中过夜培养,待细胞汇合率达50%左右时进行转染,参照LipofectamineTM2000制造商说明书将UNC5B-AS1 siRNA及非特异性siRNA转染至A549细胞,其中将转染UNC5B-AS1 siRNA的A549细胞记为si-UNC5B-AS1组,将转染非特异性siRNA的A549细胞记为si-NC组,将未行转染的A549细胞记为Ctrl组。每组设置9个复孔,各组A549细胞转染48 h后检测相关指标。
1.4 qRT-PCR检测UNC5B-AS1和miR-218-5p的表达
收集肺癌组织和对应癌旁组织,对数期HBE、A549、H1437、H1975、H1299和H460细胞以及转染48 h各组A549细胞,采用Trizol一步法分别提取组织和细胞中的总RNA。随后采用超微量核酸检测仪NanoDrop检测RNA的纯度和浓度。使用M-MLV逆转录试剂盒制备第一链cDNA。以逆转录产物cDNA为模板,使用SYBR Green PCR Master Mix检测试剂盒行qRT-PCR检测。引物序列:UNC5B-AS1正向引物:5’-GATCCTGCCTCAGGGAAA-3’;反向引物5’-GCTCAAGAGGTTGGGACT-3’。GADPH正向引物5’-GGTCGGAGTCAACGGATTTG-3’;反向引物5’-ATGAGCCCCAGCCTTCTCCAT-3’。miR-218-5p正向引物:5’-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACACATGGT-3’;反向引物5’-GGGGGTTGTGCTTGATCTAAC-3’。U6正向引物5’-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACAAAATATGGAAC-3’;反向引物5’-GTGCTCGCTTCGGCAGC-3’。建立20 μl反应体系:cDNA 2 μl、SYBR Green Mix 10 μl、正反向引物各1 μl、ddH2O补足20 μl。反应循环参数设为:95℃ 5 min,随后设40个循环,95℃ 30 s,60℃ 30 s,72℃ 10 s。所得实验数据采用2-ΔΔCt公式进行计算。以GADPH为内参,计算UNC5B-AS1相对表达量,以U6为内参,计算miR-218-5p相对表达量。实验重复3次,取均值。
1.5 细胞黏附实验
以无血清DMEM培养液稀释Matrigel基质胶,取适量稀释过的Matrigel胶铺96孔板,于超净工作台中过夜风干,备用。对数期的A549细胞以1×103cells/well接种到96孔板中,按照上述1.3方法分组和转染,48 h后用胰蛋白酶消化细胞,并制成单细胞悬液。取100 μl单细胞悬液(约1×104cells)加入到铺胶的96孔板中,设3个复孔,放置在37℃培养箱培养1 h,取出96孔板,吸取培养液,以PBS洗涤3次,以甲醇固定10 min,吉姆萨染色15 min,以清水洗去染液,在200倍显微镜下观察并计数细胞黏附数。实验重复3次,取均值。
1.6 细胞Transwell侵袭实验
各组A549细胞以胰酶消化,接种在Matrigel胶包被的Transwell小室24孔板中,在小室上室加入浓度为2×105cells/ml细胞悬液100 μl,下室加入含10%胎牛血清的DMEM培养液500 μl,37℃培养箱继续培养48 h。取出Transwell小室,用棉签小心擦去上室微孔膜上的细胞,用PBS洗涤2次,采用4%多聚甲醛固定10 min,结晶紫染色15 min,用PBS洗涤小室,晾干,在100倍倒置显微镜下随机选取5个视野,观察并计数穿膜细胞数。实验重复3次,取均值。
1.7 细胞划痕愈合实验
将转染48 h后各组A549细胞用胰酶消化,将细胞以1×105cells/well平铺于6孔板中,设3个平行复孔,放置在37℃培养箱继续培养,待细胞呈单层汇合时,用无菌枪头轻轻划6孔板,保证划线呈直线状,用PBS洗去划下的细胞。将6孔板放置在37℃培养箱培养48 h,在显微镜下观察细胞的迁移距离。实验重复3次,取均值。
1.8 双荧光素酶报告基因实验
生物信息学在线软件LncBase Experimental v.2预测表明,UNC5B-AS1与miR-218-5p存在相似结合位点,根据预测结果将miR-218-5p与UNC5B-AS1结合及突变位点的3’UTR分别扩增并构建到荧光素酶报告基因载体上,分别记为UNC5B-AS1-Wt和UNC5B-AS1-Mut(该步骤由上海吉凯制药技术有限公司完成),将UNC5B-AS1-Wt和UNC5B-AS1-Mut重组载体分别与miR-218-5p mimics或mimics对照共转染至A549细胞,48 h后分别收集细胞,按照双荧光素酶报告基因检测试剂盒说明书检测各组A549细胞萤火虫荧光素酶活性和海肾荧光素酶活性,以海肾荧光素酶活性为内参计算相对荧光素酶活性。实验重复3次,取均值。
1.9 Western blot
提取转染48 h后各组A549细胞中总蛋白,BCA法对蛋白浓度进行测定,加入适量上样缓冲液加热变性蛋白。配制10% SDS-PAGE凝胶,取等量蛋白加入上样孔,电泳分离蛋白,采用半干法电转至PVDF膜上,将膜浸入5%脱脂奶粉封闭液中孵育2 h。根据抗体使用说明书用TBST 1∶1 000稀释一抗,加入相应一抗,冰上过夜杂交,加入1∶3 000稀释的二抗,室温杂交2 h,以ECL发光显影,在成像系统中曝光并获取图像,以GAPDH进行标定,采用图像分析软件Quantity One分别计算各组A549细胞中E-cadherin、Vimentin和Twist蛋白相对表达水平。实验重复3次,取均值。
1.10 统计学处理
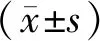
2 结果
2.1 UNC5B-AS1在肺癌组织和细胞系中的表达
qRT-PCR检测结果显示,UNC5B-AS1在肺癌组织中的表达水平(3.04±0.55)明显高于癌旁组织(1.21±0.32)(t=8.628,P<0.05);UNC5B-AS1在肺癌细胞A549、H1437、H1975、H1299和H460中的表达分别为:(4.18±0.42)、(2.26±0.23)、(3.57±0.36)、(3.51±0.35)、(2.35±0.23),显著高于支气管上皮细胞HBE(1.00±0.10)(P<0.05),且UNC5B-AS1在A549细胞中的表达量最高(P< 0.05),因此选取肺癌A549细胞用于后续研究。
2.2 UNC5B-AS1对A549细胞黏附能力的影响
qRT-PCR检测结果显示,与si-NC组比较,si-UNC5B-AS1组A549细胞中UNC5B-AS1的表达水平明显下降(P<0.05),而Ctrl组中UNC5B-AS1的表达水平无明显改变(P>0.05)。黏附实验结果显示,与si-NC组比较,si-UNC5B-AS1组细胞黏附数明显减少(P<0.05),而Ctrl组细胞黏附数无明显改变(P>0.05,表1)。
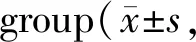
Tab. 1 Comparison of UNC5B-AS1 and cell adhesion numbers in A549 cells of each n=9)
2.3 UNC5B-AS1对A549细胞侵袭能力的影响
Transwell实验结果显示,Ctrl组、si-NC组和si-UNC5B-AS1组穿膜细胞数分别为:(126.24± 12.56)个、(128.07±14.08)个和(50.14±6.10)个,与si-NC组比较,si-UNC5B-AS1组A549细胞穿膜细胞数明显减少(P<0.05),而Ctrl组穿膜细胞数无明显改变(P>0.05,图1)。

Fig. 1 Transwell test to detect the invasion ability of A549 cells in each group(×200)
2.4 UNC5B-AS1对A549细胞迁移能力的影响
划痕愈合实验结果显示,Ctrl组、si-NC组和si-UNC5B-AS1组细胞迁移距离分别为:(1.21±0.14)μm、(1.09±0.12)μm和(0.30±0.03)μm,与si-NC组比较,si-UNC5B-AS1组A549细胞迁移距离明显减小(P<0.05),而Ctrl组细胞迁移距离无明显改变(P>0.05,图2)。

Fig. 2 Scratch healing test to detect the migration ability of A549 cells in each group
2.5 UNC5B-AS1和miR-218-5p靶向关系的验证
生物信息学软件LncBase Experimental v.2等预测结果显示,UNC5B-AS1和miR-218-5p间存在特异性结合位点(图3),提示miR-218-5p可能是UNC5B-AS1的靶基因。双荧光素酶报告基因检测实验结果显示,共转染miR-218-5p mimics和UNC5B-AS1-Wt重组荧光素酶载体,miR-218-5p能够显著抑制细胞相对荧光素酶活性(P<0.05),而共转染miR-218-5p mimics和UNC5B-AS1-Mut重组荧光素酶载体,miR-218-5p对细胞相对荧光素酶活性无明显抑制作用(P>0.05,表2)。qRT-PCR检测结果显示,Ctrl组、si-NC组和si-UNC5B-AS1组细胞中miR-218-5p的表达水平分别为:(0.99±0.09)、 (0.97±0.09)和(0.36±0.04),与si-NC组比较,si-UNC5B-AS1组A549细胞中miR-218-5p的表达水平明显降低(P<0.05),而Ctrl组miR-218-5p的表达水平无明显变化(P>0.05)。

Fig. 3 UNC5B-AS1 targeted miR-218-5p relationship verification

Tab. 2 Double luciferase reporter assay to detect the interaction between UNC5B-AS1 and miR-218-5p
2.6 UNC5B-AS1对A549细胞EMT过程的影响
Western blotting检测结果显示,与si-NC组比较,si-UNC5B-AS1组A549细胞中E-cadherin蛋白表达明显下调(P<0.05),Vimentin和Twist蛋白表达明显上调(P<0.05),而Ctrl组细胞中E-cadherin、Vimentin和Twist蛋白表达水平无明显改变(P> 0.05,图4,表3)。
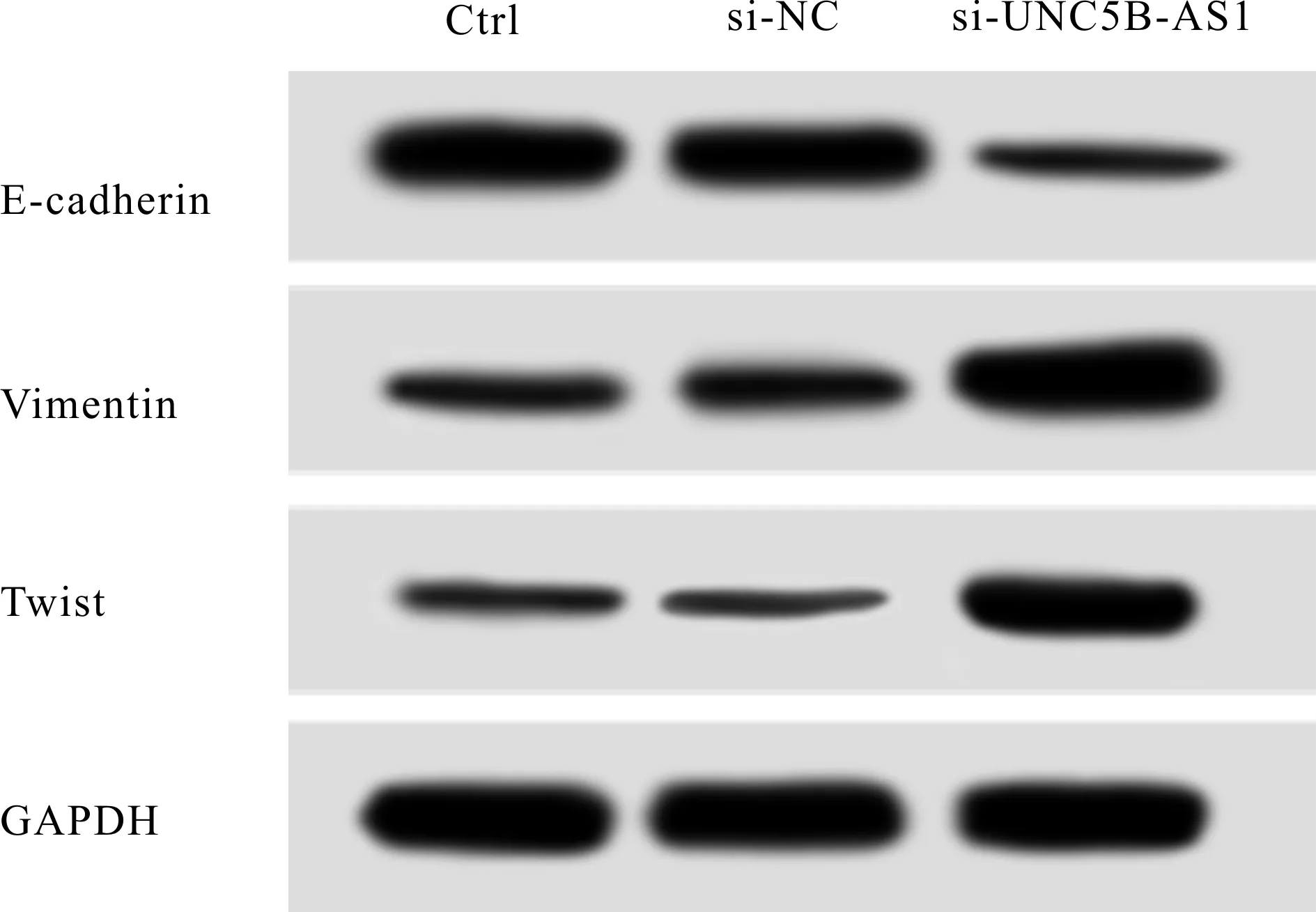
Fig. 4 Western blot to detect the expression of E-cadherin, Vimentin and Twist in A549 cells of each group
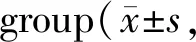
Tab. 3 Comparison of E-cadherin, Vimentin and Twist protein expression levels in A549 cells in each n=9)
3 讨论
肺癌相关死亡率是全球癌症死亡的最常见原因。在所有肺癌病例中,已确诊的患者中超过一半发生肿瘤转移,且超过70%的肺癌患者被确诊时已处晚期[9]。因此,迫切需要研究涉及肺癌的分子机制并获得潜在的治疗靶点。研究表明lncRNA与肺癌中的不同生物过程有关。例如,lncRNA SNHG1、lncRNA TUC338和lncRNA CCHE1均可通过调控不同信号通路参与肺癌细胞的生长和转移[10-12]。但是,关于lncRNA在肺癌发生和发展中的作用还远未明确。本项研究首次证明了UNC5B-AS1在肺癌组织和细胞系中表达上调。下调UNC5B-AS1可显著抑制肺癌细胞黏附、侵袭和迁移。这些数据表明UNC5B-AS1可作为癌基因在肺癌的发展和进展中起关键作用。
UNC5B-AS1是UNC-5 netrin受体B(UNC-5 netrin receptor B,UNC5B)的转录反义RNA。UNC5B-AS1是相对新颖的lncRNA,但一些研究探索了UNC5B的功能。Kong等人研究显示,UNC5B的过表达抑制膀胱癌5637细胞增殖和迁移,诱导G2/M期细胞周期阻滞[13]。另一项研究显示,在甲状腺癌中lncRNA TNRC6C-AS1的下调通过上调miR-129-5p的表达来抑制UNC5B,从而抑制细胞增殖、迁移和侵袭[14]。UNC5B在肾癌、前列腺癌组织中呈低表达,通常作为抑癌基因发挥作用[15]。因此,UNC5B-AS1作为UNC5B的转录反义RNA在肿瘤进展中可能发挥癌基因的作用。最近一项研究显示,上调的lncRNA UNC5B-AS1可作为潜在的致癌基因与甲状腺癌淋巴结转移、肿瘤大小和肿瘤组织学类型有关,更重要的是,UNC5B-AS1能够促进乳头状甲状腺癌细胞系的增殖、迁移和侵袭[16]。本实验结果同样显示UNC5B-AS1在肺癌组织和细胞系中呈高表达,下调UNC5B-AS1的表达后,A549细胞黏附、侵袭和迁移能力均明显受到抑制。表明UNC5B-AS1可能促进肺癌细胞黏附、侵袭和迁移,这与上述研究一致。
证据表明,lncRNA作为ceRNA通过选择性吸附miRNA调控肿瘤的发生和发展[17]。在本实验中双荧光素酶报告基因检测实验证明了UNC5B-AS1直接与miR-218-5p结合。且qRT-PCR检测结果显示,UNC5B-AS1能够负向调控miR-218-5p的表达。miR-218-5p被证明是多种癌症(包括肺癌)中的肿瘤抑制因子。例如,Zhu等人证明了miR-218-5p可通过与EGFR结合在抑制肺癌细胞的增殖和迁移中起关键作用[18]。miR-218-5p直接负向调节白喉酰胺生物合成1(DPH1)的表达抑制结直肠癌细胞的活力和侵袭能力[19]。此外,miR-218-5p在妊娠期高血压患者血清中表达减少,且能够抑制滋养层细胞的侵袭和迁移[20]。因此本实验数据首次表明UNC5B-AS1负向调控miR-218-5p的表达促进肺癌A549细胞的黏附、侵袭和迁移。目前普遍认为,EMT与肿瘤细胞的侵袭和迁移密切相关[21]。EMT表现为细胞间黏附能力丧失,导致细胞形态发生改变,使细胞获得运动力及迁移能力。本实验通过Western blotting检测A549细胞中维持上皮细胞特性的分子E-cadherin以及间充质标志分子Vimentin和Twist的表达情况,结果显示,下调UNC5B-AS1能够抑制E-cadherin的表达,并促进Vimentin和Twist的表达。提示UNC5B-AS1对肺癌A549细胞黏附、侵袭和迁移能力的调控作用是通过影响EMT的发生实现的。
综上,本实验结果显示,lncRNA UNC5B-AS1在肺癌组织和细胞系中的表达明显升高,下调UNC5B-AS1可靶向调节miR-218-5p的表达、通过阻碍EMT来抑制肺癌细胞黏附、侵袭和迁移。本研究首次证明了lncRNA UNC5B-AS1和miR-218-5p的靶向关系,且证实UNC5B-AS1可靶向调控miR-218-5p的表达参与肺癌细胞黏附、侵袭和迁移。总之,本研究确定了UNC5B-AS1在肺癌中的致癌作用,提供了对肺癌发生的分子机制的进一步了解,为发现肺癌新型靶向治疗奠定理论基础。

