肝细胞癌切除术后影响手术部位感染的危险因素
王 明,李 明,郑振江,李 川,蒋 利,杨家印,张 抒,文天夫△
1.成都市第三人民医院普通外科,四川成都 610031;2.四川大学华西医院肝脏外科,四川成都 610041
肝细胞癌(简称肝癌)是第五常见的恶性肿瘤,其致死率高居恶性肿瘤第3位[1]。绝大部分肝癌流行于发展中国家,以中国大陆为甚[2]。目前为止,肝癌切除术仍然是一种普及、有效的治疗方式[3]。随着手术器械的日益更新,手术技巧的飞速进步,以及围术期管理的日趋完善,肝癌切除术后致死性并发症发生率越来越低[4],但是术后感染,特别是手术部位感染,越来越受到临床工作者的重视,因为这与患者术后康复时间及医疗费用息息相关[5]。目前,医院感染监测部门都常规组建医院感染监测专业小组,基于医疗记录系统监测包括手术部位感染在内的术后感染并发症。手术部位感染包括表浅切口感染、深部切口感染、器官/腔隙感染[6]。本研究的目的是根据肝癌切除术患者的围术期临床数据,明确手术部位感染的独立危险因素,现报道如下。
1 资料与方法
1.1一般资料 选取2012年2月至2018年2月在四川大学华西医院肝脏外科接受肝癌切除术后经病理检查诊断为肝癌的1 655例患者作为研究对象,排除术前有任何感染、上腹部手术史、联合脏器切除患者,共1 319例患者参与本研究,其中男1 039例,女280例,年龄17~78岁,平均55岁。术前患者肝脏储备功能较好,Child-pugh A级1 243例,Child-pugh B级76例。伴随肝硬化患者913例。有82例(6.2%)肝癌切除术后发生手术部位感染,包括表浅切口感染37例(2.8%),深部切口感染16例(1.2%),器官/腔隙感染29例(2.2%)。根据术后有无感染分为感染组(82例)和非感染组(1 237例)。收集包含术前、术中和术后的临床数据,患者出院后至少随访3个月。首要分析手术部位感染,同时分析住院时间和术后30 d的并发症情况,并比较不同范围肝癌切除术对于手术部位感染的影响。
1.2手术及术后管理 手术采用常规右上腹肋缘下切口,肝脏恶性肿瘤切除术中常规切除胆囊,术中彩超引导下采用超声吸引装置、水刀等设备进行精细断肝,所有大血管和胆道充分暴露后再离断,对渗血或胆漏肝断面使用血管滑线连续缝合加固肝断面(图1)。肝断面处常规放置引流管1根。断肝过程中视情况决定是否采取入肝血流阻断方式控制肝断面出血[7],收缩压控制在90~100 mg Hg,中心静脉压控制在5~6 mm Hg,断肝完毕后恢复基础值。输血与否由麻醉师术中根据具体情况决定,输血指征为血红蛋白水平下降至<7.0 g/L,或出现不可控制的大出血等危急情况。手术结束前使用温热蒸馏水冲洗手术创面;逐层缝合腹腔时,温热生理盐水冲洗切口,使用薇乔抗菌缝线逐层缝合腹腔,关腹前更换外科手套。手术前30 min,静脉滴注抗菌药物,手术时间超过3 h,术中追加抗菌药物。围术期抗菌药物预防性使用72 h。麻醉清醒后立即拔除术中安置的胃管,开始少量多次饮用清水,术后8 h口服10%葡萄糖水100 mL;术后8 h给予静脉使用止痛药物。术后第1天开始口服10%葡萄糖水80 mL,4次/天,乳果糖液15 mL,3次/天(如患者已排气或排便,饮食过渡到流质或半流质饮食,停用10%葡萄糖水和乳果糖液);继续静脉给予止痛药物;专职护理人员鼓励并尽量督促患者下床活动;尿管于术后1 d拔除(有前列腺增生患者术前口服哈乐3 d);患者引流管于术后2 d或3 d经腹部B超检查无异常、无出血、无胆漏后拔除;胆漏定义[8]:腹腔引流管术后连续3 d有胆汁引出或单次引流胆汁量≥100 mL/d,未安置腹腔引流者,术后出现腹膜刺激征,腹腔穿刺抽出胆汁或再次手术发现腹腔内有胆汁聚集。鼓励并尽量督促患者咳嗽、咳痰及深呼吸;术后每天给予抗凝剂低分子肝素钠注射液,每次0.5 mg。患者术后第1个月门诊回访,然后每3个月回访。

图1 精准肝癌切除术中肝断面
1.3统计学处理 采用SPSS21.0统计软件进行数据分析处理。计数资料以例数或百分率表示,不符合正态分布的计量资料以中位数(百分位数)表示;单变量分析后,在Cox比例风险模型的多元分析中,只使用了差异有统计学意义的变量。以P<0.05为差异有统计学意义。
2 结 果
2.1两组患者临床资料比较 见表1。两组患者体质量指数、糖尿病、围术期空腹血糖、清蛋白等临床资料比较,差异均有统计学意义(P<0.05);两组患者性别、年龄、总胆红素、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、血小板、凝血酶原时间、肝功能分级、肝硬化、肝炎、甲胎蛋白、肿瘤数目、肿瘤大小、肿瘤破裂等临床资料比较,差异均无统计学意义(P>0.05)。
2.2术后结果 两组患者住院时间(P<0.05),围术期死亡(P=0.021)有明显差异(表2)。24例患者发生围术期死亡,其中感染组3例,包括肝衰竭2例,败血症1例;非感染组21例,包括肝衰竭11例,肾衰竭4例,脑出血1例,肺部感染1例,肺栓塞3例,腹腔内出血1例。
2.3影响手术部位感染的危险因素 感染组和非感染组性别、年龄、肿瘤参数等方面比较,差异均无统计学意义(P>0.05)。围术期空腹血糖>6.1 mmol/L,手术时间>280 min,术中出血量>800 mL,术后发生胆漏是影响肝癌切除术后发生手术部位感染的独立危险因素(表3)。肝癌切除范围明显影响术后手术部位感染(P<0.05),以及器官/腔隙感染(P<0.05)(表4)。

表1 两组患者临床资料比较

续表1 两组患者临床资料比较
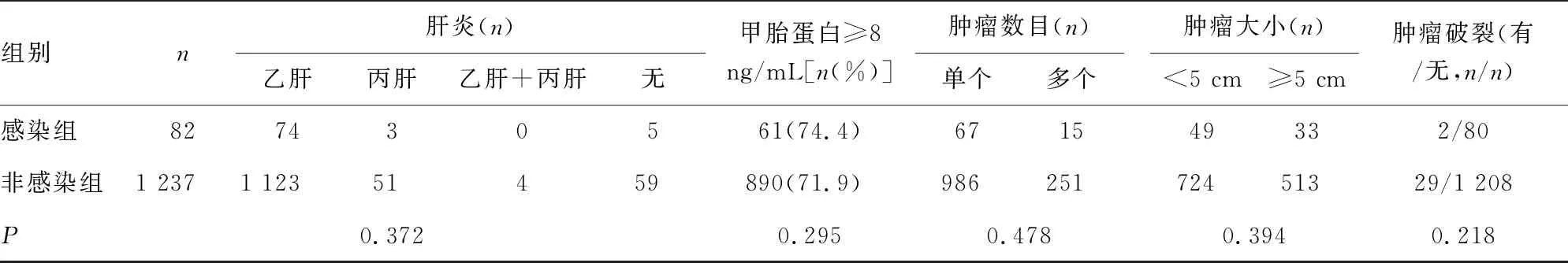
组别n肝炎(n)乙肝丙肝乙肝+丙肝无甲胎蛋白≥8ng/mL[n(%)]肿瘤数目(n)单个多个肿瘤大小(n)<5cm≥5cm肿瘤破裂(有/无,n/n)感染组827430561(74.4)671549332/80非感染组1237112351459890(71.9)98625172451329/1208P0.3720.2950.4780.3940.218
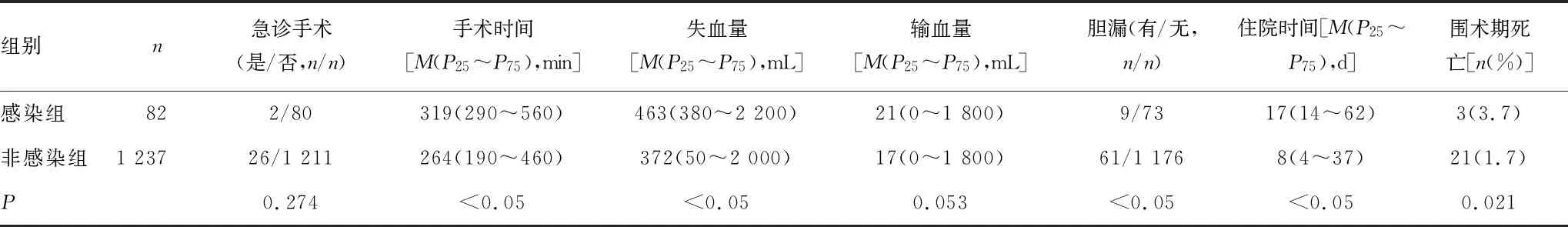
表2 两组患者术中、术后变量比较
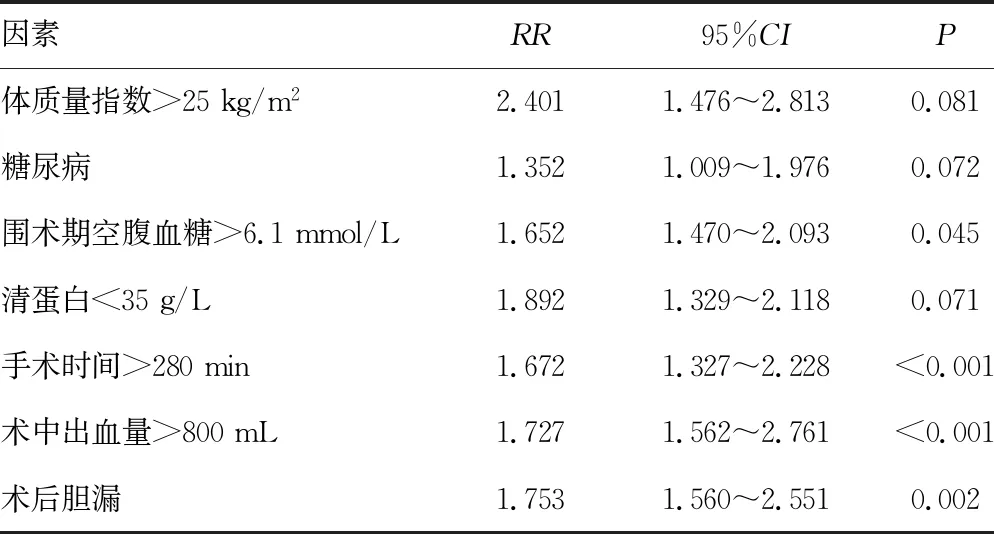
表3 影响手术部位感染的独立危险因素

表4 肝癌切除范围对手术部位感染率的影响[n%]
3 讨 论
有研究表明,糖尿病是围术期发生手术部位感染的独立危险因素[9],但从本研究结果来看,确切地说是围术期的血糖变化范围对手术部位感染的发生率有明显影响,高血糖显然会导致手术部位感染。围术期血糖控制一直是外科的研究热点,尤其对于肝癌切除患者,因为术中会涉及非常复杂的第一、二肝门静脉乃至下腔静脉的阻断、开放,这些操作会造成肝细胞缺血-再灌注损伤及许多炎症因子释放,这些因素将导致强烈的应激反应,造成围术期血糖控制困难[10]。肝癌患者很多伴随肝硬化,肝脏自身功能的调节障碍也会导致术后血糖异常,导致高血糖症状[11]。有研究表明,围术期胰岛素强化治疗可有效控制血糖值[12]。肝癌切除患者围术期最理想的血糖值是多少?一些研究者提出,围术期需保持血糖控制在正常范围内,即空腹血糖<6.1 mmol/L,但要注意发生低血糖[13]。
本研究发现,手术部位感染与手术时间长,术中出血量和术后胆漏相关。较长手术时间可能会影响全身抗菌药物的浓度,导致手术部位发生感染;外科手术时间越长,就越有可能发生手术部位感染[14]。大量术中出血减少了自然杀伤细胞和细胞毒性淋巴细胞的数量[15],降低了术后患者的免疫力。肝癌切除术后胆漏的发生可能为细菌的生长和增殖提供了理想的环境,从而导致手术部位感染发生[16]。
肝癌切除术的范围对手术部位感染有明显影响。进行半肝切除、扩大半肝切除、中肝切除时,肝断面非常大,这就意味着外科医生需要更多的手术时间来进行肝实质离断,当然较大创面会伴随更多的失血。有研究表明,一些特殊的肝切除(中肝切除术、Ⅳ切除术、Ⅷ切除术)会导致较大的创面,暴露出较大的肝格利森纤维鞘,这将导致胆漏风险增高[17]。
近10年来,精细外科理念发展迅速[18],精细肝癌切除术可缩短手术时间,减少失血和降低胆漏发生,有利于减少术后手术部位感染发生率。
本研究不足之处是没有比较分析两组患者的治疗费用,但有研究指出,发生手术部位感染患者的住院时间延长,这意味着医疗费用也增加[19]。ALFONSO等[20]进行了一项更进一步的研究显示,发生手术部位感染的患者不仅住院治疗费用增加,出院后治疗费用同样较高。
本研究有几个局限性,数据没有包含预防性使用抗菌药物。有研究表明,在没有术前感染的情况下,即使手术后没有预防性使用抗菌药物,也不会增加围术期感染的风险[21]。作者已开始了1项前瞻性随机对照试验,以明确其可行性。
综上所述,围术期空腹血糖>6.1 mmol/L、手术时间>280 min、术中出血量>800 mL、术后胆漏、肝切除范围是影响肝癌切除术后发生手术部位感染的独立危险因素,纠正这些因素可降低手术部位感染的发生率,减少患者住院时间及围术期病死率。