麦角甾苷促进大鼠骨折愈合及对骨形态发生蛋白/Runx2 通路的影响
徐亚平,刘岳勇,李 浩,双 峰,杨淮河
(中国人民解放军联勤保障部队第九〇八医院骨科脊柱病区,江西 南昌 330000)
骨折为常见的骨科疾病之一,虽然化学药物[如甲状旁腺素(PTH 1-34)、降钙素等]在治疗骨折方面取得了一定的成效,但由于有一定的毒副作用(如PTH 1-34会增加大鼠发生骨肉瘤的风险),不合适长期使用[1-2]。中医药治疗骨折毒副作用小、疗效好,适合骨折患者长期使用。肉苁蓉是一种寄生在沙漠树木梭梭根部的寄生植物,麦角甾苷为其主要活性成分[3]。根据中医“肾藏精,主骨,生髓”的理论,肉苁蓉具有促进骨愈合、防治骨科疾病的功效,但其在骨科疾病方面的应用研究较少[4]。成骨细胞功能在调节骨代谢中有重要作用,其功能缺乏可能导致骨形成的负面影响,延缓骨折愈合的进程[5]。BMP-2 蛋白在促进成骨细胞分化和成熟方面具有重要作用,可通过调控骨形态发生蛋白(BMP) /Runx2 通路促进骨折愈合[6]。本研究中探讨了麦角甾苷通过调控BMP/Runx2 通路促进骨折愈合,为其临床应用提供参考。现报道如下。
1 材料与方法
1.1 动物、试药与仪器
SD 大鼠(中国食品药品检定研究院,合格证号SCXK <京>2014-0013)。麦角甾苷(中国食品药品检定研究院,批号为190217);复方骨肽注射液(江西康缘桔都药业有限公司,批号为19012503);10%水合氯醛(上海上药新亚药业有限公司,批号为190106)。碱性磷酸酶(ALP)检测试剂盒(南京建成生物科技有限公司);骨Gla 蛋白(BGP)酶联免疫吸附(ELISA)法试剂盒(上海酶联生物科技有限公司);TRIzol(天根生化科技有限公司);RNA 反转录试剂盒和荧光定量PCR 试剂盒(大连TaKaRa 公司)。BMP,骨形态发生蛋白受体瘤基因(BMPRIB),骨形态发生蛋白受体(BMPR)Ⅱ,Runx2 和β-actin PCR 引物序列(上海生工生物工程有限公司):BMP 上 游 引 物5′-GGGACCCGCTGTCTTCTAGT-3′,下 游 引 物5′-TCAACTCAAATTCGCTGAGGAC-3′ ;BMPRIB 上游引物5′-GGCCCTTCTCCAGGACAGA-3′,下 游 引 物5′-GCTGATCATGGCTGGGTTGT-3′;BMPRⅡ上游引物5′-TCTGGAAGCTGTGGGATAGA-3′,下游引物5′-GAGGAGCCT GTGGAGAAA TAC-3′;Runx2 上游引物5′-GACTGTGGTTACCGTCATGGC-3′,下 游 引 物5′-ACTTGGTTTTTCATAACAGCGGA-3′ ;β-actin 上 游 引 物5′-CGTGGACATCCGCAAAGAC-3′,下游引物5′-GCATTTGCGGTGGACGA-3′。INSTRON3382 型生物力学实验机(美国英斯特朗公司);AU5800 型全自动生化分析仪(美国贝克曼公司);HBS-1096B 型酶标仪(南京德铁实验设备有限公司);NanoDrop2000c 型蛋白核酸检测仪(美国Thermo 公司);BIO-RADCFX96 型实时荧光定量PCR 仪(美国BD 公司)。
1.2 动物分组及造模
选取雄性SD 大鼠72 只,体质量180 ~220 g,适应性喂养1 周后进行实验,动物相关处置均符合《中华人民共和国实验动物管理条例》要求。按随机数字表法将大鼠均分为对照组(A 组)、模型组(B 组)、阳性组(C组)和麦角甾苷低、中、高剂量组(D1,D2,D3组)。用10%水合氯醛麻醉大鼠,切开右侧膝关节下皮肤,显露胫骨。B 组、C 组和麦角甾苷组大鼠在膝关节下约1 cm 处用金属锯子锯断胫骨,进行骨折断端复位,用1.0 mm 克氏针进行髓内固定,用生理盐水清洗伤口,逐层关闭伤口,A 组只暴露胫骨不锯断。术后连续3 d 肌肉注射8万U 青霉素预防感染,待大鼠苏醒后回笼。大鼠苏醒后,C 组腹腔注射复方骨肽(5 mg/kg),D1,D2,D3组分别腹腔注射麦角甾苷(20,40,80 mg/kg),A 组和B 组腹腔注射等量生理盐水。术后4 周、8 周从各组大鼠中随机取6 只,进行麻醉后腹主动脉取血,分离血清,-80 ℃保存备用。分离右侧胫骨,进行X 线摄片及骨生物力学检测,分离骨痂组织,-80 ℃保存备用。
1.3 观察指标
X 线摄片和骨生物力学:采用X 线摄像仪照相,观察大鼠胫骨骨折愈合情况;采用生物力学实验机对股骨进行最大荷载(骨折应力)测试和骨结构强度测试(骨压碎力)的骨生物力学测量。
血清中ALP 和BGP 含量:采用全自动生化分析仪检测血清中ALP 的含量,采用ELISA 法试剂盒检测血清中BGP 含量,操作按试剂说明书进行。
骨痂组织中BMP,BMPRIB,BMPRⅡ和Runx2 mRNA 表达水平:取冻存的骨痂组织,加入1 mL TRIzol 后进行总RNA 提取,根据RNA 反转录试剂盒说明合成cDNA,再根据荧光定量PCR 试剂盒说明,制备20 μL反应体系进行扩增。扩增条件为95 ℃30 s 预变性、95 ℃5 s 变性、60 ℃44 s,40 个循环,61 ℃时采集荧光,以β-actin 作为内参,采用2-△△Ct法计算。
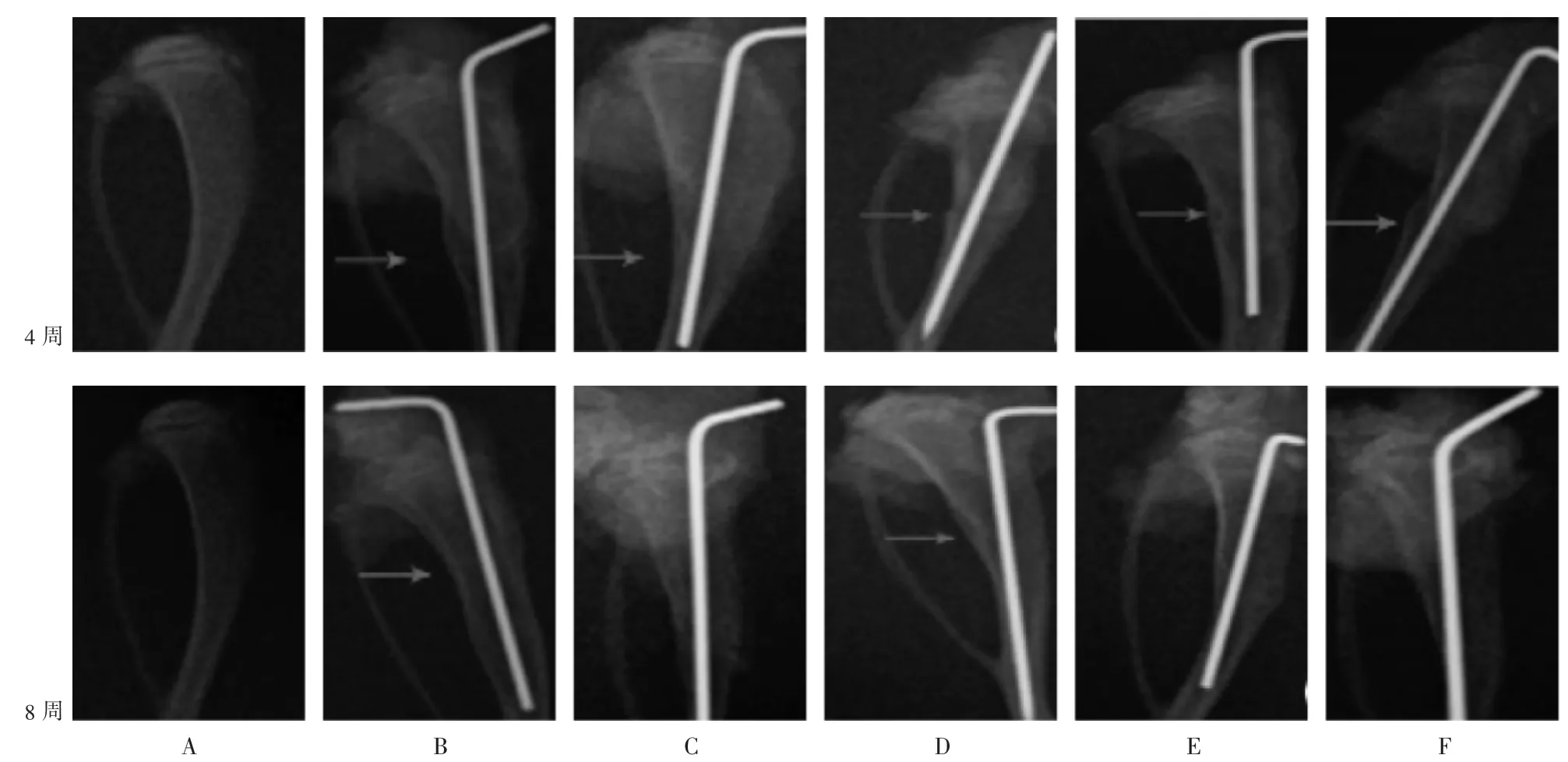
图1 各组大鼠骨折愈合情况
1.4 统计学处理
采用SPSS 19.0 统计软件分析。数据以均数±标准差()表示,用单因素方差分析,多重比较采用SNK-q检验。P <0.05 为差异有统计学意义。
2 结果
2.1 X 线摄片结果
结果见图1。给药4 周后,C 组和D2组、D3组大鼠骨折线完全消失,骨痂减少,但髓腔未通;B 组和D1组骨折线模糊,外骨痂存在。给药8 周后,C 组和麦角甾苷各剂量组完全愈合、髓腔再通,B 组骨折线消失,骨痂减少,但髓腔未通。
2.2 骨折应力和骨折碎力
结果见表1。给药4 周后,与A 组相比,其余各组大鼠骨折应力和骨折碎力均明显下降(P <0.05);与B 组相比,C 组和麦角甾苷各剂量组大鼠骨折应力和骨折碎力均明显上升(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性。给药8 周后,与A 组相比,B 组大鼠骨折应力和骨折碎力均明显上升(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性,C 组和麦角甾苷各剂量组大鼠骨折应力和骨折碎力恢复至正常。
表1 各组大鼠骨折应力和骨折碎力的比较(±s,kg)
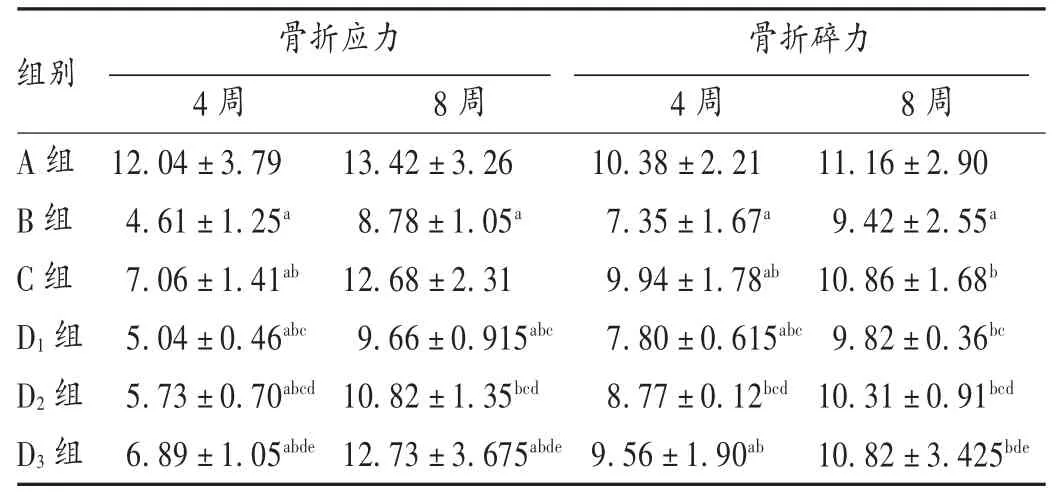
表1 各组大鼠骨折应力和骨折碎力的比较(±s,kg)
注:与A 组比较,a P <0.05;与B 组比较,b P <0.05;与C 组比较,c P <0.05;与D1 组比 较,d P <0.05;与D2 组比较,e P <0.05。下表同。
骨折应力 骨折碎力A 组B 组C 组D1 组D2 组D3 组4 周12.04±3.79 4.61±1.25a 7.06±1.41ab 5.04±0.46abc 5.73±0.70abcd 6.89±1.05abde 8 周13.42±3.26 8.78±1.05a 12.68±2.31 9.66±0.915abc 10.82±1.35bcd 12.73±3.675abde 4 周10.38±2.21 7.35±1.67a 9.94±1.78ab 7.80±0.615abc 8.77±0.12bcd 9.56±1.90ab 8 周11.16±2.90 9.42±2.55a 10.86±1.68b 9.82±0.36bc 10.31±0.91bcd 10.82±3.425bde组别
表2 各组血清ALP 和BGP 含量比较(±s)
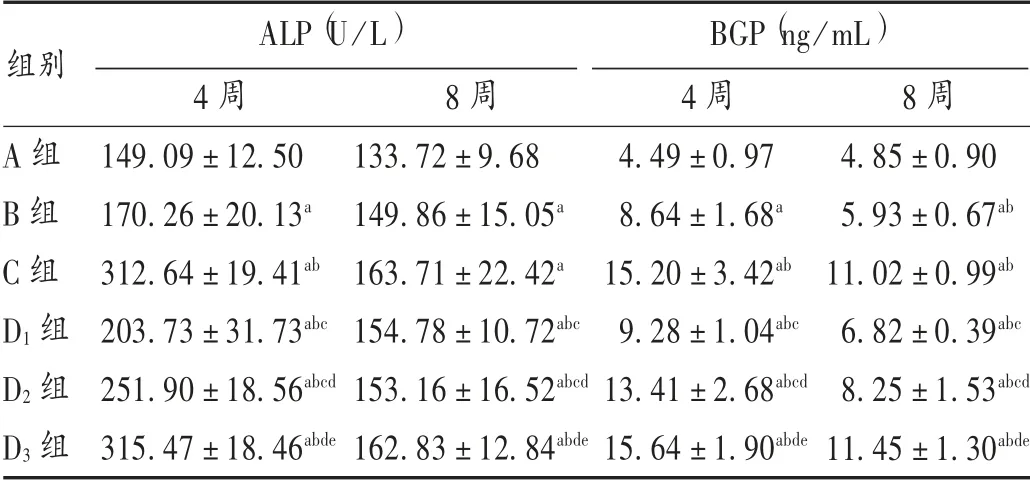
表2 各组血清ALP 和BGP 含量比较(±s)
A 组B 组C 组D1 组D2 组D3 组4 周149.09±12.50 170.26±20.13a 312.64±19.41ab 203.73±31.73abc 251.90±18.56abcd 315.47±18.46abde 8 周133.72±9.68 149.86±15.05a 163.71±22.42a 154.78±10.72abc 153.16±16.52abcd 162.83±12.84abde 4 周4.49±0.97 8.64±1.68a 15.20±3.42ab 9.28±1.04abc 13.41±2.68abcd 15.64±1.90abde 8 周4.85±0.90 5.93±0.67ab 11.02±0.99ab 6.82±0.39abc 8.25±1.53abcd 11.45±1.30abde ALP(U/L) BGP(ng/mL)组别
2.3 血清ALP 和BGP 含量
结果见表2。给药4 周后,与A 组相比,其余各组大鼠血清ALP 和BGP 含量均明显升高(P <0.05);与B 组相比,C 组和麦角甾苷各剂量组血清ALP 和BGP 含量均明显上升(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性。给药8 周后,B 组、C 组和麦角甾苷各剂量组大鼠血清ALP 和BGP 含量均明显下降(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性,但C 组和麦角甾苷各剂量组血清ALP 和BGP 含量仍高于B 组(P <0.05)。
2.4 骨痂组织BMP 和BMPRIB mRNA 表达水平
结果见表3。给药4 周后,与A 组相比,其余各组大鼠骨痂组织BMP 和BMPRIB mRNA 相对表达水平均明显升高(P <0.05);与B 组相比,C 组和麦角甾苷各剂量组骨痂组织BMP 和BMPRIB mRNA 相对表达水平均明显上升(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性。给药8 周后,B 组、C 组和麦角甾苷各剂量组大鼠骨痂组织BMP 和BMPRIB mRNA 相对表达水平均明显下降(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性,但C 组和麦角甾苷各剂量组骨痂组织BMP 和BMPRIB mRNA 相对表达水平仍高于B 组(P <0.05)。
表3 各组骨痂组织BMP 和BMPRIBmRNA 表达水平比较(±s)
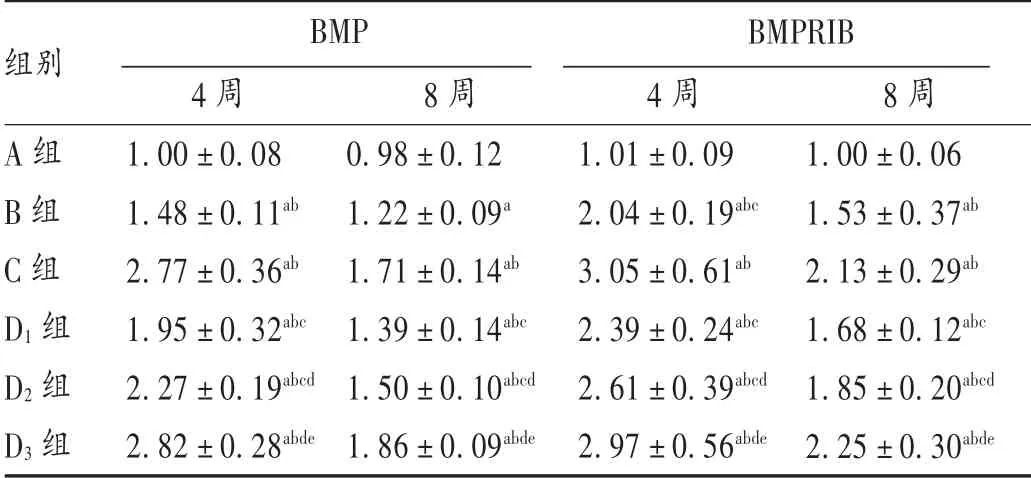
表3 各组骨痂组织BMP 和BMPRIBmRNA 表达水平比较(±s)
A 组B 组C 组D1 组D2 组D3 组4 周1.00±0.08 1.48±0.11ab 2.77±0.36ab 1.95±0.32abc 2.27±0.19abcd 2.82±0.28abde 8 周0.98±0.12 1.22±0.09a 1.71±0.14ab 1.39±0.14abc 1.50±0.10abcd 1.86±0.09abde 4 周1.01±0.09 2.04±0.19abc 3.05±0.61ab 2.39±0.24abc 2.61±0.39abcd 2.97±0.56abde 8 周1.00±0.06 1.53±0.37ab 2.13±0.29ab 1.68±0.12abc 1.85±0.20abcd 2.25±0.30abde组别BMP BMPRIB
2.5 骨痂组织BMPRⅡ和Runx2 mRNA 表达水平
结果见表4。给药4 周后,与A 组相比,其余各组大鼠骨痂组织BMPRⅡ和Runx2mRNA 相对表达水平均明显升高(P <0.05);与B 组相比,C 组和麦角甾苷各剂量组骨痂组织BMPRⅡ和Runx2 mRNA 相对表达水
平均明显上升(P <0.05),麦角甾苷各剂量组反应呈剂
量依赖性。给药8 周后,B 组、C 组和麦角甾苷各剂量组大鼠骨痂组织BMPRⅡ和Runx2 mRNA 相对表达水平均明显下降(P <0.05),麦角甾苷各剂量组反应呈剂量依赖性,但C 组和麦角甾苷各剂量组骨痂组织BMPRⅡ和Runx2 mRNA 相对表达水平仍高于B 组(P <0.05)。
表4 各组骨痂组织BMPRⅡ和Runx2 mRNA 表达水平比较(±s)

表4 各组骨痂组织BMPRⅡ和Runx2 mRNA 表达水平比较(±s)
A 组B 组C 组D1 组D2 组D3 组4 周1.00±0.05 2.34±0.56a 3.92±0.89ab 2.74±0.35abc 3.08±0.41abcd 3.98±0.91abde 8 周1.04±0.09 1.54±0.25a 2.26±0.41ab 1.69±0.52abc 1.87±0.12abcd 2.28±0.39abde 4 周0.99±0.010 2.13±0.56a 4.02±0.20aab 2.52±0.36abc 3.10±0.52abcd 3.94±0.29abde 8 周1.00±0.04 1.40±0.27a 2.23±0.49ab 1.68±0.26abc 1.97±0.14abcd 2.24±0.15abde BMPRⅡ Runx2组别
3 讨论
肉苁蓉为补肾壮阳的传统中草药,麦角甾苷为其主要活性成分,可促进成骨细胞分化及骨愈合,防止骨质疏松等功效[7]。本研究结果表明,麦角甾苷可促进骨折大鼠骨痂形成,改善骨折大鼠愈伤组织的形成,这可能与其通过BMP/Runx2 信号通路促进成骨细胞的募集有关。复方骨肽注射液是临床常用治疗骨折的药物,通过与复方骨肽注射液治疗效果的比较,也进一步证实了麦角甾苷能促进骨折愈合[8]。
ALP 和BGP 在骨形成中起重要作用,ALP 为骨形成过程中的催化剂,从而促进类骨质形成和骨矿化;BGP可维持正常的骨矿化,抑制羟基磷灰石晶体的异常形成和软骨矿化的影响[9-10]。本研究结果显示,麦角甾苷治疗可增加血清ALP 和BGP 水平,但在第8 周时ALP 逐渐恢复至正常水平,而BGP 仍处于较高水平。可能与ALP 是由未成熟的成骨细胞分泌,主要存在于骨折愈合的早期阶段,而BGP 是由成熟的成骨细胞产生的,主要存在于骨折愈合的后期阶段[11-12]。本研究结果表明,麦角甾苷可促进血清骨形成因子分泌,促进骨形成。
多条信号通路(如BMP,Smad 和Runx2 通路)积极参与控制骨形成[13]。BMP 是骨形成的重要蛋白质,能刺激成骨细胞分化和骨形成,因为它的缺失会诱发自发性骨折[14]。BMP/Smad 信号由IB 型和Ⅱ型BMP 受体(即BMPRIB 和BMPRⅡ)及其下游分子Smad1、5 和8 介导,磷酸化的Smad1、5 和8 蛋白与Smad4 形成复合物,然后转运到细胞核中,与其他转录因子相互作用,如Runx2,这是成骨细胞分化的关键转录调控因子,BMP的下游靶点[15-16]。Runx2 蛋白为主转录因子,对于成骨细胞分化的BMP 信号传导的执行和完成至关重要[17]。本研究结果证实,麦角甾苷可促进骨痂组织中BMP,BMPRIB,BMPRⅡ和Runx2 mRNA 的表达,提示BMP/Runx2 信号通路参与了麦角甾苷诱导的骨折愈合。但本研究未测量Smad1、5 和8 蛋白磷酸化水平,同时如MAPK 信号通路在控制细胞增殖和分化中协同或独立地发挥重要作用,p38 MAPK 信号通路可以积极地调节成骨细胞增殖和分化,将在后续研究进行探索和完善[18]。
综上所述,麦角甾苷可促进骨折大鼠的骨折愈合,作用机制可能与激活BMP/Runx2 信号通路有关。

