蓝氏贾第鞭毛虫和微小隐孢子虫双重荧光定量PCR两步法检测技术的建立
李 佳,黄达娜,张晓敏,牛 丛,万成松,张仁利1,
蓝氏贾第鞭毛虫(Giardialamblia)(贾第虫)和微小隐孢子虫(Cryptosporidiumparvum),简称“两虫”,是两种常见的寄生于人与动物肠道的原虫,分别引起贾第虫病和隐孢子虫病,主要通过粪口途径传播,严重时可导致死亡[1]。蓝氏贾第鞭毛虫主要寄生在宿主小肠,主要是十二指肠,可引起腹痛、腹泻及吸收不良等症状。每年全球大约有2亿人感染蓝氏贾第鞭毛虫,在旅游者中发病率较高,因此由蓝氏贾第鞭毛虫引起的腹泻也称为“旅游者腹泻”[2-3]。微小隐孢子虫是专性细胞内寄生原虫,主要寄生于小肠上皮细胞的刷状缘纳虫空泡内,引起宿主腹泻、腹痛,病程多为自限性。免疫缺陷患者的症状更为严重,多并发肠外器官隐孢子虫病,微小隐孢子虫感染也是艾滋病患者并发腹泻死亡的原因之一[4-5]。WHO将隐孢子虫病和贾第虫病列为重要的人兽共患寄生虫病[6];2006年,我国将“两虫”列为《生活饮用水卫生标准》的非常规项目[7]。因此,建立“两虫”的同步定量检测方法具有重要的意义。目前,“两虫”的检测方法主要包括镜检法、免疫学方法、分子生物学方法等。传统的镜检法是“两虫”检测的“金标准”,但耗时耗力,且检出率较低[8]。免疫学方法,如免疫荧光、ELISA,虽然灵敏度和特异性较传统的镜检法有所提高,但前者不能区分虫种,后者易出现交叉反应,不能准确定量,在轻度感染的粪便样本中的应用较差[9]。荧光定量PCR(FQ-PCR)法敏感性高,特异性好,能同时检测大量样本,是同时定量检测“两虫”的首选方法之一。本研究旨在建立TaqMan探针的双重荧光定量PCR检测方法,以实现“两虫”灵敏快速的临床检测。
1 材料与方法
1.1虫体及医源性腹泻样本 蓝氏贾第鞭毛虫、微小隐孢子虫、异尖线虫、弓形虫、肝吸虫、疟原虫和广州管圆线虫均分离自深圳市疾病预防控制中心寄生虫门诊部病人的留存样本,由深圳市疾病预防控制中心病原生物所实验室保存。疑似“两虫”感染病人的医源性腹泻样本均来自深圳市疾病预防控制中心寄生虫门诊部。
1.2试剂与仪器 主要试剂:Premix Ex TaqTM(Probe qPCR)、大肠杆菌DH5α感受态细胞、pMDTM19-T载体、Ex Taq®Hot Start Version购自宝生物工程有限公司;切胶回收试剂盒QIAquick Gel Extraction Kit、DNA提取试剂盒DNeasy Blood & Tissue Kit和QIAamp®Fast DNA Stool Mini Kit购自QIAGEN公司;质粒提取试剂盒E.Z.N.A.®Plasmid Midi Kit购自OMEGA公司。主要仪器:ABI7500荧光定量PCR仪。
1.3 方法
1.3.1引物和TaqMan探针的设计和合成 在GenBank中查找微小隐孢子虫cowp基因序列(GenBank序列号:AB514064.1)和蓝氏贾第鞭毛虫gdh基因序列(GenBank序列号:KM190761.1),根据其保守区域,用Primer Express 3.0软件设计引物和探针,并对所设计的引物和探针在NCBI上进行Blast比对,蓝氏贾第鞭毛虫探针5’端标记VIC荧光基团,微小隐孢子虫5’端标记FAM荧光基团(表1)。引物和探针在生工生物工程(上海)有限公司合成。
表1 荧光定量PCR的引物和TaqMan探针
Tab.1 Primer and TaqMan probe for FQ-PCR

Target SpeciesGenePrimer/probeSequence(5'-3')Length/bpGiardia lambliagdhGIA-FACTCCAACGGGACCATTGTC156GIA-RAGCACTCCCAAGGCTTCTTGGIA-PVIC-CAACGAGGAGAAGCTGGCCCACC-BHQ1Cryptosporidium parvumcowpCRY-FTTGCATTCACTATGCCTGAAAAA115CRY-RAGTATAGTGCCTGGAGGACATTCTGCRY-PFAM-CCCCCAGGATTCGTTTTTTCTGGAAA-TAMRA
1.3.2虫体基因组DNA的提取 医源性腹泻样本参照试剂盒QIAamp®Fast DNA Stool Mini Kit说明书提取DNA;分离的虫体参照试剂盒DNeasy Blood & Tissue Kit说明书提取DNA,提取的DNA于-20 ℃保存备用。
1.3.3质粒标准品的制备 以引物GIA-F/R对蓝氏贾第鞭毛虫基因组DNA进行PCR扩增,同时以引物CRY-F/R对微小隐孢子虫基因组DNA进行PCR扩增。普通PCR反应体系总体积为50 μL,体系组分包括:HS Enzyme 0.25 μL、10x EX Taq buffer 5 μL、dNTP 4 μL、上下游引物(10 μmol/L)各1 μL、DEPC H2O 35.75 μL、DNA模板3 μL。反应条件为:98 ℃ 1 min;98 ℃ 10 s、55 ℃ 30 s、72 ℃ 30 s,共30个循环;72 ℃ 7 min。
1%琼脂糖凝胶电泳后对目的片段进行切胶回收,将回收后的片段连接至pMDTM19-T载体上,连接产物转化至大肠杆菌DH5α感受态细胞,挑取单菌落由生工生物工程(上海)有限公司测序验证。测定浓度后作为质粒标准品于-20 ℃保存备用。
1.3.4引物和探针浓度的优化 根据ABI7500仪器使用说明书构建反应体系,分别对蓝氏贾第鞭毛虫和微小隐孢子虫的引物和探针浓度进行优化。FQ-PCR反应体系总体积为20 μL,体系组分包括:Premix Ex Taq®(Probe qPCR) 10 μL、上下游引物(GIA-F/R、CRY-F/R)终浓度分别为0.2、0.4和0.6 μmol/L、探针(GIA-P、CRY-P)终浓度分别为0.1、0.2和0.3 μmol/L、ROX Reference Dye Ⅱ 0.2 μL、DNA模板2 μL,DEPC H2O补足体积20 μL。实验分组如下:第①②③组的探针浓度为0.1 μmol/L,引物浓度分别为0.2、0.4和0.6 μmol/L;第④⑤⑥组的探针浓度为0.2 μmol/L,引物浓度分别为0.2、0.4和0.6 μmol/L;第⑦⑧⑨组的探针浓度为0.3 μmol/L,引物浓度分别为0.2、0.4和0.6 μmol/L。反应条件:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 34 s(收集荧光),共40个循环。荧光定量PCR后通过比较Ct值、ΔRn值和扩增曲线确定最终的引物和探针浓度。
1.3.5双重FQ-PCR体系的建立 根据2.4中的结果确定体系最优的引物和探针浓度,构建双重FQ-PCR体系。
1.3.6双重FQ-PCR体系灵敏度的评价和标准曲线的绘制 以含有蓝氏贾第鞭毛虫目的片段的质粒DNA pMDTM19-T-GIA和含有微小隐孢子虫目的片段的质粒DNA pMDTM19-T-CRY为模板,进行倍比稀释使其终浓度为100~109copies/μL,将两种模板同时加入同一个反应管中,用建立的双重FQ-PCR体系进行反应,确定其灵敏度,同时以质粒标准品拷贝数的对数值为横坐标,Ct值为纵坐标绘制标准曲线。
1.3.7双重FQ-PCR体系特异性的评价 分别以蓝氏贾第鞭毛虫、微小隐孢子虫、质粒DNA pMDTM19-T-GIA、质粒DNA pMDTM19-T-CRY、弓形虫、异尖线虫、肝吸虫、疟原虫、广州管圆线虫DNA为模板,同时设立DEPC H2O作为阴性对照,用建立的双重FQ-PCR体系进行反应,评价其特异性。
1.3.8双重FQ-PCR体系稳定性和重复性的评价
分别选取浓度为109~105copies/μL的蓝氏贾第鞭毛虫和微小隐孢子虫质粒DNA作为模板,将两种模板同时加入同一个反应管中,用建立的双重FQ-PCR体系进行反应,每个浓度进行3次平行实验,计算其标准差和变异系数,评价其批内稳定性。同时在一周内选取5 d,分别进行检测,每次进行3次平行实验,计算5次结果的标准差和变异系数,评价其批间重复性。
1.3.9双重FQ-PCR和单重FQ-PCR方法一致性的评价 分别选取浓度为102~108copies/μL的蓝氏贾第鞭毛虫和微小隐孢子虫质粒DNA作为模板,同时进行双重FQ-PCR和单重FQ-PCR检测,每个浓度进行3次平行实验,计算其标准差和变异系数,评价双重FQ-PCR和单重FQ-PCR方法的一致性。
1.3.10双重FQ-PCR体系的实际应用评价 分别将来自寄生虫门诊部的疑似“两虫”感染病人的医源性腹泻样本编号为1~6,分别提取核酸作为模板,使用本研究建立的双重FQ-PCR体系进行检测,同时使用商品化金标层析试纸条进行检测,以评价此体系的实际应用价值。
2 结 果
2.1标准质粒的浓度测定 经测定,蓝氏贾第鞭毛虫质粒DNA pMDTM19-T-GIA和微小隐孢子虫质粒DNA pMDTM19-T-CRY的浓度分别为77.13 ng/μL和66.57 ng/μL。经下列公式换算成拷贝数分别为4.51×1011copies/μL和5.28×1011copies/μL。拷贝/μL=浓度(ng/μL)×阿伏伽德罗常数×10-9/(660×碱基数)
2.2引物和探针浓度的优化结果 分别选取浓度为4.51×108copies/μL的蓝氏贾第鞭毛虫质粒DNA pMDTM19-T-GIA和浓度为5.28×108copies/μL的微小隐孢子虫质粒DNA pMDTM19-T-CRY作为模板,根据1.3.4所述的实子分组进行引物和探针浓度的优化。由图1和图2可知,根据ΔRn值最高、Ct值最低的原则,两对引物的最优浓度均为0.4 μmol/L,两对探针的最优浓度均为0.3 μmol/L。
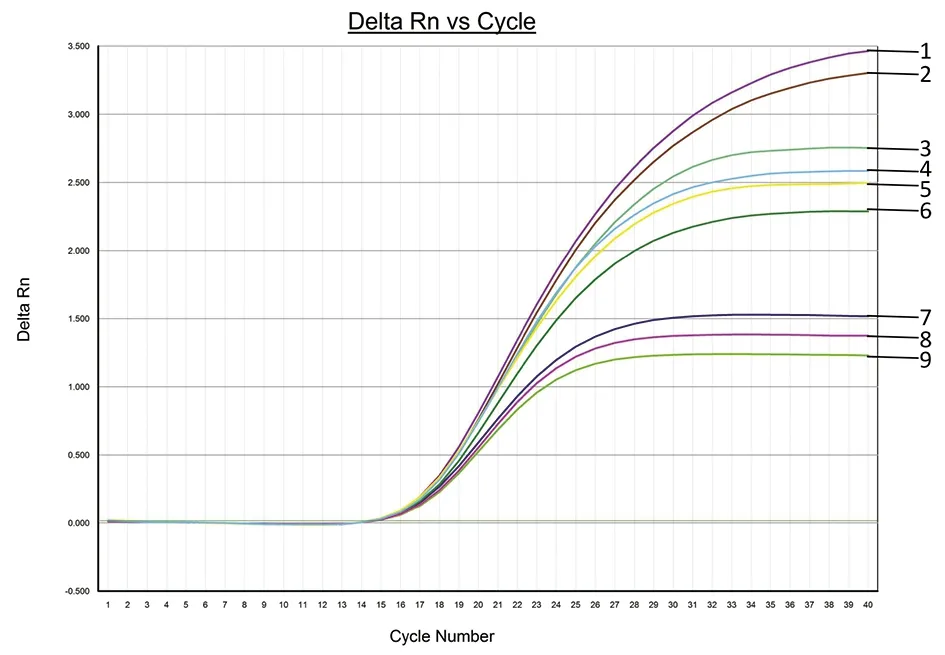
Note: 1为⑧, 2为⑨, 3为⑦, 4为⑥, 5为④, 6为⑤; 7为①, 8为②, 9为③图1 蓝氏贾第鞭毛虫特异性引物(GIA-F/R)和探针(GIA-P)的浓度优化结果Fig.1 Optimization results of Giardia lamblia specific primers and probes
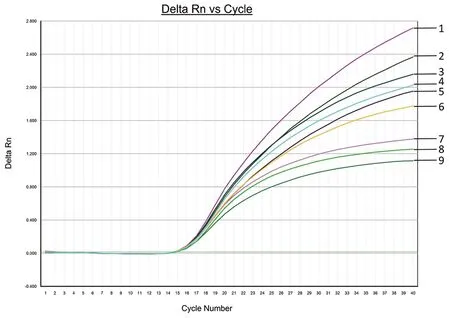
Note: 1为⑧, 2为⑨, 3为⑤, 4为⑥, 5为⑦, 6为④, 7为②, 8为③, 9为①图2 微小隐孢子虫特异性引物(CRY-F/R)和探针(CRY-P)的浓度优化结果Fig.1 Optimization results of Cryptosporidium parvum specific primers and probes
2.3双重FQ-PCR体系的建立 根据2.2引物和探针浓度优化的结果,最终确定双重FQ-PCR体系,体系组分包括:Premix Ex TaqTM(Probe qPCR) 10 μL、GIA-F(10 μmol/L) 0.8 μL、GIA-R(10 μmol/L) 0.8 μL、CRY-F(10 μmol/L) 0.8 μL、CRY-R(10 μmol/L) 0.8 μL、GIA-P(10 μmol/L) 0.6 μL、CRY-P(10 μmol/L) 0.6 μL、ROX Reference Dye Ⅱ 0.2 μL、两虫DNA模板各2 μL,DEPC H2O补足体积至20 μL。用双重FQ-PCR体系检测蓝氏贾第鞭毛虫和微小隐孢子虫样本的结果见图3,结果表明该体系能同时检测两虫或任意一种虫种。
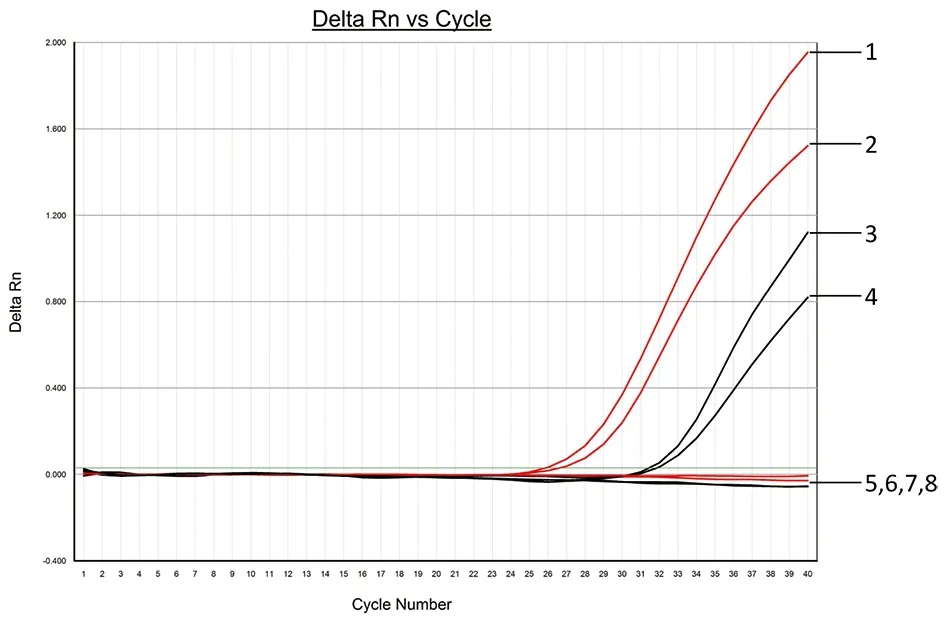
Note: 1,5: Giardia lamblia; 2,4: Giardia lamblia+Cryptosporidium parvum; 3,6: Cryptosporidium parvum; 7,8: DEPC H2O. Red curve was the VIC detection channel (Giardia lamblia); black curve was the FAM detection channel (Cryptosporidium parvum)图3 双重FQ-PCR体系的建立Fig.3 Establishment of duplex FQ-PCR system
2.4双重FQ-PCR体系的灵敏度和标准曲线 以梯度稀释后浓度分别为4.51×109copies/μL~4.51×100copies/μL的质粒DNA pMDTM19-T-GIA和5.28×109copies/μL~5.28×100copies/μL的质粒DNA pMDTM19-T-CRY作为模板,以DEPC H2O作为阴性对照,进行双重FQ-PCR,扩增曲线见图4,结果表明该体系对蓝氏贾第鞭毛虫和微小隐孢子虫检测的灵敏度分别为45.1 copies/μL和52.8 copies/μL。以质粒标准品拷贝数的对数值为横坐标,Ct值为纵坐标绘制标准曲线,结果见图5。双重FQ-PCR体系检测蓝氏贾第鞭毛虫的标准曲线方程为:Ct=-3.08×LOG(copies)+41.57,R2=0.99,扩增效率为111%;检测微小隐孢子虫的标准曲线方程为Ct=-3.2×LOG(copies)+42.17,R2=0.99,扩增效率为105%。结果表明该体系在浓度为109copies/μL~101copies/μL之间具有良好的线性关系。
2.5双重FQ-PCR体系的特异性 利用双重FQ-PCR体系同时检测蓝氏贾第鞭毛虫、微小隐孢子虫、质粒DNA pMDTM19-T-GIA(浓度为4.51×107copies/μL)、质粒DNA pMDTM19-T-CRY(浓度为5.28×107copies/μL)、弓形虫、异尖线虫、肝吸虫、疟原虫、广州管圆线虫DNA,以DEPC H2O作为阴性对照,扩增曲线见图6。结果表明该体系能分别或同时检测出蓝氏贾第鞭毛虫和微小隐孢子虫的DNA,且对其它虫种DNA检测结果均为阴性,体系特异性良好。
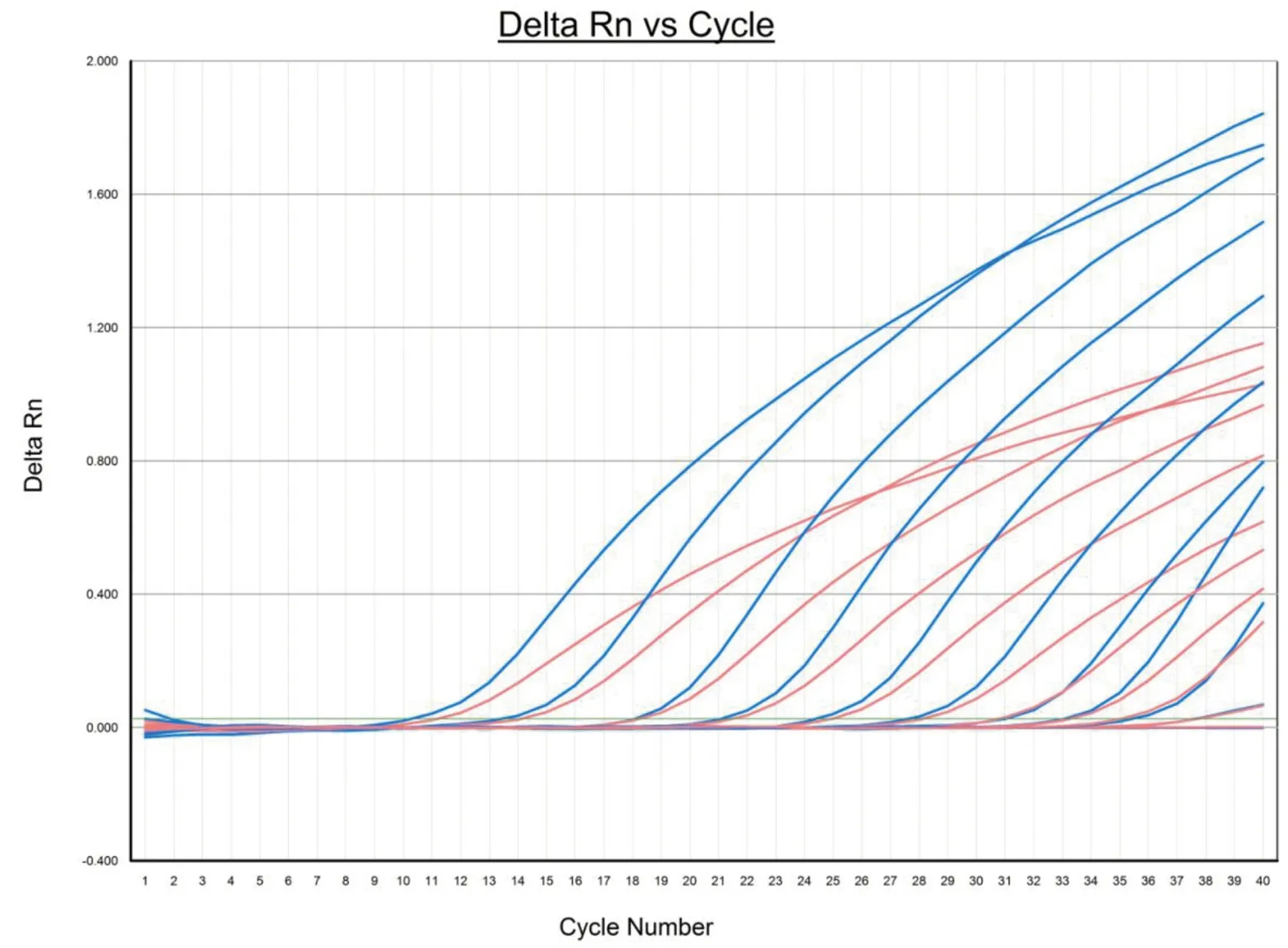
Note: The concentration of the plasmid standard from left to right in the amplification curve was 4.51×109 copies/μL~4.51×100 copies/μL(Giardia lamblia) and 5.28×109 copies/μL~5.28×100 copies/μL(Cryptosporidium parvum). The bottom line was DEPC H2O. The blue curve was the FAM detection channel (Cryptosporidium parvum); the red curve was the VIC detection channel (Giardia lamblia)图4 质粒标准品扩增曲线Fig.4 Plasmid standard amplification curve
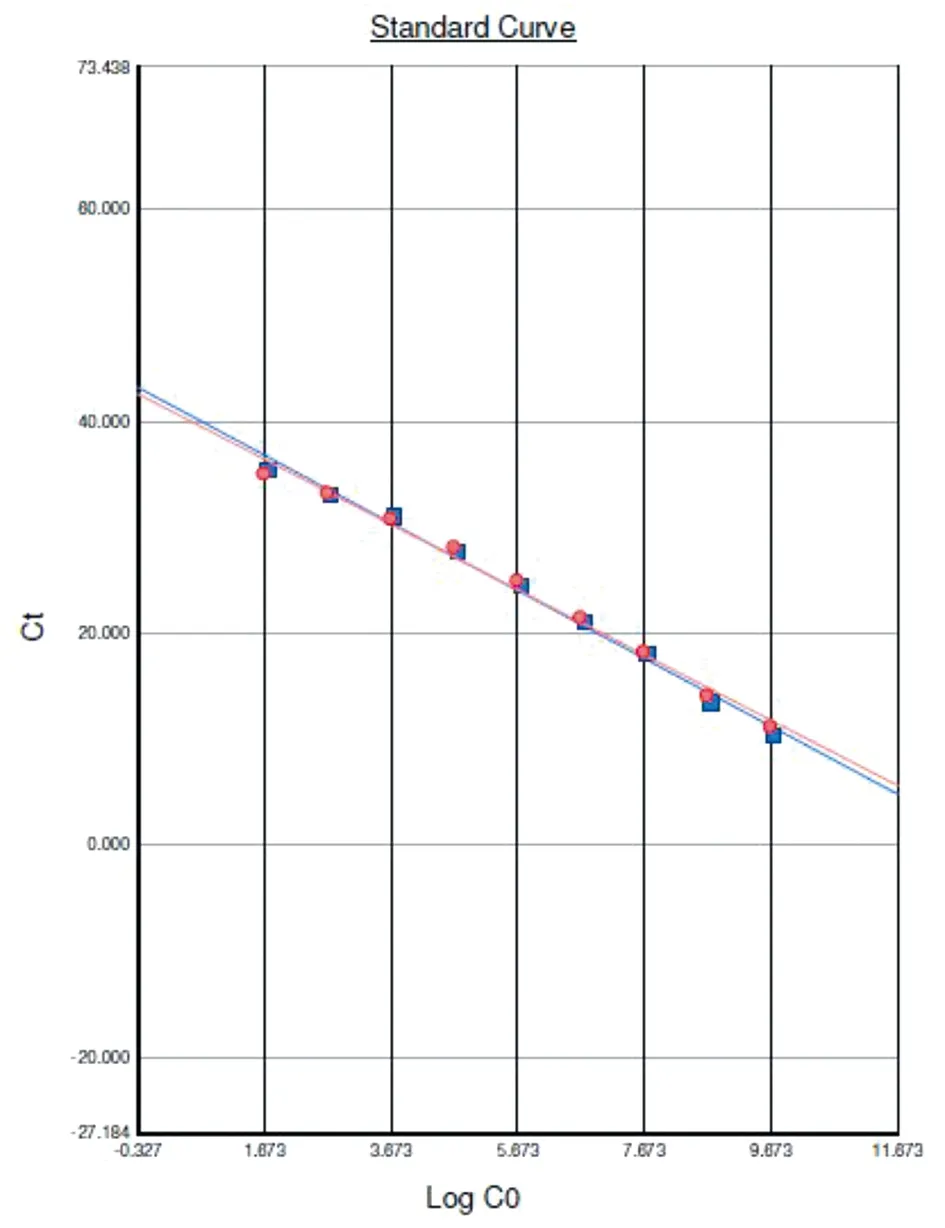
Note: The blue line is the standard curve of Cryptosporidium parvum; the red line is the standard curve of Giardia lamblia.图5 双重FQ-PCR的标准曲线Fig.5 Standard curve of duplex FQ-PCR
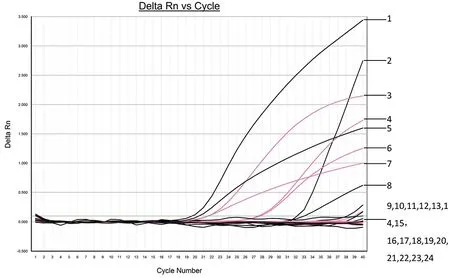
Note: 1,9: Plasmid DNA pMDTM19-T-CRY; 2,10: Cryptosporidium parvum; 3,11: Plasmid DNA pMDTM19-T-GIA; 4,12: Giardia lamblia; 5,7: Plasmid DNA pMDTM19-T-CRY+ Plasmid DNA pMDTM19-T-GIA; 6,8: Cryptosporidium parvum+Giardia lamblia; 13,14: Toxoplasma Gondii; 15,16: Anisakis; 17,18: Liver fluke; 19,20: Plasmodium; 21,22: Angiostrongylus cantonensis; 23,24: DEPC H2O. The black curve is the FAM detection channel (Cryptosporidium parvum); the red curve is the VIC detection channel (Giardia lamblia).图6 双重FQ-PCR的特异性扩增曲线Fig.6 Specific amplification curve of duplex FQ-PCR
2.6双重FQ-PCR体系稳定性和重复性 双重FQ-PCR的批内稳定性实验见表2,结果显示,蓝氏贾第鞭毛虫质粒DNA每个稀释度的3个平行反应管Ct值的变异系数均在1.16%以下;微小隐孢子虫质粒DNA每个稀释度的3个平行反应管Ct值的变异系数均在0.62%以下,证明该体系检测两虫的批内稳定性良好。双重FQ-PCR的批间重复性实验见表3,结果表明,蓝氏贾第鞭毛虫质粒DNA每个稀释度5次实验中,3个平行反应管Ct值的变异系数均在3.81%以下;微小隐孢子虫质粒DNA每个稀释度5次实验中,3个平行反应管Ct值的变异系数均在3.39%以下,证明该体系检测两虫的批间重复性良好。
2.7双重FQ-PCR和单重FQ-PCR方法的一致性
双重FQ-PCR和单重FQ-PCR方法一致性实验结果见表4,两种方法检测微小隐孢子虫Ct值的变异系数在2.21%以下;检测蓝氏贾第鞭毛虫Ct值的变异系数在1.60%以下,证明该体系与单重FQ-PCR检测结果具有较好的一致性。
表2 双重FQ-PCR的批内稳定性
Tab.2 Intra-assay stability of duplex FQ-PCR
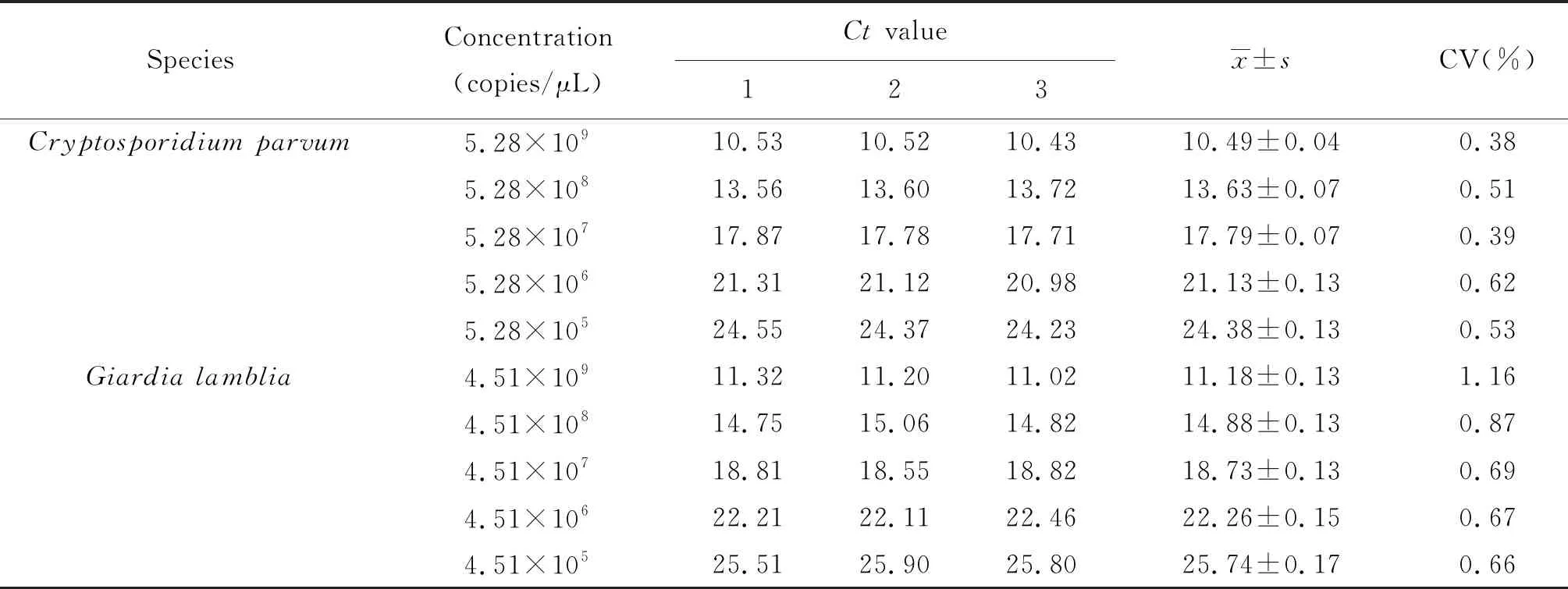
SpeciesConcentration(copies/μL)Ct value123x±sCV(%)Cryptosporidium parvum5.28×10910.5310.5210.4310.49±0.040.385.28×10813.5613.6013.7213.63±0.070.515.28×10717.8717.7817.7117.79±0.070.395.28×10621.3121.1220.9821.13±0.130.625.28×10524.5524.3724.2324.38±0.130.53Giardia lamblia4.51×10911.3211.2011.0211.18±0.131.164.51×10814.7515.0614.8214.88±0.130.874.51×10718.8118.5518.8218.73±0.130.694.51×10622.2122.1122.4622.26±0.150.674.51×10525.5125.9025.8025.74±0.170.66
表3 双重FQ-PCR的批间重复性
Tab.3 Inter-assay repeatability of duplex FQ-PCR
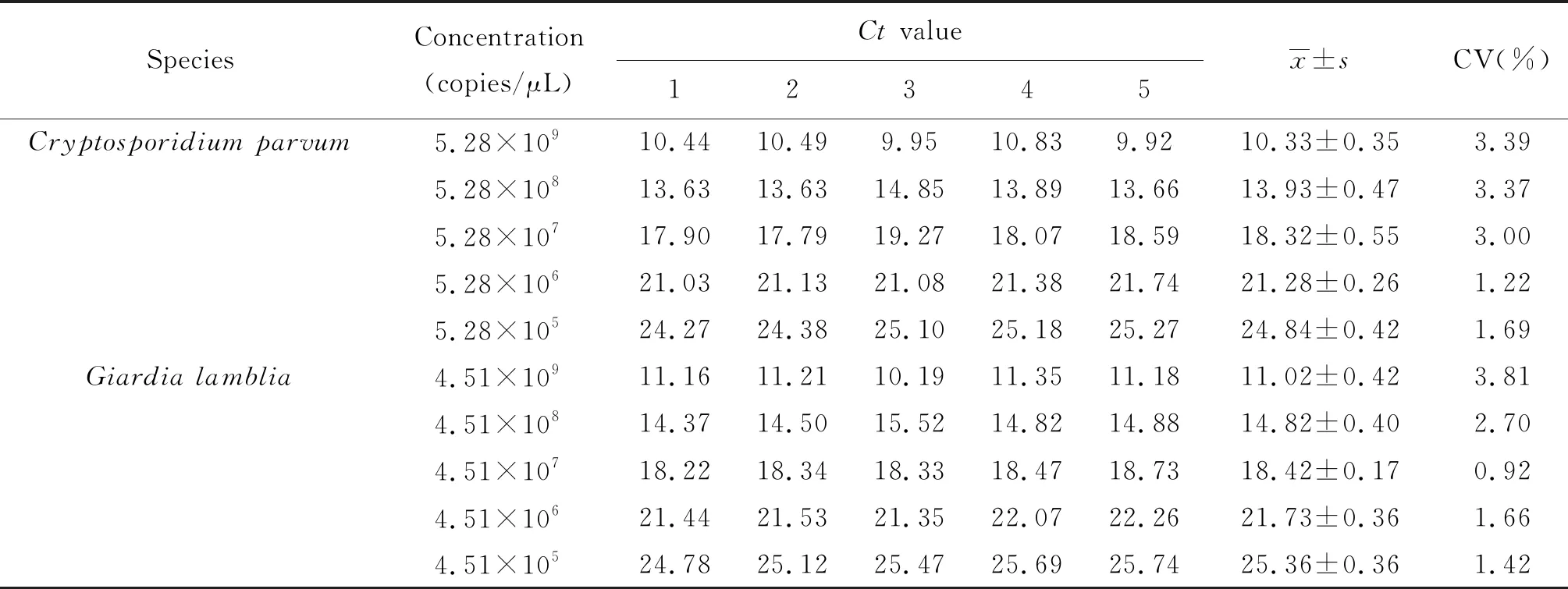
SpeciesConcentration(copies/μL)Ct value12345x±sCV(%)Cryptosporidium parvum5.28×10910.4410.499.9510.839.9210.33±0.353.395.28×10813.6313.6314.8513.8913.6613.93±0.473.375.28×10717.9017.7919.2718.0718.5918.32±0.553.005.28×10621.0321.1321.0821.3821.7421.28±0.261.225.28×10524.2724.3825.1025.1825.2724.84±0.421.69Giardia lamblia4.51×10911.1611.2110.1911.3511.1811.02±0.423.814.51×10814.3714.5015.5214.8214.8814.82±0.402.704.51×10718.2218.3418.3318.4718.7318.42±0.170.924.51×10621.4421.5321.3522.0722.2621.73±0.361.664.51×10524.7825.1225.4725.6925.7425.36±0.361.42
2.8双重FQ-PCR体系的实际应用评价 双重FQ-PCR体系对来自寄生虫门诊部的疑似“两虫”感染病人的医源性腹泻样本所提取的核酸的检测结果见图7,结果显示,此方法不仅能有效地检测出蓝氏贾第鞭毛虫或微小隐孢子虫阳性样本的核酸,且互不干扰,还能同时检测出“两虫”阳性样本的核酸。与此同时,我们同时用现有商品化的金标层析法检测了样本,并与本实验所建立的双重FQ-PCR方法进行比较,结果见表5,结果显示两种方法检测样本的符合率为100%,表明此体系有较好的实际应用价值。
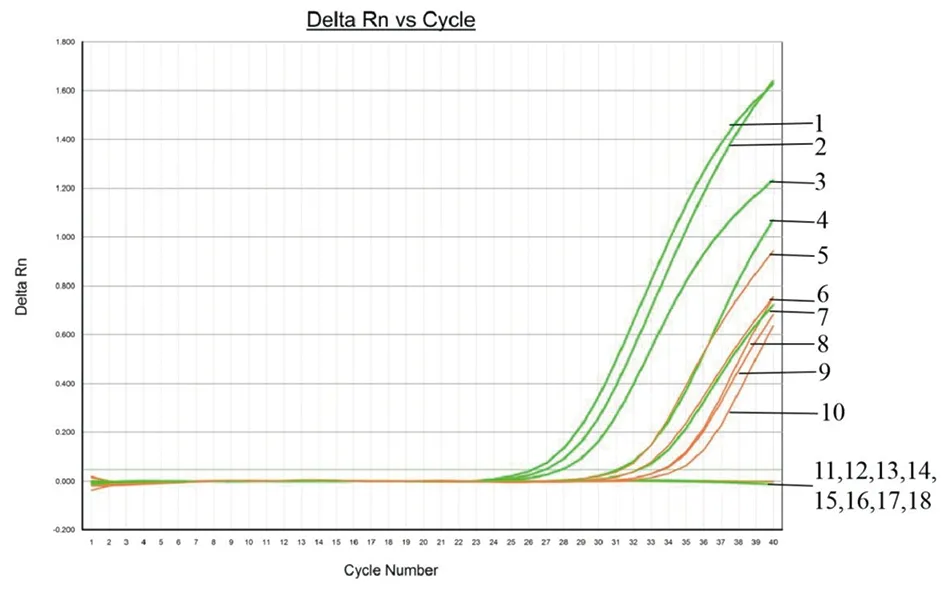
Note: 1,11: sample 1; 2,12: sample 3; 3,6: sample 2+sample 3; 4,13: sample 4; 5,14: sample 2; 7,9: sample 4+sample 5; 8,15: sample 5; 10,16: sample 6; 17,18: DEPC H2O. The orange curve is the FAM detection channel (Cryptosporidium parvum); the green curve is the VIC detection channel (Giardia lamblia).图7 双重FQ-PCR的实际应用评价Fig.7 Practical evaluation of duplex FQ-PCR
表4 双重FQ-PCR和单重FQ-PCR方法的一致性
Tab.4 Consistency of duplex FQ-PCR and single FQ-PCR methods
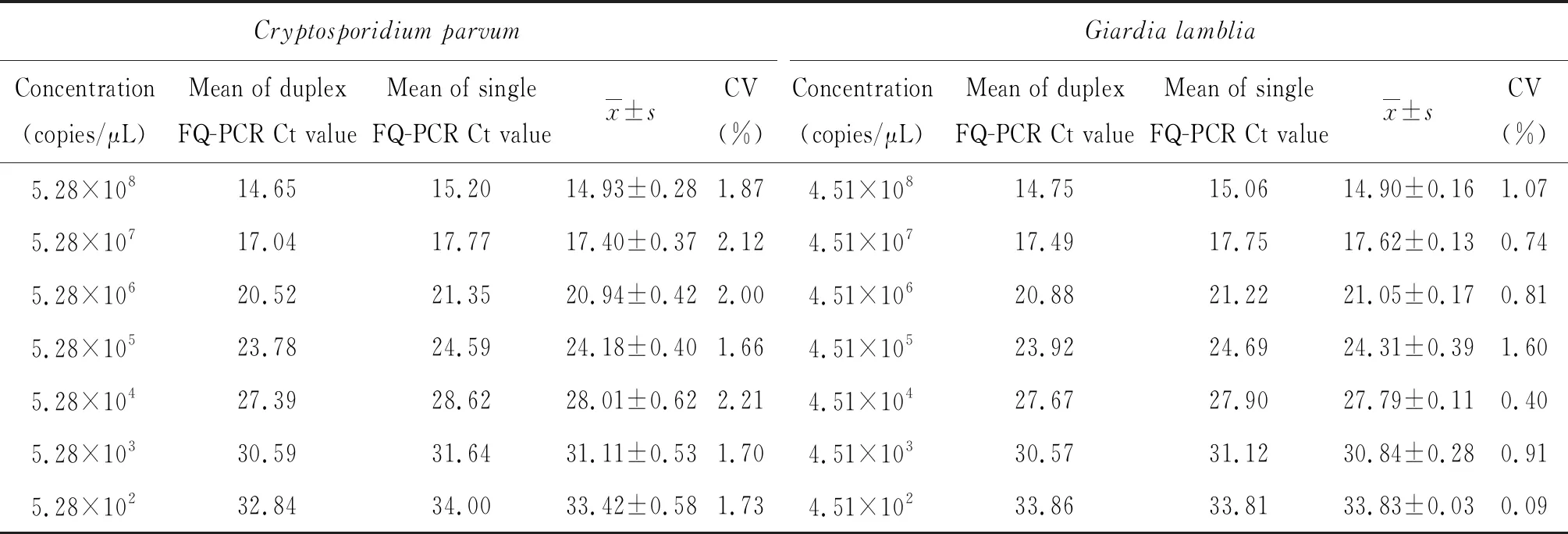
Cryptosporidium parvumGiardia lambliaConcentration(copies/μL)Mean of duplex FQ-PCR Ct valueMean of single FQ-PCR Ct valuex±sCV(%)Concentration(copies/μL)Mean of duplex FQ-PCR Ct valueMean of single FQ-PCR Ct valuex±sCV(%)5.28×10814.6515.2014.93±0.281.874.51×10814.7515.0614.90±0.161.075.28×10717.0417.7717.40±0.372.124.51×10717.4917.7517.62±0.130.745.28×10620.5221.3520.94±0.422.004.51×10620.8821.2221.05±0.170.815.28×10523.7824.5924.18±0.401.664.51×10523.9224.6924.31±0.391.605.28×10427.3928.6228.01±0.622.214.51×10427.6727.9027.79±0.110.405.28×10330.5931.6431.11±0.531.704.51×10330.5731.1230.84±0.280.915.28×10232.8434.0033.42±0.581.734.51×10233.8633.8133.83±0.030.09
表5 疑似“两虫”感染的医源性腹泻样本两种检测方法的比较
Tab.5 Comparison of two detection methods for iatrogenic diarrhea samples suspected of "two insects" infection
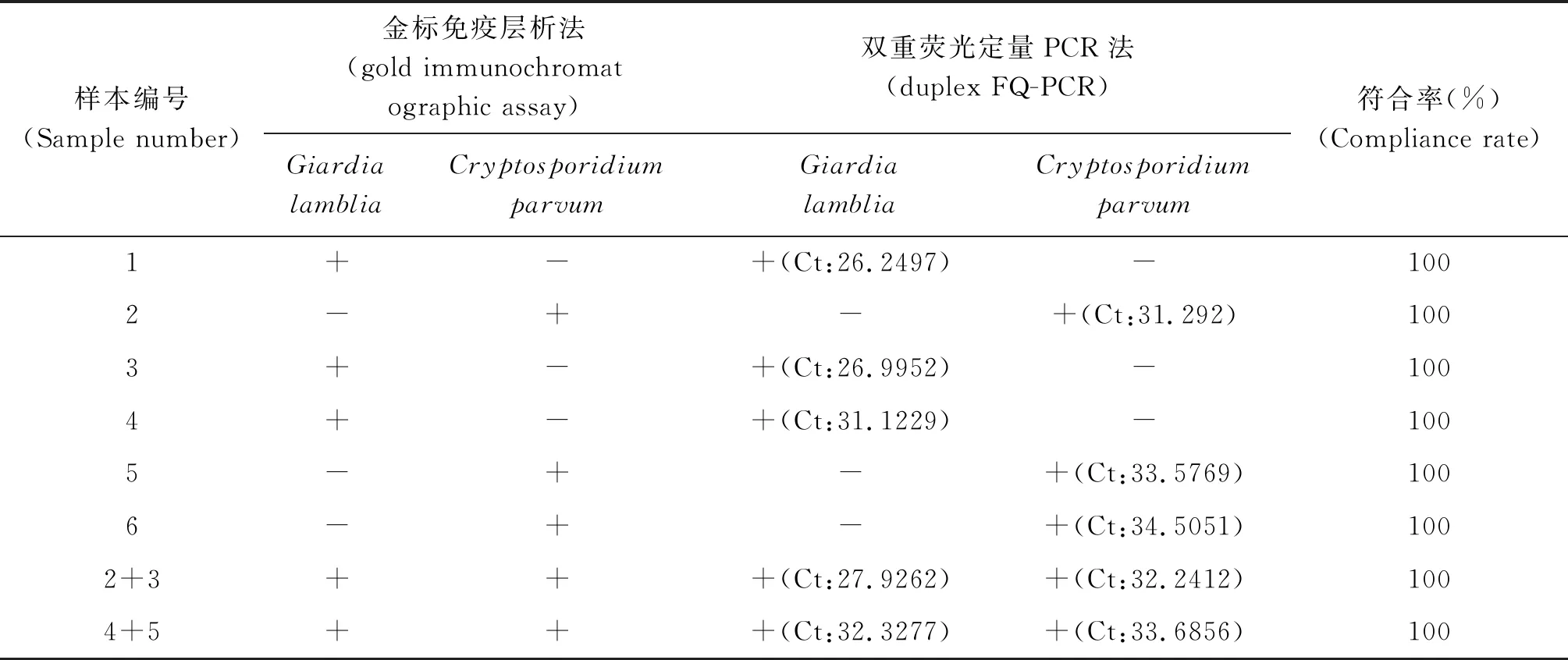
样本编号(Sample number)金标免疫层析法(gold immunochromat ographic assay)双重荧光定量PCR法(duplex FQ-PCR)Giardia lambliaCryptosporidium parvumGiardia lambliaCryptosporidium parvum符合率(%)(Compliance rate)1+-+(Ct:26.2497)-1002-+-+(Ct:31.292)1003+-+(Ct:26.9952)-1004+-+(Ct:31.1229)-1005-+-+(Ct:33.5769)1006-+-+(Ct:34.5051)1002+3+++(Ct:27.9262)+(Ct:32.2412)1004+5+++(Ct:32.3277)+(Ct:33.6856)100
3 讨 论
自20世纪以来,蓝氏贾第鞭毛虫和微小隐孢子虫在全球范围内均有报道,每年感染“两虫”的患者约200万例[10]。发达国家中微小隐孢子虫感染率约为0.1%~9.1%,蓝氏贾第鞭毛虫感染率约为0.2%~29.2%;而在我国微小隐孢子虫感染率约为0.3%~16.1%,蓝氏贾第鞭毛虫感染率约为0.4%~16.2%[11-12]。近年来“两虫”的感染形式愈发严峻,其宿主广泛,进入人体后会造成严重的健康损害,感染动物后会造成畜牧业和养殖业巨大的经济损失。因此,建立一种快速、准确、特异的“两虫”检测方法是具有重要意义的。
相比于传统的镜检法、免疫学方法等,FQ-PCR技术以其准确性高、特异性强、重复性好等优点,已经成为分子生物学领域内应用越来越广泛的技术之一,也是“两虫”检测的首选方法之一。多重PCR通过使用一对以上引物同时识别一个以上靶序列,在一个反应中同时扩增多个靶序列,在提高通量的同时降低反应成本[13],早在1988年Chamberian[14]就首次采用了多重PCR技术;杨晓华等[15]曾建立分别检测蓝氏贾第鞭毛虫和微小隐孢子虫的FQ-PCR方法;Shin等[16]建立了同时检测微小隐孢子虫、环孢子虫和蓝氏贾第鞭毛虫的多重FQ-PCR方法,方法检测前两者的灵敏度为2×101copies/μL,而检测蓝氏贾第鞭毛虫的灵敏度为2×103copies/μL;高宇航等[17]建立了实验用羊十二指肠贾第虫与微小隐孢子虫双重PCR检测方法,该方法最低可检测每克样品中5×102个十二指肠贾第虫和微小隐孢子虫的包(卵)囊。在本实验中,我们选取常用于分离鉴定寄生虫的基因作为靶基因:微小隐孢子虫的卵囊壁蛋白(cowp)和蓝氏贾第鞭毛虫的谷氨酸脱氢酶(gdh)基因[18-19];采用FAM和VIC作为荧光报告基团;同时设计了“变性—退火延伸”两步法进行PCR扩增,整个过程仅需55 min,在提高反应通量的同时缩短反应时间。本研究建立的以TaqMan探针为基础的双重FQ-PCR检测体系不仅能在同一反应管中同时检测“两虫”,而且具有良好的特异性和灵敏性。“两虫”检测的灵敏度分别为4.51×10 copies/μL和5.28×10 copies/μL,稳定性和重复性均在3.81%以下。同时我们通过检测疑似“两虫”感染的医源性腹泻样本,对建立的FQ-PCR体系和现已商品化的金标层析法进行比较,结果表明两种具有较好的一致性,体现了建立的FQ-PCR体系较好的实际应用价值。
综上,本研究建立的双重FQ-PCR技术灵敏度高,特异性强,稳定性和重复性好,可用于“两虫”快速、特异、准确的定量检测。
利益冲突:无
引用本文格式:李佳, 黄达娜, 张晓敏,等.蓝氏贾第鞭毛虫和微小隐孢子虫双重荧光定量PCR两步法检测技术的建立[J].中国人兽共患病学报,2020,36(1):32-39. DOI: 10.3969/j.issn.1002-2694.2019.00. 191

