小鼠miR-144/451降低红细胞活性氧簇水平抑制AKT蛋白磷酸化的实验研究
许 蕾, 杨 蕾, 吴 凡, 严 莹, 杭 筱, 郁多男
(扬州大学医学院江苏省非编码RNA基础与临床转化重点实验室, 江苏 扬州, 225009)
活性氧簇(ROS)是指氧来源的自由基,包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(OH-)、臭氧(O3)、单线态氧等[1-2]。许多正常的细胞活动均会持续产生ROS, 生理情况下ROS会被广泛表达的抗氧化蛋白如超氧化物歧化酶(SOD)、过氧化氢酶(Cat)和谷胱甘肽过氧化物酶(GPx)等所拮抗,因而不会对造成细胞损伤[3]。
AKT又称蛋白激酶B(PKB),是一种丝氨酸/苏氨酸蛋白激酶,是磷脂酰肌醇3激酶(PI3K)/AKT信号通路的关键分子[4]。在各种因素的刺激作用下, AKT发生磷酸化(p-AKT)而被激活。AKT在多种细胞调节过程中扮演重要角色,如糖代谢、增殖、分化和迁移等[5-6]。研究[7]表明在氧化应激过程中AKT也起到非常重要的作用。
微小核糖核酸(miRNA)是一类非编码的小分子RNA, 长度为18~25核苷酸(nt)[8]。miR-144/451是在红细胞内高度表达,在物种进化中高度保守的基因簇[9]。本课题组前期研究[10]发现miR-144/451敲除后,小鼠红细胞中ROS水平增高,红细胞抗氧化能力下降。其机制是miR-144/451敲除后,其靶基因Ywhaz在红细胞中表达增加,引起Ywhaz蛋白产物14-3-3ζ与抗氧化转录因子叉头转录因子O亚型3(FOXO3)结合,迫使FOXO3从细胞核内转移到细胞核外,使得被其直接转录的抗氧化酶Cat和GPx1表达下降[11]。本研究发现,在miR-144/451 KO小鼠中, miR-144/451靶基因Ywhaz(14-3-3ζ)的表达增高可以引起AKT的磷酸化,但是14-3-3ζ的增高并不是AKT磷酸化的主要原因,14-3-3ζ增高引起的ROS水平的增高才是AKT急剧磷酸化的主要原因。
1 材料与方法
1.1 试验动物
miR-144/451基因敲除(KO)鼠是利用传统的重组方法敲除包含miR-144及miR-451前体在内的共388个核苷酸序列。miR-144/451 敲除鼠的具体构建方法及基因型鉴定见参考文献[11], 实验动物的使用经过扬州大学医学院动物伦理委员会批准。
1.2 细胞培养
小鼠纤维母细胞NIH3T3、红系前体细胞系G1E细胞、人类宫颈癌Hela细胞由美国宾夕法尼亚大学/费城儿童医院提供。培养方法详见参考文献[11]。
1.3 骨髓有核红细胞磁珠分选
将8~10周龄野生型(WT)和miR-144/451 KO小鼠的骨髓细胞制成细胞悬液,用70.0 μm滤器过滤后,转移至15.0 mL离心管中, 4 ℃下1 000转/min离心5 min, 弃上清,加入3.0 mL红细胞裂解液(南京福麦斯公司),冰上裂解10 min, 去除骨髓中的成熟红细胞,加入10.0 mL PBS终止裂解,离心,弃上清,用100.0 μL PBS重悬细胞,每管细胞悬液中加入20.0 μL Ter119磁珠抗体(德国美天旎公司),混匀后4 ℃孵育25 min, 加入10.0 mL PBS终止孵育,离心,弃上清, 500.0 μL PBS重悬细胞后,磁珠分选架(德国美天旎公司)进行阳选,收集Ter119阳性的细胞即骨髓有核红细胞。
1.4 小鼠外周血红细胞ROS流式细胞检测
使用8~10周龄WT和miR-144/451 KO小鼠各6只,经目内眦采血得到2种小鼠的外周血,流式管中每管加入PBS 0.5 mL, 再加入外周血0.2 μL。加入Ter119-APC(美国BD公司)和CD71-PE(美国BD公司)2种抗体进行孵育,终止后用ROS检测试剂DCFH-DA(美国Invitrogen)孵育标记,工作浓度为1∶1 000,避光37 ℃下孵育25 min, PBS终止洗涤离心重悬,用流式细胞仪检测细胞的荧光强度。流式实验数据使用Flowjo软件分析外周血红细胞的2′, 7′-二氯荧光黄双乙酸盐(DCFH)平均荧光强度(MFI),即可反映ROS相对水平。
1.5 Ywhaz过表达
将Ywhaz的全长mRNA克隆到pBABE-puro逆转录病毒载体上,将pBABE-Ywhaz与pBABE-puro质粒转染至293T细胞中,制备逆转录病毒,收取转染后48~60 h病毒上清液,感染红系前体细胞系G1E细胞。继续培养48 h后,用质量浓度为1.0 μg/mL嘌呤霉素进行筛选。取嘌呤霉素筛选3 d后阳性率90%以上的细胞进行后续实验,通过Western Blot验证Ywhaz的过表达。
1.6 Western Blot
各组细胞处理后提取总蛋白,加入上样缓冲液,12% SDS-PAGE电泳,结束后转膜, 125 mA电流下4 ℃转膜 120 min, 封闭2 h, 一抗4 ℃孵育过夜,室温漂 洗3次,加入二抗室温孵育1 h后漂洗3次,化学发光液(苏州新赛美公司)显影,凝胶成像。β-actin检测作为内对照。Image J软件分析条带光密度。使用的抗体如下: β-actin(Sigma)、p-AKT(Cell Signaling)、Ywhaz(Santa Cruz Biotechnology)。
1.7 统计学分析
2 结 果
2.1 miR-144/451 KO小鼠外周血红细胞中ROS
水平明显升高
为了检测miR-144/451 KO小鼠外周血红细胞ROS水平,作者分别取8~10周龄WT和miR-144/451 KO小鼠外周血,首先采用Ter119-APC、CD71-PE抗体标记小鼠外周血红细胞,采用DCFH-DA检测小鼠外周血红细胞ROS水平,流式细胞分析发现miR-144/451 KO小鼠的红细胞ROS水平明显增高。miR-144/451 KO小鼠的红细胞ROS水平的平均荧光强度均值为730, 高于WT小鼠的平均荧光强度均值397,差异有统计学意义(P<0.05)。见图1。这些结果表明miR-144/451敲除后,红细胞中ROS水平升高,红细胞的抗氧化能力下降。

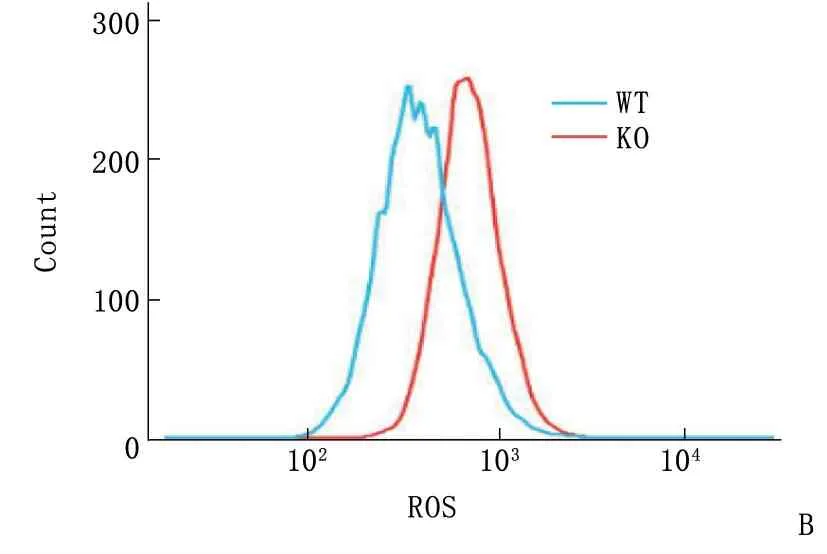
A: 流式检测Ter119标记的外周血红细胞; B: 外周血红细胞中ROS荧光强度。
图1 miR-144/451敲除后外周血红细胞中ROS水平增高(n=6)
2.2 miR-144/451 KO小鼠骨髓有核红细胞中
p-AKT水平明显升高
作者前期研究[11]发现, miR-144/451 KO小鼠ROS水平增高与miR-451的靶基因Ywhaz增高有关,即Ywhaz表达增高引起更多的Ywhaz的蛋白产物14-3-3ζ与抗氧化转录因子Foxo3的结合,抑制了Foxo3的入核。为了验证miR-144/451 KO小鼠的骨髓有核红细胞中AKT是否被激活,作者采用磁珠分选分别得到2种不同基因型小鼠的骨髓有核红细胞,提取蛋白后进行Western Blot检测,结果发现miR-144/451 KO小鼠骨髓有核红细胞的p-AKT蛋白水平显著高于WT小鼠组(P<0.05)。采用Image J软件进行灰度扫描及定量分析发现, miR-144/451 KO小鼠骨髓有核红细胞中p-AKT含量的灰度扫描均值为68.48, 高于WT小鼠灰度扫描均值1.54, 差异有统计学意义(P<0.05), 表明miR-144/451敲除后,红细胞前体细胞中AKT被高度磷酸化。见图2。
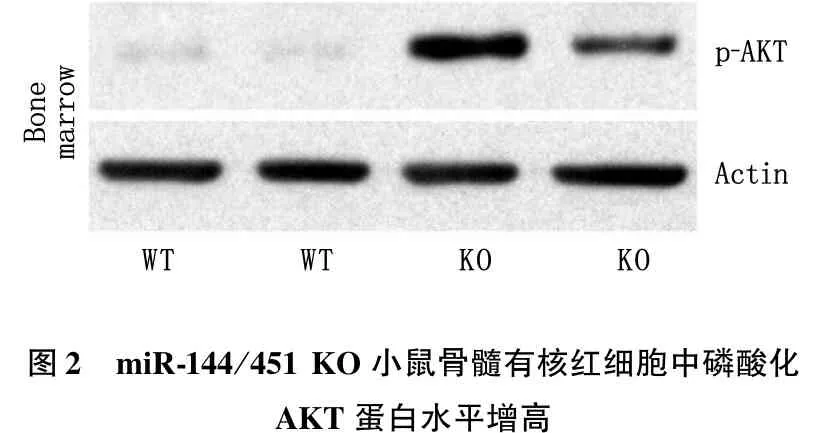
图2 miR-144/451KO小鼠骨髓有核红细胞中磷酸化AKT蛋白水平增高
2.3 超氧化剂H2O2明显激活AKT磷酸化
本研究显示,在miR-144/451敲除后,红细胞中ROS水平升高,红细胞前体细胞中AKT被高度磷酸化。这些结果提示, AKT高度磷酸化与ROS的增高可能存在着密切关系。为了探讨ROS增高与AKT高度磷酸化的关系,作者利用H2O2处理G1E细胞。G1E细胞是一种胚胎干细胞来源的红细胞系[11]。结果发现H2O2处理后的G1E细胞AKT急剧磷酸化(图3A )。作者前期研究[11]发现过表达miR-451的靶基因Ywhaz后,红系前体细胞的AKT会被磷酸化。本实验中,作者发现G1E细胞中过表达Ywhaz,也证实AKT会在一定程度被磷酸化(图3B,泳道1、3)。但是,采用H2O2处理后, AKT磷酸化的水平比过表达Ywhaz引起的明显增高(图3B, 泳道2、4)。为了进一步验证ROS与AKT高度磷酸化的关系,作者使用小鼠纤维母细胞NIH3T3及人宫颈癌细胞Hela细胞系,经H2O2处理后发现AKT也被明显磷酸化,而且AKT磷酸化是H2O2浓度依赖的(图3C)。这些结果表明ROS水平升高引起的AKT高度磷酸化并不仅限于红细胞。
3 讨 论
作者前期研究[11]发现,在miR-144/451敲除后, miR-144/451 KO小鼠出现轻度贫血,在氧化应激情况下贫血加重; 同时,作者还发现,应激状态下miR-144/451敲除后红细胞凋亡明显,可能是由于miR-144/451敲除后,正常情况下被miR-144/451抑制的基因Ywhaz、Cab39上调引起,但是具体机制尚待进一步研究[12]。本研究发现miR-144/451敲除后,红细胞中ROS增高,AKT高度磷酸化,证明ROS水平的增高才是AKT高度磷酸化的主要原因。
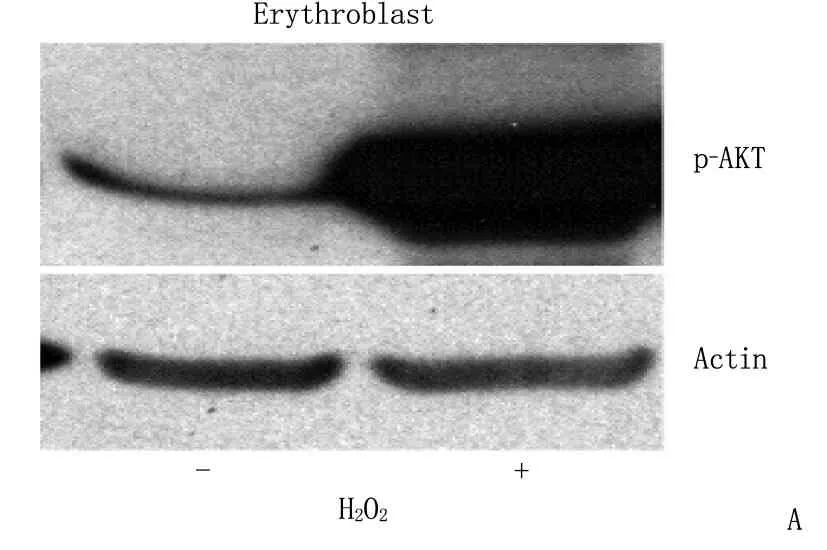
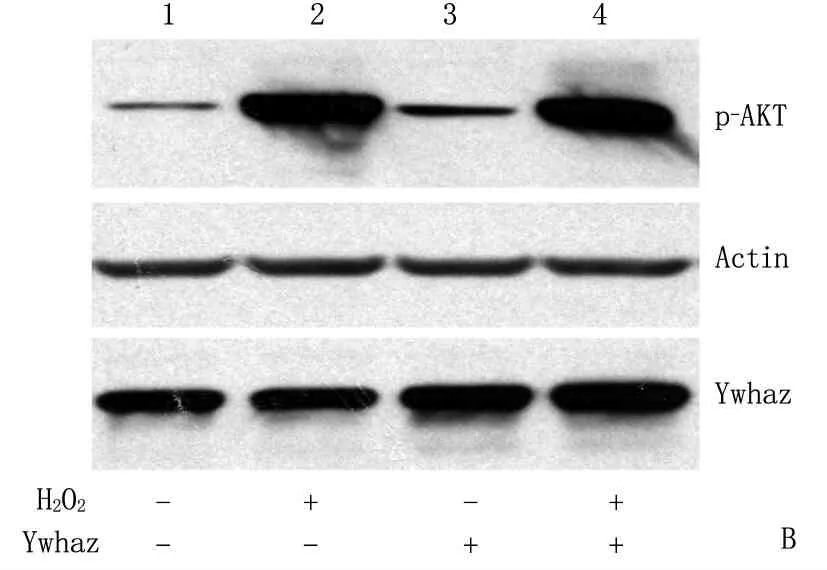
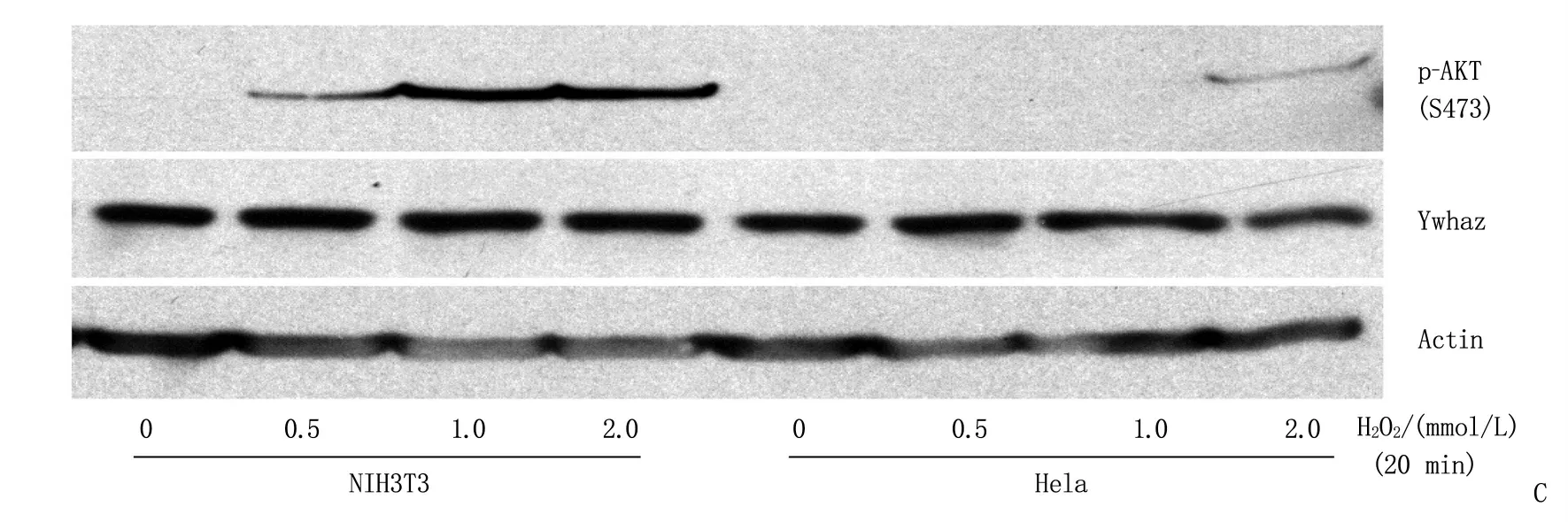
A: G1E细胞经H2O2处理后Western Blot检测p-AKT蛋白水平,“-”表示不加H2O2, “+”表示加H2O2;B: 过表达Ywhaz的G1E细胞经H2O2处理后Western Blot检测p-AKT蛋白水平, H2O2的“+”“-”表示加、不加H2O2, Ywhaz的“+”“-”表示过表达、不过表达;C: 其他细胞系经不同浓度H2O2处理后Western Blot检测Ywhaz(14-3-3ζ)及p-AKT的蛋白水平。
图3 超氧化剂H2O2明显激活AKT磷酸化
本研究结果证实,在红细胞中Ywhaz基因编码蛋白产物14-3-3ζ表达增加和ROS水平升高均可以引起AKT磷酸化,其中ROS水平升高是引起AKT高度磷酸化的主要途径,但这2条途径又高度相关。尽管14-3-3ζ引起的AKT磷酸化水平较低,但是这种低水平的AKT磷酸化可以暴露14-3-3ζ的磷酸化位点,从而引起14-3-3ζ与抗氧化转录因子FOXO3的结合,迫使FOXO3从细胞核内转移到细胞核外,从而失去其转录抗氧化酶Cat和GPx1等基因的功能[11], 由此引起的细胞内ROS水平升高又可以促进AKT的高度磷酸化,这种高度磷酸化的AKT进一步促进FOXO3的出核,这样一个正反馈调控机制最终导致红细胞因过度氧化引起凋亡,机体产生贫血。因此,miR-144/451可以抑制14-3-3ζ的表达,从而阻断这种正反馈机制,保护红细胞免受氧化攻击,从而维持红细胞稳态。

