过表达钾转运蛋白基因trkH提高玉米的钾营养
丁宝娟 安利佳 苏 乔
(大连理工大学生物工程学院,大连 116023)
钾是植物生长发育所必须的营养元素之一,占植物干重的2%~10%,参与多种生理生化过程,包括蛋白质合成、光合作用和渗透调节等[1~2]。地壳中钾含量丰富,但能被植物吸收利用的速效钾不足[3]。玉米(ZeamaysL.)作为世界三大粮食作物之一,在我国农业生产中占有重要的地位。土壤缺钾严重影响了玉米的产量和品质。通过遗传改良的方式提高玉米的钾营养是解决这个问题的有效途径之一。
植物对钾的吸收主要依靠钾离子通道和钾离子转运体两大钾转运系统,前者主要包括Shaker通道、TPK通道和Kir-like通道[4],后者主要包括KUP/HAK/KT转运体,Trk/Ktr/HKT转运体、KEA转运体和CHX转运体[5~7]。其中,Shaker通道和KUP/HAK/KT转运体是目前研究最为广泛的两大家族。目前已从棉花(Gossypiumhirsutum)[8]、小花碱茅(Puccinelliatenuiflora)[9]、盐地碱蓬(Suaedasalsa)[10]、霸王(Zygophyllumxanthoxylum)[11]和水稻(Oryzasativa)[12]等植物中分离得到AKT1基因。Ahmad等[12]研究发现过表达OsAKT1基因可以提高水稻的钾营养吸收。Duan等[10]研究发现,过表达SsAKT1基因在低钾条件下能够提高盐地碱蓬的钾吸收能力。KUP/HAK/KT钾转运体家族存在于植物、真菌和细菌中,参与植物体内K+的吸收和转运,提高植物的耐盐性以及对干旱胁迫的反应[13]。KUP/HAK/KT钾转运体在植物的发育过程也起到重要的作用,例如根毛的生长和生长素的分布等[14]。目前,研究人员已从碧桃(Prunuspersica)[15]、木薯(Manihotesculenta)[16]、棉花(Gossypiumhirsutum)[17]和柳杉(Cryptomeriajaponica)[18]等植物中克隆得到钾转运蛋白基因。谭颖等[19]在烟草中过表达NtHAK1基因显著提高了转基因烟草的钾吸收能力。Han等[20]的研究表明,过表达KUP7基因能够提高转基因拟南芥的K+吸收。Song等[21]在水稻中过表达空心莲子草的ApKUP3基因,提高了转基因水稻的K+吸收。Wang等[17]在拟南芥中过表达GhKT2基因,低钾条件下转GhKT2基因拟南芥的干重和K+含量显著高于野生型。
TrkH是一种细菌钾转运蛋白,其在细菌中的结构和功能已进行了详尽的研究[22],但在植物中的功能未知。本实验室前期从海洋微生物宏基因组DNA中克隆得到细菌钾转运蛋白基因trkH(Accession Number:MK863632),在酵母和烟草中验证了功能。本研究采用农杆菌介导的幼胚侵染法,以Hi-Ⅱ基因型的玉米为受体品种,将trkH基因导入玉米中,通过钾耗竭实验分析了转trkH基因玉米的K+吸收功能,为获得钾营养高效的玉米新品种奠定基础。
1 实验材料与方法
1.1 植物材料和表达载体
植物材料为Hi-Ⅱ基因型玉米。植物表达载体为pTF101:trkH,含有目的基因trkH和筛选标记基因Bar,为本实验室构建和保存(图1)。
1.2 培养基
玉米转化培养基及其组成见表1。
1.3 农杆菌介导的玉米遗传转化
参照Frame等[23]的方法进行玉米转化,方法略有修改,农杆菌菌液浓度为OD550=0.35~0.45,抗生素为200 mg·L-1的头孢噻肟。
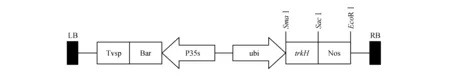
图1 pTF101:trkH载体结构简图Fig.1 Schematic representation of pTF101:trkH vector
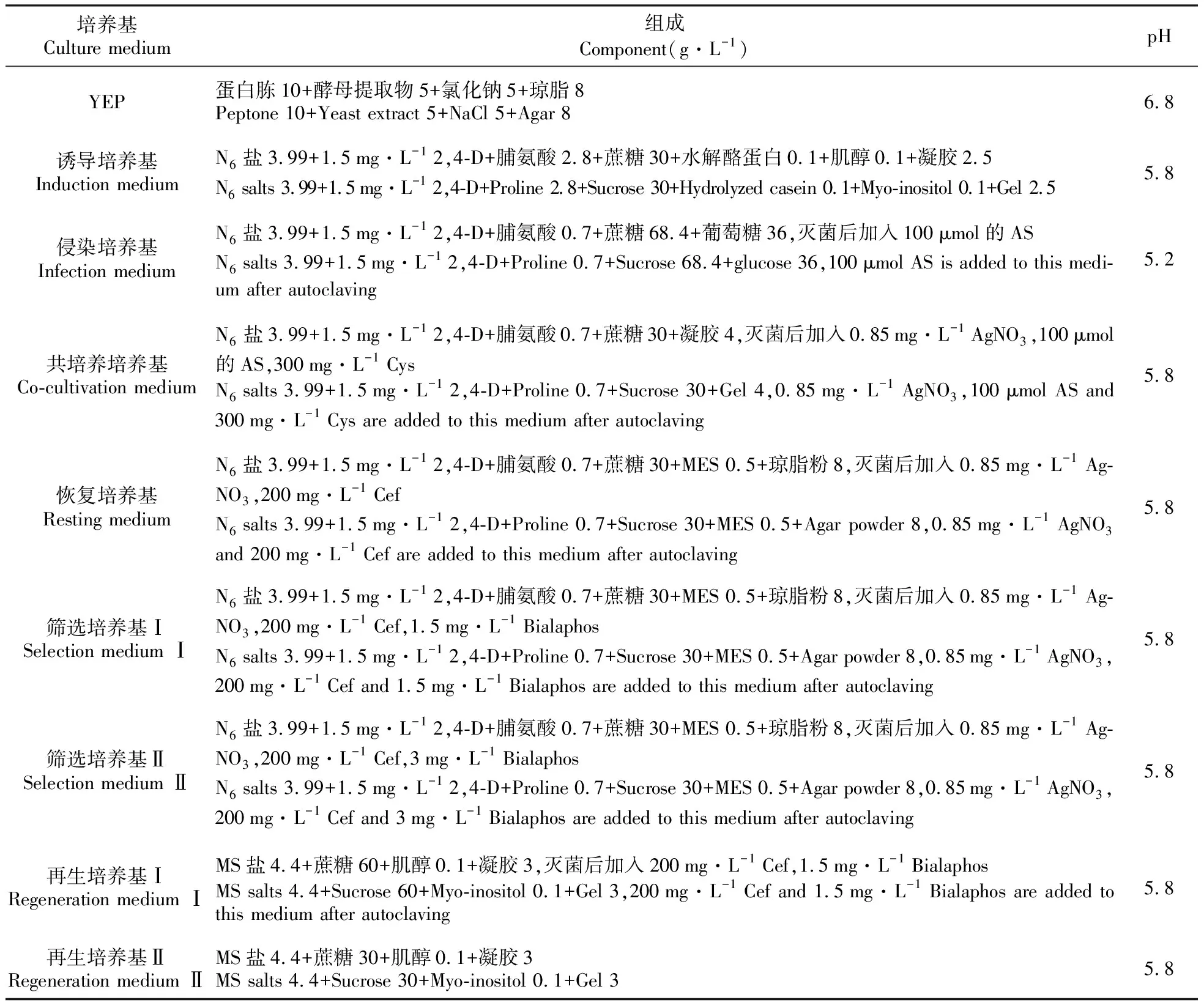
表1 培养基组成
1.4 T0代转化植株的PCR检测
采用快捷型植物基因组DNA提取试剂盒进行玉米基因组DNA的提取,利用表2中trkH和Bar基因的引物分别进行PCR扩增。PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸90 s,35个循环;72℃延伸10 min;4℃保存。1%琼脂糖凝胶电泳检测PCR扩增产物。
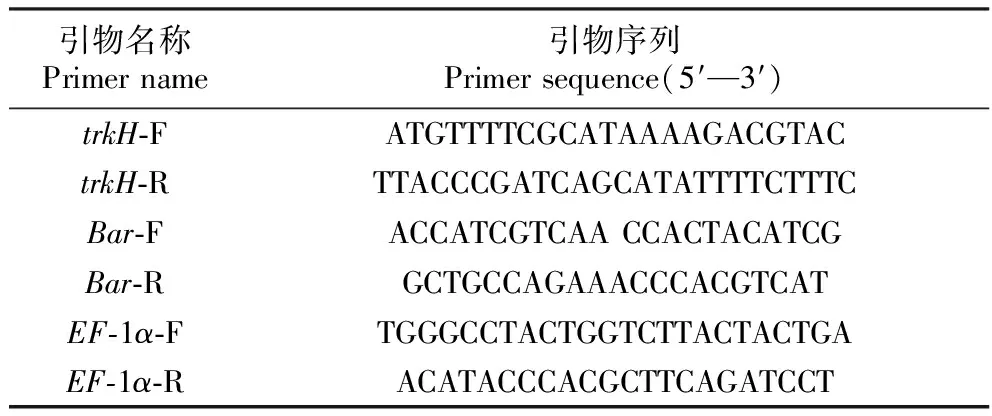
表2 PCR检测的引物序列
1.5 T1代转基因植株Bar试纸条检测
根据QuickStixTMKit for LibertyLink®(bar) Cotton Leaf & Seed说明书进行Bar基因的蛋白水平检测。
1.6 T1代转基因植株的半定量RT-PCR检测
将部分T0代转基因植株与玉米骨干自交系PH6WC杂交,获得8个T1代株系。采用TRIZol试剂提取玉米叶片总RNA,根据大连宝生物公司PrimerScriptTMRT reagent Kit with g DNA Eraser(Perfect Real Time)说明书进行反转录反应。以反转录得到的cDNA为模板进行半定量RT-PCR检测,以EF-1α为内参基因,trkH和EF-1α引物序列见表2。PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸90 s,27个循环;72℃延伸10 min;4℃保存。1%琼脂糖凝胶电泳检测PCR扩增产物。
1.7 T1代转基因植株的遗传分析
选取籽粒饱满的8个T1代转基因株系玉米种子各30粒,播种到含有营养土的花盆中,待玉米幼苗长至三叶一心期时,喷洒除草剂,统计T1代转基因株系的分离比。选取分离比接近1∶1的转基因株系进行PCR检测,trkH引物序列见表2,PCR反应条件同1.4。统计PCR检测结果并进行χ2测验。
1.8 T1代转基因植株的钾离子耗竭分析
切取少量玉米胚乳组织,采用碱煮法[24]提取L3、L5和L7转基因株系T1代种子的基因组DNA。为保证遗传背景尽量一致,经PCR检测后,以PCR检测阳性材料为转基因玉米,以PCR检测阴性材料为野生型进行钾离子耗竭实验。将玉米种子进行简单的表面消毒后于托盘中萌发3~5 d。萌发的玉米幼苗定植到1/2 Hoagland[25]营养液中进行通气培养,pH6.0,每3天更换一次营养液。待幼苗长至四叶一心期时,分别将转基因植株和野生型植株转移至缺钾的1/2 Hoagland营养液中,其中,KH2PO4用NaH2PO4替代,KNO3用Ca(NO3)2替代,其余成分相同,饥饿处理48 h。饥饿处理后,将玉米幼苗转移至耗竭液(0.2 mmol CaSO4,1 mmol KCl)中,每隔12 h取样一次,每次吸取1 mL溶液,并用双蒸水补足体积,耗竭处理72 h,玉米幼苗在处理期间保持通气状态。采用原子吸收光谱仪测定样品中的钾离子含量。
2 结果与分析
2.1 转基因玉米植株的获得
采用农杆菌介导的幼胚侵染法对玉米Hi-Ⅱ品种进行遗传转化。在共培养培养基中培养3 d后,生长良好的幼胚会变大且质地坚硬(图2:a);经过7 d的恢复培养,会诱导出Ⅱ型愈伤组织,此时可通过愈伤组织的生长状态来判断幼胚是否可以转移至筛选培养基中(图2:b);经过4~6周的筛选培养后,获得蓬松状态的抗性愈伤(图2:c~d);将抗性愈伤分成小块,在再生Ⅰ培养基中培养2周,长出呈乳白色的胚状体(图2:e);挑选生长健壮的胚状体转移至再生Ⅱ培养基中,2周后生长出再生苗(图2:f)。最终获得T0代Baster抗性苗21株。
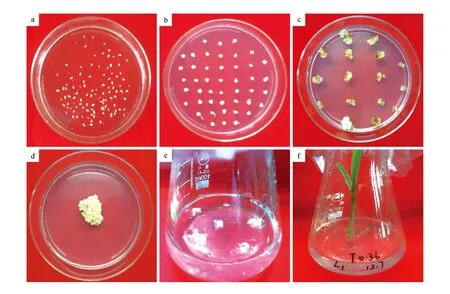
图2 农杆菌介导玉米的遗传转化 a.共培养;b.恢复;c~d.筛选;e.胚状体;f.再生植株Fig.2 Agrobacterium-mediated genetic transformation of maize a.Co-cultivation; b.Resting; c-d.Selection; e.Embryoid; f.Regeneration plant
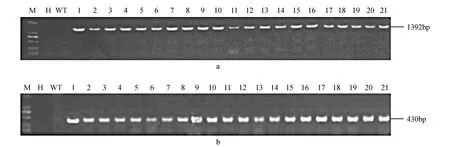
图3 转trkH基因植株的PCR检测 a.trkH基因;b.Bar基因 M.DL2000 Marker;H.ddH2O;WT.野生型植株;1~21.转基因植株Fig.3 PCR detection of the trkH transgenic plants a. trkH gene; b. Bar gene; M. DL2000 Marker; H. ddH2O; WT. Wild type; 1-21. Transgenic plants

图4 转trkH基因植株的Bar试纸条检测 WT.野生型植株;1~21.转基因植株Fig.4 Bar strip detection of trkH transgenic plants WT. Wild type; 1-21. Transgenic plants
2.2 T0代Baster抗性植株的鉴定
以提取的玉米基因组DNA为模板,对目的基因trkH和筛选标记基因Bar进行PCR检测,扩增出符合预期大小的片段,表明目的基因和筛选标记基因成功转入到玉米基因组中(图3)。Bar试纸条检测结果表明,21株抗性苗出现了检测线,而野生型植株没有出现检测线,说明Bar基因在蛋白水平上成功表达(图4)。
2.3 T1转基因植株的半定量RT-PCR分析
将部分T0代转基因植株与玉米骨干自交系PH6WC进行杂交,收获8个T1代株系。半定量RT-PCR检测结果表明,T1代株系在转录水平上均能表达,且表达量差异不大(图5)。

图5 T1代转trkH基因植株的半定量RT-PCR WT.野生型植株;L1~L8.转基因植株Fig.5 Semi-quantitative RT-PCR detection of T1trkH transgenic plants WT. Wild type; L1-L8. Transgenic plants
2.4 T1代转基因植株的遗传分析
选取籽粒饱满的T1代转基因株系玉米种子各30粒,三叶一心期时喷洒除草剂,非抗性植株叶片逐渐萎黄,直至死亡。然后统计分离比,选择其中比例接近1∶1的L3、L5和L7转基因株系进行PCR检测。切取少量玉米胚乳组织,采用碱煮法提取玉米基因组DNA,将其作为模板,利用trkH基因的引物进行PCR扩增,统计PCR检测结果并进行χ2测验,结果表明L3、L5和L7转化株系的后代均符合孟德尔分离定律(表3)。
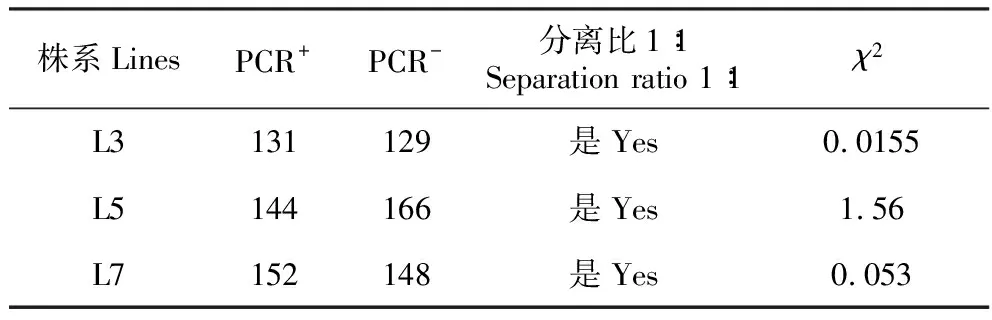
表3 转trkH基因玉米T1代遗传分析
注:PCR+.阳性植株;PCR-.阴性植株χ2=3.841,P<0.05
Note:PCR+.Positive plants; PCR-.Negative plantsχ2=3.841,P<0.05
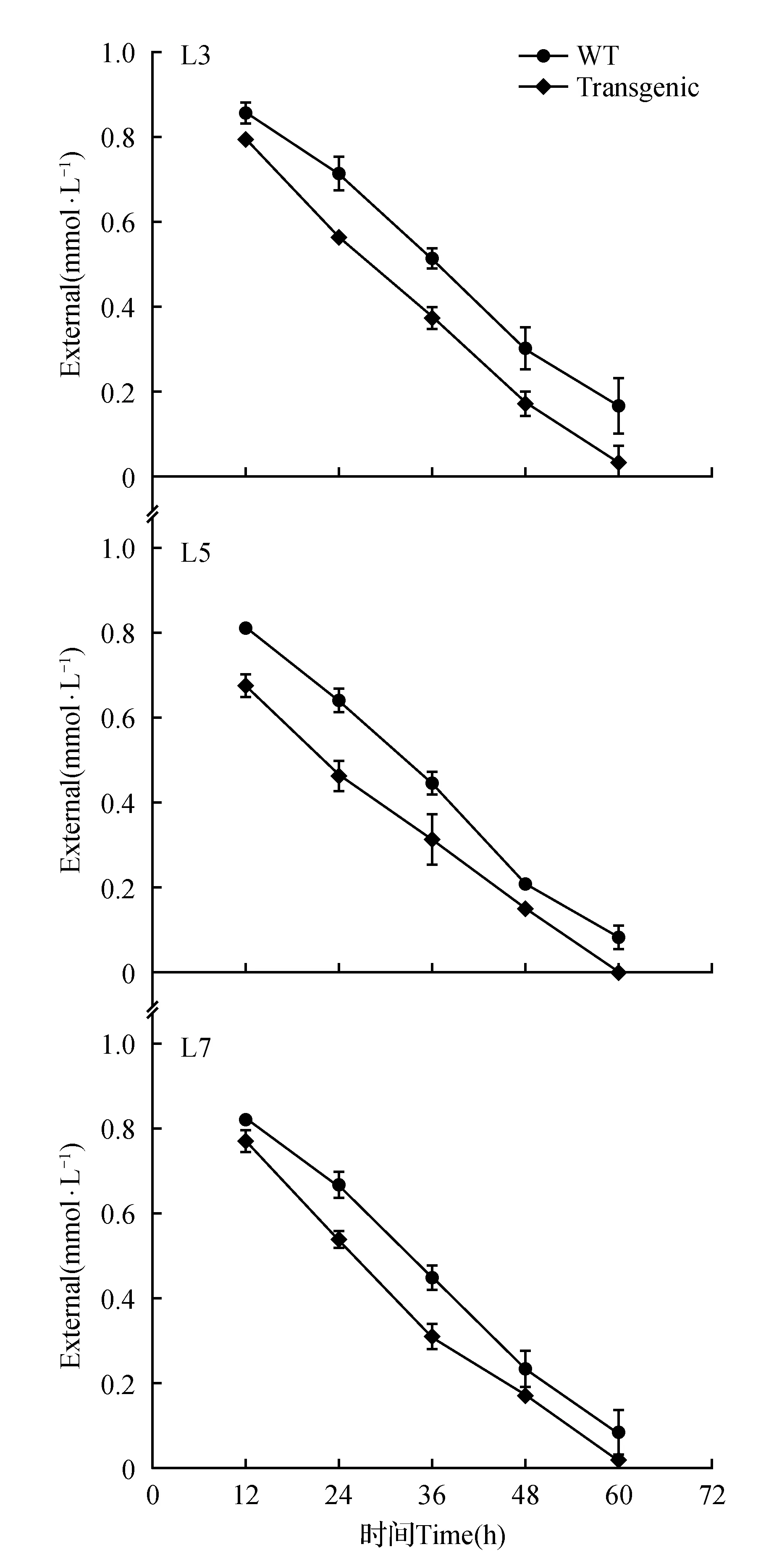
图6 T1代转trkH基因植株在1 mmol K+浓度下的耗竭实验Fig.6 Depletion experiment of T1trkH transgenic plants at 1 mmol K+ concentration
2.5 T1代转基因植株的K+耗竭实验
为评估低K+胁迫下过表达trkH基因能否提高转基因玉米的K+吸收能力,挑选四叶一心期的转基因和野生型玉米进行K+耗竭实验。结果表明,在1 mmol K+浓度条件下耗竭处理72 h,L3、L5和L7转基因玉米的K+吸收能力高于野生型(图6)。
3 讨论
土壤缺钾影响玉米的产量和品质,培育钾营养高效的玉米品种是解决这个问题的途径之一。本研究通过农杆菌介导的幼胚侵染法将细菌钾转运蛋白基因trkH转入玉米Hi-Ⅱ幼胚中。PCR检测结果初步表明外源基因trkH成功转入玉米基因组中。半定量RT-PCR检测结果表明trkH基因在转录水平上表达。Bar试纸条检测结果表明Bar基因在蛋白水平上表达。将T0代转基因株系与PH6WC杂交,对其后代进行PCR检测,结果符合1∶1的孟德尔分离比,推测L3、L5和L7转基因株系为单拷贝且可以稳定遗传。玉米苗期钾耗竭实验结果表明转基因玉米的钾吸收能力高于野生型,与Ahmad等[12]在水稻中过表达OsAKT1基因、Han等[20]在拟南芥中过表达KUP7基因和Song等[21]在水稻中过表达ApKUP3基因的研究结果一致。
细菌Trk系统主要包括介导K+转运的跨膜亚基TrkH或TrkG以及外围调节亚基TrkA,多数情况下细菌中TrkH实现K+跨膜转运需要TrkA的辅助调节;真菌中的Trk系统表现为单一亚基结构,只有介导离子转运的跨膜亚基,并没有辅助的调节亚基。推测可能是由于真核系统较为复杂,有其他提供能量或者调节激活的机制[5,22,26~27]。本实验室前期从海洋微生物宏基因组DNA中克隆得到细菌钾转运蛋白基因trkH,在酵母和烟草中验证了其功能,结果表明TrkH在高等生物中可以不依赖于TrkA发挥钾吸收的功能。本研究表明单独过表达trkH基因能够提高转基因玉米的钾吸收能力,为培育钾营养高效玉米新品种奠定基础。

