响应面优化花生叶可溶性蛋白提取工艺及抗氧化活性分析
高 琦 刘梓蘅 耿 艺 金小乂 吴嘉乐 卢雅婷张 倩 薛友林
(1辽宁大学轻型产业学院,辽宁 沈阳 110036;2中共辽宁省委党校,辽宁 沈阳 110161)
植物叶蛋白是将新鲜植物茎叶经过压榨后提取得到的绿色蛋白浓缩物,富含人体所需的必需氨基酸和非必需氨基酸,营养价值丰富[1]。植物叶蛋白是全球最多的可再生蛋白质资源之一,其提取物和加工产品已广泛应用于食品、饲料、医药、农药、化妆品等领域[2-3]。
花生是我国主要的油料作物和大量出口的农业产品,其总产量、单产量和出口量均位于世界前列[4]。花生在收获的同时会产生一些副产物,其中花生叶中的粗蛋白含量高达20%(干重)[5]。目前关于花生叶的研究主要集中在生理方面,如Katam 等[6]对水胁迫下干旱敏感/非敏感型花生的花生叶蛋白质组学进行了研究,发现水分胁迫影响干旱敏感品种与光合作用、代谢相关蛋白的功能,在非敏感花生品种中,参与细胞壁木质化的酶能够诱导形成屏障降低叶的水分损失;Chen 等[7]对冷胁迫下花生叶的基因进行了鉴定,发现花生叶冷应激反应主要涉及信号转导、转录调控和可溶性代谢物的积累等生物过程;Cossetin 等[8]对花生叶醇提取物的组成进行了鉴定,主要检测出29种化合物,且该提取物具有良好的抗氧化和抗炎症活性。此外,Gao 等[9]使用液相色谱质谱联用技术对富硒的花生叶蛋白构成进行了鉴定,发现富硒后花生叶中硒的主要形式为SeMet和MeSeCys,且其抗氧化活性明显增强。但关于花生叶蛋白的大规模工业化提取方法鲜有报道,若能高效地从花生叶中提取蛋白质,将会有效地促进花生加工产业发展,填补花生叶蛋白提取方法的空白。
植物蛋白提取方法种类繁多,目前常用的植物蛋白提取方法主要有碱溶酸沉法、超声波辅助提取法[10]、直接加热法[11]、酶辅助法提取法[12]等。碱溶酸沉法因成本低、易操作控制、可获得较高产量及纯度的蛋白等优点已成为应用最广泛的方法[13-14]。因此,本试验采用碱溶酸沉法提取花生叶可溶性蛋白,测定其等电点,并通过单因素试验考察花生叶可溶性蛋白提取工艺的主要参数,以蛋白提取率作为响应面优化目标,对花生叶可溶性蛋白的相关提取条件进行优化,旨在为利用花生叶开发相关新产品的研究提供理论参考。
1 材料与方法
1.1 材料与试剂
花生叶由辽宁省沈阳市沈北新区石佛寺试验田提供;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),东京化成工业株式会社;氢氧化钠、考马斯亮蓝G250、邻苯三酚、水杨酸、三氯乙酸、氯化铁等均为分析纯,国药集团化学试剂有限公司。
1.2 主要仪器与设备
FA2004 电子分析天平,上海舜宇恒平科学仪器有限公司;万威300型高速多功能粉碎机,上海赛耐机械有限公司;LGJ-12 普通冷冻干燥机,北京松源华兴科技有限公司;TG16G 台式高速离心机,长沙英泰仪器有限公司;PHSJ-3F 酸碱度测试仪,上海仪电科学仪器股份有限公司;721型可见分光光度计,德卡精密量仪(深圳)有限公司;TT30-DK-98-Ⅱ数显电热恒温水浴锅,北京北瑞达医药科技有限公司。
1.3 试验方法
1.3.1 样品前处理 清除花生叶表面尘土,晒干,用粉碎机粉碎并过80 目筛,将花生叶粉装袋,置于4℃干燥环境贮存备用。
1.3.2 花生叶蛋白等电点测定及蛋白质提取率计算
参照金小乂[5]的方法。将酸沉pH值分别调整为1.5、2.0、2.5、3.0、3.5、4.0、4.5,提取花生叶蛋白。按照公式(1)计算可溶性蛋白提取率,提取率最高的酸沉pH值即为叶蛋白等电点。

花生叶粉中总蛋白含量采用凯氏定氮法[15]测定。冻干样品(花生叶可溶性蛋白提取物)中蛋白含量采用考马斯亮蓝法[16]测定。
1.3.3 花生叶可溶性蛋白质提取及蛋白质纯度计算 参照金小乂[5]的方法提取花生叶可溶性蛋白质,酸沉pH值调节为2.0(本试验测定花生叶可溶性蛋白质等电点为2.0)。按照公式(1)计算蛋白质提取率,按照公式(2)计算蛋白质纯度:

1.3.4 单因素试验 设定浸提pH值9.0、料液比1 ∶20(w/v)、浸提时间30 min为固定值,分别考察不同浸提pH值(6.0、7.0、8.0、9.0、10.0)、浸提时间(20、30、40、50 min)、料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶40(w/v)]对花生叶可溶性蛋白提取率的影响。
1.3.5 Box-Behnken 试验设计 应用Design Expert 8.0.6 软件,采用Box-Behnken 设计响应面试验[17-20]。根据单因素试验结果,选取料液比(A)、浸提时间(B)、浸提pH值(C)3个主要影响因素为自变量,以花生叶可溶性蛋白质提取率作为响应值。响应面试验因素和水平见表1。

表1 Box-Behnken 试验设计因素和水平Table1 Factors and levels used in Box-Behnken design
1.3.6 DPPH 自由基清除能力测定 取2.0 mL 不同浓度的花生叶可溶性蛋白溶液(0.10、0.25、0.75、1.25和2.00 mg·mL-1)加入2 mL 0.06 mg·mL-1DPPH 乙醇溶液,避光30 min,将溶液混匀后于517 nm 波长处测定吸光度值[21],并与阳性对照组Vc进行对比。DPPH 自由基清除率按照公式(3)计算:

1.3.7 羟自由基清除能力测定 于试管中按顺序加入0.5 mL 9 mmol·L-1硫 酸 亚 铁 溶 液、0.5 mL 9 mmol·L-1水杨酸-乙醇溶液、5.0 mL 0.02% H2O2溶液和1.0 mL 样品溶液,混匀后将溶液置于37℃水浴中恒温20 min,于510 nm 波长处测定吸光度值[22]。以纯水做参比,样品选用不同浓度的花生叶可溶性蛋白溶液(0.10、0.25、0.75、1.25和2.00 mg·mL-1),并与阳性对照组Vc进行对比。羟自由基清除率按照公式(4)计算:

1.3.8 超氧阴离子自由基清除能力测定 将4.5 mL Tris-HCl 缓冲溶液(0.05 mol·L-1,pH值8.2)和1.0 mL 蒸馏水混合,于25℃水浴中保温20 min,之后迅速加入0.5 mL 25 mmol·L-1邻苯三酚溶液和1.0 mL 样品溶液,置于25℃恒温水浴中反应5 min,最后加入1.0 mL 8 mol·L-1盐酸溶液终止反应,在320 nm 波长处测定吸光度值[23]。样品选用不同浓度的花生叶可溶 性 蛋 白 溶 液(0.10、0.25、0.75、1.25和2.00 mg·mL-1),以Vc 作为阳性对照进行比较。超氧阴离子自由基清除率按照公式(5)计算:

1.3.9 还原力测定 将2 mL 样品溶液加入2.5 mL磷酸盐缓冲液(0.2 mol·L-1,pH值6.6)和2.5 mL 1.0%铁氰化钾溶液中,于50℃温育20 min,然后加入1 mL 10.0%三氯乙酸,5 000 r·min-1离心10 min。取2.5 mL 上层溶液加入到0.5 mL 0.1%氯化铁和2.5 mL 蒸馏水中,静置10 min,于700 nm 波长处测定吸光度值[24]。样品的吸光度值越大,说明样品还原力能力越强。样品选用不同浓度的花生叶可溶性蛋白溶液(0.10、0.25、0.75、1.25和1.50 mg·mL-1),并以Vc 作为阳性对照进行比较。
1.4 数据分析
试验每组重复3次,以各组数据平均值为最终结果,计算标准差。利用Design-Expert 8.0.6 软件对试验进行响应面设计并对所得结果进行分析。使用Origin Lab Origin Pro v7.5 软件进行数据分析与制图。
2 结果与分析
2.1 花生叶可溶性蛋白的等电点
由图1可知,当酸沉pH值从1.5 上升至4.5时,花生叶可溶性蛋白提取率呈先上升后下降趋势,在pH值2.0 处花生叶可溶性蛋白提取率达到最大,为44.1%,此时花生叶可溶性蛋白质纯度也最高,为61.3%。表明,花生叶可溶性蛋白质的等电点为2.0。
2.2 单因素试验结果

图1 花生叶可溶性蛋白的等电点Fig.1 Isoelectric point of peanut leaf soluble protein
2.2.1 料液比对花生叶可溶性蛋白提取率的影响 由图2-A可知,当料液比为1 ∶10 g·mL-1时,蛋白提取率较低,随着料液比逐渐增加,花生叶可溶性蛋白提取率先上升后下降,当料液比为1 ∶20 g·mL-1时,提取率最高(47.1%),料液比为1 ∶40 g·mL-1时蛋白提取率为39.8%。这可能是由于溶剂较少时溶液的粘度大,分子的扩散速率低,影响了物料中蛋白质的溶解,导致蛋白质不能完全溶出,造成蛋白提取率较低[25-26];随着溶剂的增加,溶液逐渐被稀释,阻碍效果减弱,蛋白的溶出量上升,提取率升高;而当溶剂过多时蛋白提取率下降,可能是因为过多的溶剂使物料在溶液中过于分散,不利于蛋白质酸沉离心,蛋白损失增加,进而蛋白提取率下降[27]。
2.2.2 浸提时间对花生叶可溶性蛋白提取率的影响 由图2-B可知,当浸提时间从20 min 增加至30 min时,花生叶可溶性蛋白提取率也相应增加,浸提时间为30 min时,蛋白提取率最大(47.2%);当浸提时间大于30 min时,蛋白提取率又逐渐下降,在浸提时间为50 min时蛋白提取率最低(39.2%)。浸提时间过短蛋白提取率低,可能是由于原料中蛋白还未完全溶解,导致溶液中蛋白含量较低,使得提取率低;而浸提时间过长可能会导致浸提液中蛋白质分子间相互作用增强,从而使蛋白质聚集,形成沉淀,经离心后上清液中蛋白质含量降低,导致蛋白提取率降低[16,28]。
2.2.3 浸提pH值对花生叶可溶性蛋白提取率的影响 由图2-C可知,当pH值从6.0 增加至9.0时,蛋白提取率逐渐上升,在pH值9.0时,蛋白提取率最大(49.3%)。这是由于碱性环境中,蛋白质的外层结构遭到破坏,蛋白质的亲水基团暴露,使得蛋白与水的结合能力增强,蛋白质溶解度增加,最终蛋白提取率增加;而当pH值大于9.0时,蛋白质极性发生了变化,同时过量的碱破坏了蛋白中的肽键和肽链,导致蛋白质部分水解,降低了溶液中蛋白质的含量,使得提取率降低[14,29]。
2.3 响应面试验优化结果
采用Design-Expert 软件对表2试验结果数据进行综合分析,得到料液比(A)、浸提时间(B)、浸提pH值(C)的二次项回归方程为:
Y= 49.70 - 0.74A+ 3.98B+ 4.00C- 0.28AB-1.76AC+2.80BC-5.01A2-2.17B2-9.35C2。
由表3可知,回归方程中P<0.000 1,说明本试验建立的模型极显著;失拟项P=0.66,说明本试验拟合的模型纯误差不显著;由F值可知,3个影响因素对花生叶可溶性蛋白提取率影响从高到低依次为C(浸提pH值)>B(浸提时间)>A(料液比)。回归方程的R2=0.992 7 与实际情况拟合良好,试验误差较小,模型成立。B、A2、B2、C2和交互作用项AC、BC影响极显著(P<0.01),说明浸提时间、浸提pH值是影响蛋白提取率的最重要因素;而A以及AB的交互作用并不是影响蛋白提取率的显著因素(P>0.05)。因此,可以利用该回归方程分析和预测花生叶蛋白提取工艺的最佳参数,同时该回归方程能有效分析和预测各因素对花生叶可溶性蛋白提取率的影响。
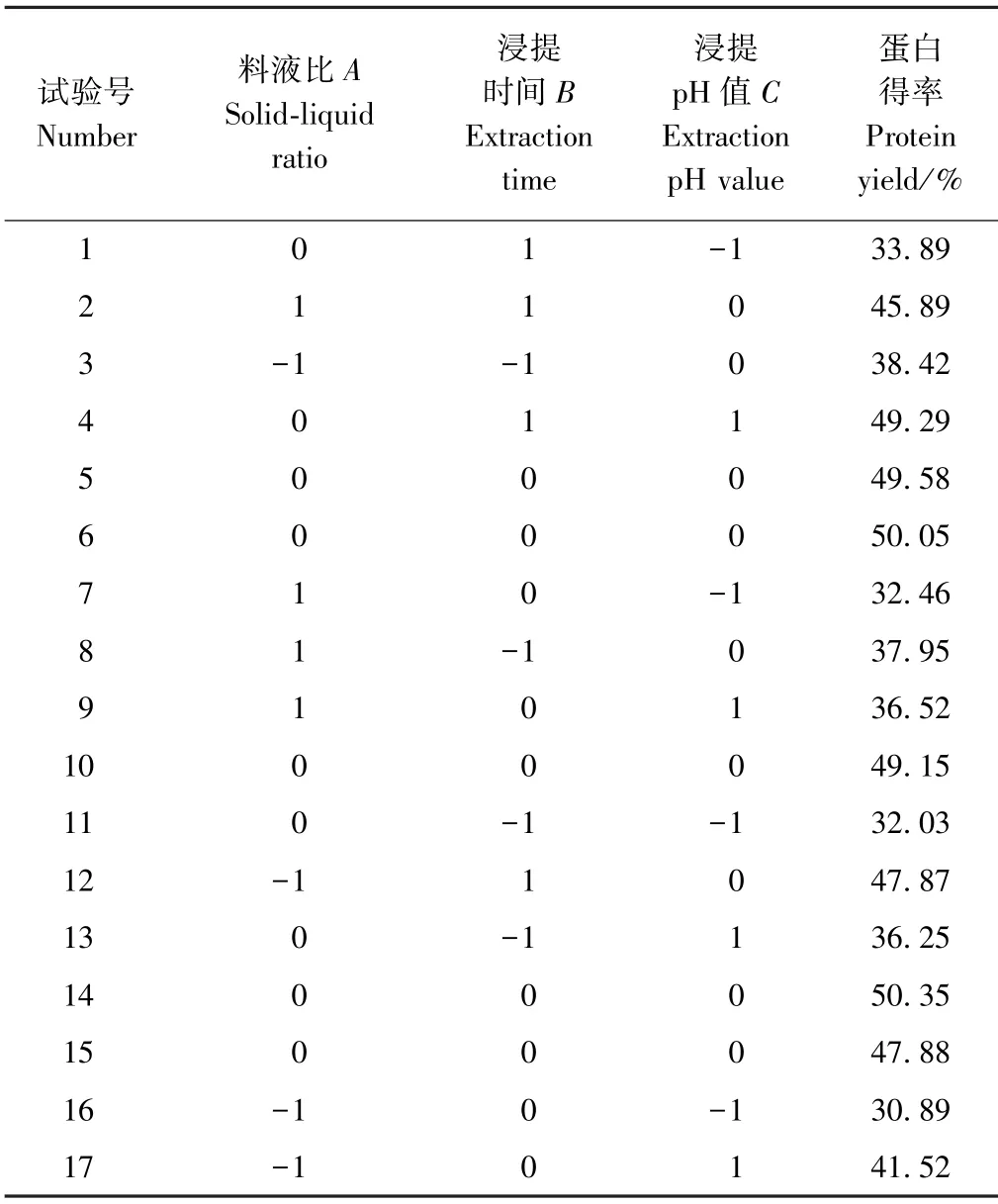
表2 Box-Behnken 试验设计结果Table2 Box-Behnken design with experimental results

表3 响应面试验回归模型方差分析Table3 analysis of variance for the fitted regression model
2.4 各因素交互作用的响应面分析
根据响应面设计所得的回归方程,利用Design-Expert 8.0.6 软件制作交互因素的响应面分析图和等高线分析图。
由图3-A、B可知,随着料液比的增加,蛋白提取率呈先增后降的趋势;随着浸提时间的延长,蛋白提取率呈增加趋势。由等高线的疏密分布及响应面的倾斜程度可知,料液比和浸提pH值的交互作用对蛋白提取率有一定的影响,且浸提时间的影响较料液比明显,但是二者的交互作用对蛋白提取率的影响不明显。
由图3-C、D可知,随着料液比的增加,蛋白提取率呈先增后降的趋势;随着浸提pH值的升高,蛋白提取率呈先增后降的趋势。此外,料液比和浸提pH值的交互作用对蛋白提取率影响较大,且浸提pH值的影响较料液比更明显。表明,当料液比介于0.05~0.55 mg·mL-1之间,浸提pH值介于9.0~9.5时,蛋白提取率较高。
由图3-E、F可知,随着浸提时间的延长,蛋白提取率呈先增后降的趋势;随着浸提pH值的升高,蛋白提取率呈先增后降的趋势。浸提时间和浸提pH值的交互作用对蛋白提取率影响极显著,且浸提pH值的影响较浸提时间明显。表明,当浸提pH值介于9.0~9.5 之间,浸提时间约为30 min时,蛋白提取率较高。
2.5 验证试验结果
优化后花生叶可溶性蛋白最佳提取条件为浸提pH值9.27、浸提时间40 min、料液比1 ∶22(w/v),此条件下花生叶可溶性蛋白的理论提取率为52.8%。考虑到实际试验条件及操作的便利性,将最佳提取条件调整为浸提pH值9.0、浸提时间40 min、料液比1 ∶20(w/v)。应用调整后的试验参数进行3次重复平行测定,得到蛋白提取率为54.2%,蛋白质纯度为63.8%,与预测值52.8%接近,结果偏差较小。说明利用响应面对花生叶可溶性蛋白提取条件的优化,结果准确,试验设计具有较好的可靠性和重现性,所得花生叶可溶性蛋白纯度较高,响应面优化效果较好。
2.6 花生叶可溶性蛋白抗氧化活性结果分析
2.6.1 DPPH 自由基清除能力 由图4-A可知,花生叶可溶性蛋白样品清除DPPH 自由基效果较好,且随着蛋白浓度的增加,DPPH 自由基清除率有较明显的增加。当Vc 浓度为0.25 mg·mL-1时,其抑制效果达到最佳,清除率为94.0%。花生叶可溶性蛋白浓度从0.1 mg·mL-1增加至0.75 mg·mL-1时,DPPH 自由基清除率从18.5%增加至73.3%,DPPH 自由基清除能力有较大提升;当蛋白溶液浓度为2.0 mg·mL-1时DPPH自由基消除效果最佳,清除率为90.4%。上述结果表明,花生叶可溶性蛋白与Vc 对DPPH 自由基清除率的最佳效果相当。
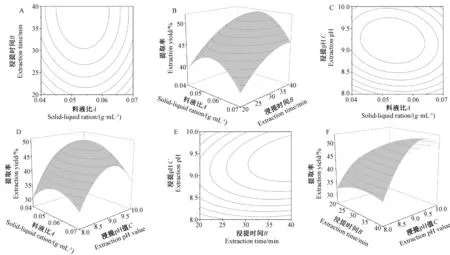
图3 料液比与浸提时间交互作用(A,B)、料液比与浸提pH 交互作用(A,C)和浸提时间与浸提pH 交互作用(B,C)的等高线和响应面图Fig.3 Contour line and response surface of the interaction between solid-liquid ratio and extraction time (A,B),the interaction between solid-liquid ratio and extraction pH (A,C) and the interaction between extraction time and extraction pH (B,C)
2.6.2 羟自由基清除能力 由图4-B可知,花生叶可溶性蛋白样品对羟自由基有一定的清除能力,随着蛋白溶液浓度的增加,羟基自由基清除率呈上升趋势;当蛋白浓度为2.0 mg·mL-1时,羟自由基清除率最高,为26.4%;而Vc 对羟自由基清除效果较好,当其浓度为1.25 mg·mL-1时,羟自由基清除率最高(94.73%)。表明,花生叶可溶性蛋白的羟自由基清除能力和Vc 有较大的差距,花生叶可溶性蛋白的羟自由基清除能力总体较弱。
2.6.3 超氧阴离子自由基清除能力 由图4-C可知,花生叶可溶性蛋白样品对超氧阴离子自由基清除效果较好,且随着蛋白浓度的增加,超氧阴离子自由基清除率增加明显。蛋白浓度从0.1 mg·mL-1增加至0.75 mg·mL-1,超氧阴离子自由基清除率从13.9%增加至75.1%。当蛋白浓度为2 mg·mL-1时,清除率达到98.4%,Vc 对超氧阴离子自由基清除率最高为98.8%。表明,花生叶可溶性蛋白与Vc 对清除超氧化物自由基的能力基本一致。
2.6.4 还原能力 由图4-D可知,花生叶可溶性蛋白具有一定的还原能力,且叶蛋白还原能力着随浓度的增加不断增加,在1.5 mg·mL-1时达到最高,吸光度值为1.798。Vc 有较强的还原能力,在1.0 mg·mL-1时还原力能力达到最高,吸光度值为2.954。表明,花生叶可溶性蛋白还原能力为Vc 还原力的一半。
3 讨论
利用碱溶酸沉法提取植物蛋白,试验耗时短、操作便捷,是提取植物蛋白常用的方式。有研究利用碱溶酸沉法提取青稞[30]、枸杞[31]、芝麻[32]、酸枣[33]的蛋白质,并对提取条件进行优化,蛋白提取影响因素与本试验基本相同,但不同原料蛋白的最优提取条件不尽相同,如青稞和酸枣最佳浸提pH值为11.0,而花生叶和枸杞最佳浸提pH值为9.0;花生叶和枸杞提取的最佳料液比为1 ∶20 g·mL-1,酸枣为1 ∶24 g·mL-1,而青稞和芝麻的最佳料液比为1 ∶25 g·mL-1。虽然不同原料最佳提取条件不同,但经优化后蛋白提取率均较高。出现这种差别的原因可能是不同原料的蛋白含量不同,相同植物不同器官之间的蛋白含量差异也较大,同一种植物的同一器官在不同生长期蛋白质含量也不同[34],从而影响蛋白提取条件。本试验在单因素试验基础上,利用Box-Behnken 试验法设计响应面试验,得到最佳提取条件为浸提pH值9.0、浸提时间40 min、料液比1 ∶20 g·mL-1,该条件下进行提取验证,所得蛋白提取率为54.2%,蛋白质纯度为63.8%,蛋白提取率与优化前相比有较大提高,说明碱溶酸沉法是一种简单方便且有效的花生叶可溶性蛋白的提取方法。但碱溶酸沉法在工业大规模生产中会消耗大量的酸、碱[35],浪费资源的同时也会造成一定的酸污染,这也是该方法亟待解决的问题。
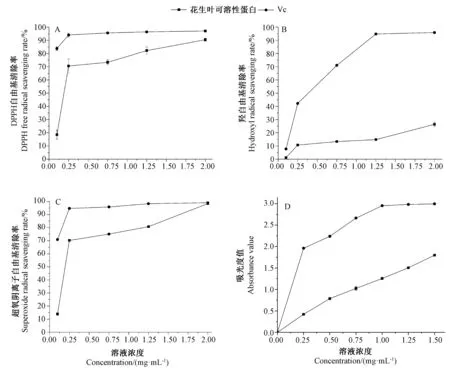
图4 花生叶可溶性蛋白和抗坏血酸的DPPH 自由基清除率(A)、羟自由基清除率(B)、超氧阴离子自由基清除率(C)和还原力(D)Fig.4 Antioxidant activity of peanut leaf soluble protein and Vc on DPPH free radical (A),hydroxyl radical (B),superoxide radical(C),and reducing power (D)
本试验通过DPPH 自由基、羟自由基清除能力等抗氧化指标的测定,分析了花生叶可溶性蛋白的抗氧化活性。结果表明,花生叶可溶性蛋白具有良好的DPPH 自由基和超氧阴离子自由基清除活性,并有较强的还原能力。其中DPPH 自由基清除能力和还原力与Ningappa 等[36]提取的麻绞叶蛋白能力相当,但羟自由基清除能力弱于麻绞叶蛋白,这可能是因为花生叶可溶性蛋白是粗提取蛋白,样品溶液中可能含有对反应体系产生影响的杂质,从而造成羟自由基清除活性较弱[37];DPPH 自由基和超氧阴离子自由基清除能力与陶阿丽等[38]采用闪式提取法提取的豆腐柴叶蛋白相比较强,这可能是提取方法不同造成所提蛋白组成不同,且热处理会降低蛋白活性,从而影响其抗氧化活性[3];超氧阴离子自由基清除能力与文静等[39]提取的茶渣蛋白相比较弱,这可能是因为从茶渣中提取的蛋白含有超氧化物歧化酶,具有很强的自由基清除能力。此外,赵立娜等[40]利用复合蛋白酶对提取的茶渣蛋白进行酶解,所得多肽混合物的自由基清除活性较强,且具有良好的抗脂质过氧化能力;韩雅利等[41]利用胰蛋白酶对苜蓿叶蛋白进行酶解,酶解后的蛋白表现出较高的还原能力和自由基清除能力。从不同原料中提取的叶蛋白均表现出良好的抗氧化活性,说明它是一种良好的天然抗氧化物来源,同时酶解能够增强叶蛋白的抗氧化活性。由此可见,花生叶可溶性蛋白具有一定的抗氧化活性,目前提取的花生叶可溶性蛋白是多种蛋白的混合物,有关蛋白分离、纯化及其活性研究仍有待进一步开展。
4 结论
本试验对碱溶酸沉法提取花生叶可溶性蛋白提取工艺进行了优化,得到最佳提取条件:浸提pH值9.0、浸提时间40 min、料液比1 ∶20 g·mL-1,其中浸提pH值对蛋白提取率影响最大。在最优条件下花生叶可溶性蛋白提取率为54.2%,蛋白质纯度为63.8%。此外,花生叶可溶性蛋白表现出良好的抗氧化特性且与浓度存在剂量依赖性,对DPPH 自由基和超氧阴离子自由基的清除能力较强,且具有一定的还原能力,但羟自由基清除能力较弱。花生叶蛋白的研究既能合理利用资源避免浪费,又能为花生加工产业提出新的发展方向。

