谷子CIPK基因(Seita.5G145900)对非生物逆境的响应
赵晋锋 杜艳伟 王高鸿 李颜方 赵根有 余爱丽
(山西省农业科学院谷子研究所/特色杂粮种质资源发掘与育种山西省重点实验室,山西长治 046011)
CBL 互作蛋白酶(CBL-interacting protein kinase,CIPK)是具有丝氨酸/苏氨酸结合位点的一类蛋白激酶[1]。研究表明,CIPK 包括N 端催化结构域和C 端调控结构域,其催化结构域类似于SNF1 蛋白激酶结构域[2]。CIPK是其上游类钙调磷酸酶B 亚基蛋白(calcineurin B-like protein,CBL)的靶蛋白,依靠与CBL 互作形成复合物传递信号启动细胞内下游相关应答基因的转录和翻译来应对胁迫[3]。在CIPK 调控域包含1个保守的FISH(称为NAF)基序,是介导CIPKs与CBLs 互作所必需的结构域[4-5]。CIPK 多基因家族在植物界广泛存在,如在苔藓、蕨类、裸子植物及被子植物中均发现有CIPK基因。目前已在多种植物中克隆到了CIPK基因,如拟南芥、水稻[6]、玉米[7]、小麦[8]、高粱[9]、棉花[10]、杨树[11]、亚洲梨[12]、葡萄[13]等。前人研究表明,CBL/CIPK 网络系统在植物响应环境胁迫中起着非常重要的作用,如参与盐胁迫、高镁胁迫、营养元素(低钾、低氮、低磷)胁迫、氧化胁迫、干旱胁迫、低温胁迫、高pH值胁迫及激素信号应答等生理生 化 过 程[14-16]。其中,AtCIPK1被报道能与AtCBL1或AtCBL9 互作,在干旱胁迫下维持植物细胞的渗透平衡[17],OsCIPK23 过量表达能激活或调控多种抗旱相关基因的表达,参与对干旱的响应[18]。AtCIPK6表达受盐、渗透胁迫和脱落酸(abscisic acid,ABA)强烈诱导,在细胞内钠离子外排方面起重要作用[19-20],水稻OSCIPK6和OSCIPK16 受干旱、ABA和低温诱导,表明它们可能参与干旱、低温、盐等逆境胁迫和ABA 应答[21],ZmCIPK21 受盐、高温、ABA的强烈诱导[22]。综上,CBL/CIPK 网络系统在植物对非生物逆境应答以及植物生长发育过程的众多信号转导途径中起关键调控作用。因此,通过对CIPK基因功能的深入研究了解植物逆境应答机制对于基因工程方法改良作物抗逆性具有一定应用价值和理论意义。
在前期研究谷子CBL和CIPK工作的基础上[23-24],本研究对SiCIPK19基因的结构,蛋白特征、理化特性,启动子区域顺式元件预测以及基因进化等方面进行了系统分析,利用实时定量PCR 方法分析SiCIPK19基因在不同逆境胁迫下的表达模式,并研究其在谷子不同生育期干旱条件下的表达情况,旨在为进一步揭示谷子CIPK基因在逆境胁迫应答中的功能提供依据。
1 材料与方法
1.1 材料与试剂
以测序谷子品种豫谷1号为材料,保存于山西省农业科学院谷子研究所生物技术科室。
逆转录酶、LATaqDNA 聚合酶和RNA 酶抑制剂,购自宝生物工程(大连)有限公司;TRIzol 及其他试剂均购自生工生物工程(上海)有限公司。
1.2 前处理试验
按照Shinozaki 等[25]的方法,在谷子幼苗三叶期分别对其进行20% 聚乙二醇6000(PEG 6000)、盐(250 mmol·L-1NaCl)、ABA (100 μmol·L-1)和低温(4℃) 胁迫处理,分别于处理0(CK)、1、3、6、12和24 h后整株取样。在旱棚种植豫谷1号,对照组(control,CK)生育期内正常浇水;干旱处理只浇3次关键水,其他农田管理措施相同。所有样品叶片取样后立即在-80℃冰箱中速冻备用。试验均设3次生物学重复。
1.3 植物总RNA提取和引物设计
植物总RNA提取参照TRIzol 试剂盒使用说明提取所有材料,试验所需其他试剂参照《分子克隆》第3版配制[26]。根据SiCIPK19、SiGAPB转录序列,用软件PrimerPrimer 5.0 设计SiCIPK19、SiGAPB的RT-qPCR特异性引物,由生工生物工程(上海)有限公司合成。
1.4 基因发掘和生物信息学分析
用已知拟南芥CIPK 蛋白序列在谷子数据库中比对发现其同源序列SiCIPK19 (Seita.5G145900)。蛋白理化特性、氨基酸组成、一二级结构等在ExPASy 网站(https://prosite.expasy.org)在线工具预测;SiCIPK19潜在功能用Profun 2.2 Server 预测,信号肽用SignalP 4.1 Server进行分析;SiCIPK19 编码蛋白亚细胞定位用Psort 在线工具预测;SiCIPK19 氨基酸同源性序列用BLAST 工具在NCBI 上查找。候选基因序列比对用ClustalX1.83 软件分析;不同物种CIPK基因[SbCIPK5(高粱),ZmCIPK15(玉米),OsCIPK5(水稻),TaCIPK5(小麦),AtCIPK6(拟南芥),SiCIPK6、16、19(谷子),PsCIPK(北美云杉),PpCIPK(小立碗藓),其蛋白序列号分别为XP_002454972.1、ACG36627.1、XP_015621591.1、AJR22390.1、NP_194825.1、XP_004973551.1、XP_004956833.1、XP_012701746.1、ABK24914.1和ACQ83473.1]进化树用Mega 4.1 软件构建[27]。
1.5 RT-qPCR分析
样品总RNA 反转录合成cDNA,均一化后作为RT-qPCR 模板,以SiGAPB作为内参基因。PCR 反应程序:95℃预变性2 min;95℃变性7 s,61℃退火10 s,72℃延伸15 s,共45个循环。试验设3次重复,采用2-ΔΔCt法[28]计算基因在某种逆境处理下某个时间点相对于对照组的转录水平变化。
2 结果与分析
2.1 基因序列参数分析
序列分析显示,SiCIPK19位于谷子5号染色体12948718-12950070 区域,基因组序列长1 353 bp,编码450个氨基酸,该基因只有一个转录本,无可变剪切,cDNA 编码序列由一个外显子构成,不含内含子。NCBI数据库比对显示,与水稻、高粱、普通小麦中的CIPK5 以及玉米中的CIPK15 同源性较高。由图1可知,SiCIPK19基因12~266 氨基酸区域为蛋白激酶功能域,311~335 氨基酸为NAF 结构域。此外,SiCIPK19 蛋白序列含有丝氨酸/苏氨酸激酶功能域(130~142 Aa)、蛋白激酶ATP 结合域(18~41 Aa)位点和信号转导位点等多个CIPK 家族基因的特征结构域。推断SiCIPK19 (Seita.5G145900)是谷子CIPK 家族成员之一。不同物种CIPK 蛋白序列比对进一步发现,SiCIPK19 蛋白与其他物种CIPK 蛋白非常相似,所有比对序列一致性为67.01%,具有非常保守的序列结构。该基因与高粱(SbCIPK5)、玉米(ZmCIPK15)和水稻(OsCIPK5) 小麦(TaCIPK5)基因同源性非常高,一致性分别为79.88%、76.89%、76.69%和75.50%,而与其他物种(拟南芥、北美云杉、小立碗藓) 序列一致性相对较低(图2)。该结论一方面说明SiCIPK19基因与高粱、玉米、水稻、小麦有较近的亲缘关系,另一方面表明SiCIPK19可能与这些不同物种同源性较高的基因在逆境应答或其他信号途径中有着相似的功能。
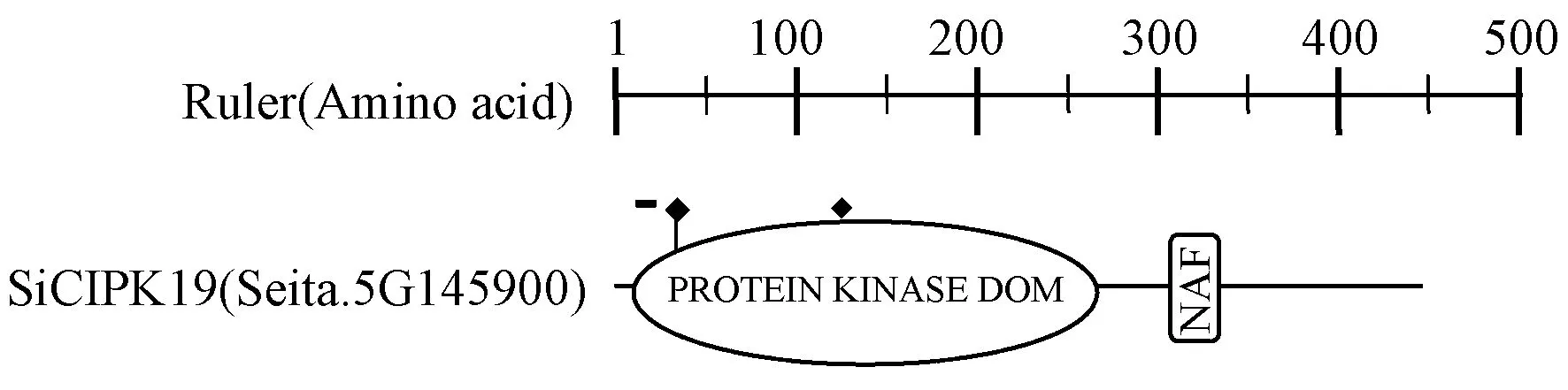
图1 SiCIPK19 蛋白功能域及功能位点预测Fig.1 Domain and functional site prediction of SiCIPK19 protein

图2 Seita.5G145900 与其他已知CIPK 氨基酸序列比对分析Fig.2 Sequences alignment of Seita.5G145900 and other known CIPKs
2.2 SiCIPK19基因的生物信息学分析
2.2.1 SiCIPK19 蛋白参数分析 参数分析显示,SiCIPK19 蛋白分子式为C2280H3613N635O662S19,分子量51.12 kD,等电点(isoelectric point,pI)9.23,平均疏水性(average hydrophobicity,GRAVY)-0.429,脂肪系数(aliphatic index,AI)82.56,不稳定指数37.95。二级结构预测显示螺旋(包括α-、pi-和3_10-helix)28.67%,β-折叠链16.22%,loop 环为55.11%。溶剂可及性分析显示,膜外面积占41.33%,膜内面积占49.11%,镶嵌面积占9.56%。亚细胞位置预测SiCIPK19 蛋白被定位在内质网(置信度57)。根据SignalP 4.1 Server 软件预测可知,SiCIPK19 第30位精氨酸残基具有最高的原始剪切位点分值0.127,第12位酪氨酸具有最高的综合剪切位点分值0.112,第1位甲硫氨酸残基具有最高的信号肽分值0.197。基因氨基酸残基的加权平均值为0.107 (小于临界值0.45)。因此,推测SiCIPK19基因所编码的蛋白不存在信号肽,为非分泌蛋白。
2.2.2SiCIPK19基因启动子区域顺式元件分析和功能预测 由表1可知,SiCIPK19 (Seita.5G145900)基因启动子区域主要包括植物激素应答元件(5个)、逆境类应答元件(2个)、光应答元件(11个)及其他类元件(8个)。Profun 2.2 Server 软件预测显示,SiCIPK19蛋白在分子功能上可能具有丝氨酸/苏氨酸激酶活性,杂环化合物、核苷磷酸、小分子、有机环状化合物结合活性,以及转移酶活性、激酶活性、蛋白激酶活性。上述结果表明,SiCIPK19基因可能参与蛋白质、大分子、有机物质的合成以及细胞代谢,信号转导,刺激应答及生物调节等生物过程。
2.3 不同非生物逆境胁迫下谷子苗期SiCIPK19基因的表达分析
由图3可知,在不同胁迫处理下谷子苗期SiCIPK19的表达量均有所上调,但其具体表达动态变化模式不完全相同。20% PEG 6000 胁迫处理1 h时,SiCIPK19表达量下调为CK的0.55倍;胁迫处理3~6 h时,SiCIPK19表达量迅速上调;胁迫处理12 h时,SiCIPK19表达量急剧上升至最大,为CK的70.66倍。100 μmol·L-1ABA 胁迫下,随着胁迫时间的延长,SiCIPK19表达量呈先上升后下降的趋势,胁迫处理12 h时,SiCIPK19表达量达到最大值,为CK的53.71倍。250 mmol·L-1NaCl 胁迫时,SiCIPK19表达量呈先下降后上升再下降的趋势,胁迫处理1、3、6、12、24 h时,SiCIPK19表达量分别为CK的0.48、3.30、10.31、7.56、2.00倍。低温(4℃)胁迫下,SiCIPK19表达量呈先下降后上升的趋势,胁迫处理1、3、6、12、24 h时,SiCIPK19表达量分别为CK的1.02、0.73、0.36、0.77、1.98倍。相比之下,20% PEG6000和100 μmol·L-1ABA 胁迫对SiCIPK19表达量影响较大,胁迫下SiCIPK19 最高表达量分别为CK的70.66和53.71倍,而250 mmol·L-1NaCl和低温(4℃) 胁迫 对SiCIPK19表达量影响相对较小,胁迫下最高表达量分别为CK的10.31和1.98倍。综上表明,SiCIPK19 参与了谷子苗期干旱、盐、低温和ABA 等逆境胁迫响应,尤其是在干旱和ABA 信号途径中可能起重要作用。
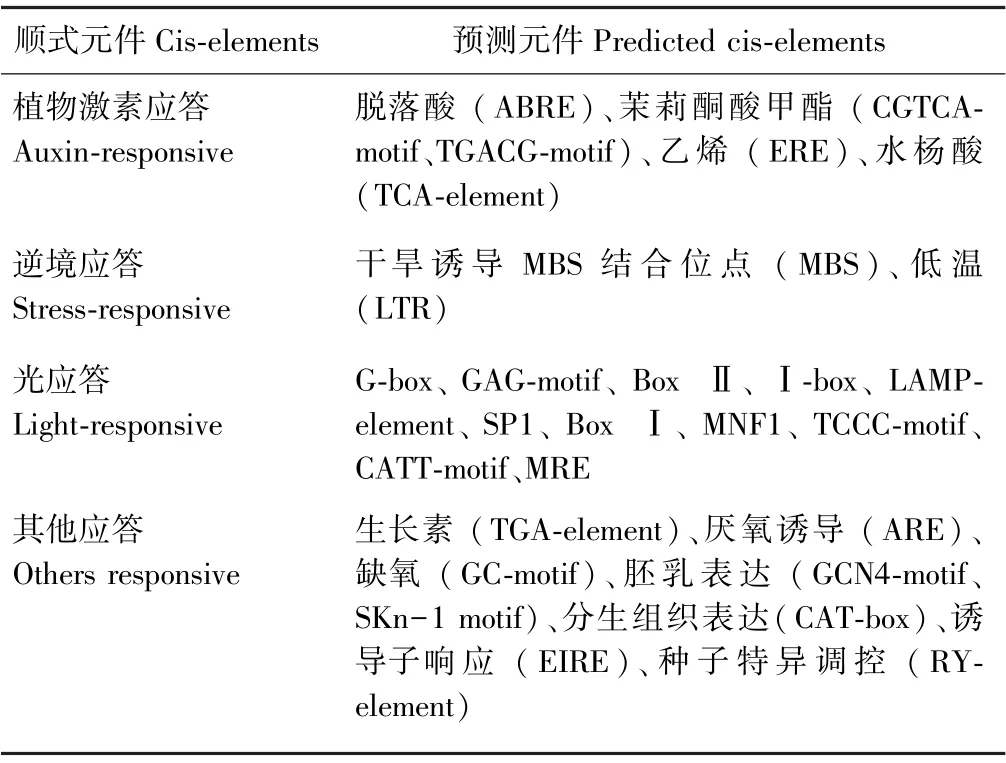
表1 SiCIPK19(Seita.5G145900)基因启动子区域顺式元件预测Table1 Putative cis-elements in the promoter of SiCIPK19 (Seita.5G145900)
2.4 干旱处理下谷子不同生育期SiCIPK19基因的表达分析
由图4可知,CK 谷子的SiCIPK19基因在拔节期、抽穗期和灌浆期表达量逐步提高,在抽穗期和灌浆期表达量分别为拔节期的6.18和7.24倍。在干旱条件下,谷子拔节期、抽穗期和灌浆期SiCIPK19基因表达量分别为CK 拔节期的8.31、237.23和235.46倍,较CK 相应生育期表达量也大幅度提升,CK 谷子的SiCIPK19基因在各生育期均有表达,揭示在谷子正常生长条件下该基因在整个生育期均发挥了一定作用。在干旱条件下SiCIPK19基因表达量在拔节期、抽穗期和灌浆期均被诱导,尤其在抽穗期和灌浆期诱导倍数达几百倍之高。推测SiCIPK19基因参与了谷子在拔节期、抽穗期和灌浆期等不同生育期对干旱胁迫的响应,尤其是在抽穗期和灌浆期的干旱应答信号途径中发挥重要作用。

图3 不同胁迫下谷子苗期SiCIPK19基因的表达分析Fig.3 Expression analysis of SiCIPK19 under different stressesing in foxtail millet seedlings
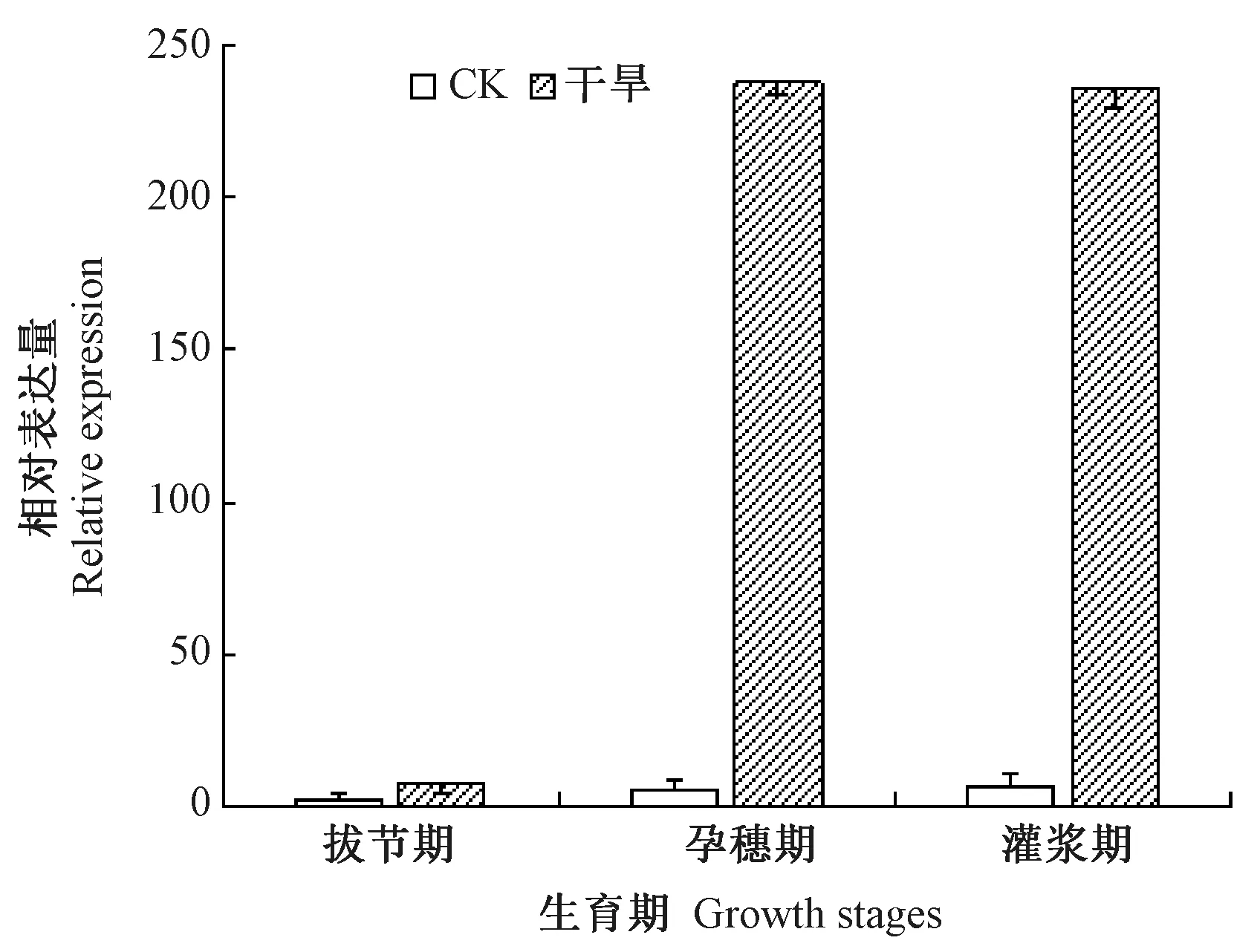
图4 SiCIPK19基因在谷子不同生育期干旱胁迫下的表达分析Fig.4 Expression analysis of SiCIPK19 of foxtail millet under drought stressesing in different growth stages
3 讨论
非生物逆境胁迫中的干旱、盐、低温对植物的影响最为明显,是导致作物减产的主要限制因素[29]。CIPK是一类丝氨酸/苏氨酸蛋白激酶,在植物体内以多基因家族方式存在。CIPK基因在响应逆境胁迫、病原体与防御反应、营养元素吸收与平衡、激素应答等植物生长和发育过程中发挥着重要的作用,尤其与非生物逆境胁迫的信号传导密切相关[14]。谷子是我国典型的抗旱耐瘠特色作物,因此发掘谷子中的CIPK基因并在分子水平上阐明其耐逆机理和调控机制具有重要的理论意义和广阔的应用前景。要解析CIPKs 功能首先要清楚CIPKs 参与了哪些逆境胁迫应答,在哪些逆境信号通路中起作用。本研究在前期工作基础上发现了位于谷子基因组5号染色体的谷子的SiCIPK19 (Seita.5G145900)基因,随后对该基因的蛋白序列参数特征、主要功能域等进行了详细分析,结果显示,SiCIPK19基因包含所有CIPK 家族基因的主要特征,表明SiCIPK19基因是谷子CIPK 家族成员之一。
为发掘SiCIPK19基因的潜在功能,本研究对其启动子区域的顺式元件进行了预测和分析。一般来讲,如果基因启动子区域存在某种顺式元件则暗示该基因很可能参与相应的信号途径[30]。顺式元件分析发现,在SiCIPK19 启动子区域存在逆境类、激素类以及大量的光应答元件,预示SiCIPK19基因很可能参与到这些相应的信号途径中。此外,谷子苗期逆境表达分析结果表明,SiCIPK19 在受到不同逆境胁迫时其表达量均被诱导提高,特别是在干旱和100 μmol·L-1ABA 胁迫时表达量被强烈诱导,说明SiCIPK19 参与了谷子苗期干旱、盐、低温和ABA 等逆境胁迫响应,尤其是在干旱和ABA 信号途径中起重要作用。干旱处理下谷子不同生育期SiCIPK19基因的表达分析表明,SiCIPK19基因参与了谷子在拔节期、抽穗期和灌浆期等不同生育期对干旱胁迫的响应,尤其是在抽穗期和灌浆期的干旱应答信号途径中发挥重要作用。本研究不仅验证了在SiCIPK19 启动子区域存在逆境相关顺式元件,且与已报道的大量CIPK基因能响应非生物逆境应答的研究结果相一致。此外,功能预测显示,SiCIPK19可能参与蛋白质、大分子、有机物质的生物合成以及细胞代谢,信号转导,刺激应答以及生物调节等生物过程;顺式元件分析也发现在SiCIPK19 启动子区域存在众多激素类应答元件(脱落酸、茉莉酮酸甲酯、水杨酸、乙烯),逆境类应答元件以及其他类元件,包括厌氧诱导、生长素、激发响应元件、种子特异调控元件。表明SiCIPK19基因不仅在逆境应答中起关键作用,而且在其他环境胁迫信号系统应答所涉及的植物生长发育和生理生化过程中也可能发挥一定作用。下一步应构建SiCIPK19基因的超表达和缺失载体,通过农杆菌介导转化谷子进一步研究该基因在逆境应答中的功能和机制。此外,在启动子区域还发现了大量的光应答元件,而谷子是光温敏感性作物[31],预示SiCIPK19基因也可能参与调控谷子的光温应答调控。
4 结论
本研究系统分析了谷子SiCIPK19 (Seita.5G145900)基因的蛋白结构、特征、功能域、顺式元件等参数特征,证明SiCIPK19 参与了谷子苗期干旱、盐、低温和ABA 等逆境胁迫响应,可能在干旱胁迫应答过程中起重要作用。本研究丰富和完善了植物CIPK 家族成员,为进一步阐明CBL/CIPK 信号系统在谷子逆境应答中的功能、机制提供了试验依据。

