血清miRNA-494和miRNA-125a表达在腰椎间盘退变疾病中的临床应用
苏晓明,朱 超,杨 瑜*,李 毅
(1.陕西省咸阳市第一人民医院检验科,陕西 咸阳 712000; 2.陕西中医药大学附属医院骨三科,陕西 咸阳 712000;3.西安交通大学医学院附属红会医院足踝外科,陕西 西安 710000)
椎间盘退行性疾病是以颈肩痛、腰腿痛为主要表现的一系列临床综合征,包括颈椎病、椎间盘突出症、椎间盘源性腰痛、退变性椎管狭窄症,以及颈、腰椎不稳症等。这一系列综合征最终导致椎间盘退变(intervertebral disc degeneration,IDD)[1],然而IDD的发病机制尚不清楚[2]。研究认为,miRNAs通过调控蛋白表达参与机体的多种生理和病理过程。更多的证据表明miRNAs调控椎间盘髓核细胞的凋亡[3-6]。既往关于IDD的研究多以髓核组织为研究对象,针对外周血液的研究少有报道。本研究通过RT-PCR检测IDD患者血清miRNA-494和miRNA-125a的表达,旨在探讨IDD疾病的发病机制,为其早期诊断及治疗的研究提供新的思路。
1 资料与方法
1.1一般资料 选取2015年10月-2017年10月在陕西省咸阳市第一人民医院骨科就医的腰椎间盘膨出或突出患者45例为退变组,男性25例,女性20例,年龄23~61岁,平均(45.8±9.3)岁,体重指数24.3±2.9;下腰痛患者42例为对照组,男性23例,女性19例,年龄48~70岁,平均(58.3±9.7)岁,体重指数23.7±2.8。2组性别、年龄和体重指数差异均无统计学意义(P>0.05),具有可比性。
所有患者无腰部手术史,且排除腰椎骨折、脊柱侧凸畸形、骨质疏松、肿瘤、结核、感染等疾病。退变组主要表现为腰痛及根性症状,经X线片和MRI确诊均为椎间盘膨出或突出;对照组主要临床症状为下腰痛、经MRI排除椎间盘源性腰痛,椎间盘膨出或突出、退变性椎管狭窄等。
本研究经医院伦理委员会批准;患者均签署知情同意书。
1.2研究方法
1.2.1MRI检查 所有患者行脊柱常规扫描及磁共振弥散加权成像(diffusion weighted imaging,DWI)[7],扫描过程分别采用快速自旋回波及平面回波成像脉冲序列(GE SIGNA EXCITE1.5T超导型MRI成像仪)。选取L3/4、L4/5、L5/S1共261个椎间盘测量其椎间盘髓核水分子的表观弥散系数(apparent diffusion coefficient,ADC),选择椎间盘髓核区的前、中、 后3点,每个点于腰椎正中矢状面上取圆形兴趣区,并避开上下椎体的终板及脑脊液,后取平均值为每个椎间盘的ADC值,评价椎间盘的退变程度。
1.2.2椎间盘Pfirrmann(PM)分级[6]目前国际上多采用PM分级评价椎间盘的退变程度。Pfirrmann分级分别由2位有经验的医师进行分析,见表1。

表1 椎间盘PM分级Table 1 PM classification of intervertebral disc
1.2.3标本采集 所有患者在禁食12 h后采集静脉血,于4 ℃分离血清,于-80 ℃保存备用。
1.2.4miRNAs表达量检测 血清RNA提取采用Trizol法,应用RT-PCR技术检测血清中miRNA-125a和miRNA-494的表达(mirVANA PARIS试剂盒)。吸取100 μL血清与变性液混匀,于冰上孵育5 min;加入等体积的酸、酚、氯仿混匀,冷冻离心5 min,重复此步骤3次,加入250 μL无水乙醇,充分混合后过柱,洗柱2次并用缓冲液稀释,获得RNA提取液。用琼脂糖凝胶电泳分析RNA溶液。若紫外分析仪观察到5 s、18 s 和28 s出现清晰条带,则认为此RNA 可用于反转录。用紫外分光光度计对电泳条带进行扫描,采集260 nm 和280 nm 波长处的光密度值。若其光密度值在1.7~2.0间则认为总RNA 溶液无杂质。后将RNA溶液于-80 ℃保存备用。根据TaqMall microRNA Reverse Transcripts Kits操作说明书进行RT-PCR。引物设计采用pfimer 5软件,内参照采用β-actin。miRNA-125a引物序列中正义链为5′-GCCTCCCTGAGACCCTTTA-3′,反义链为5′-GTGTCGTGGAGTCGGCA-3′,扩增产物长度为350 bp。 miRNA-494的引物序列中正义链为5′-TTAATGCTAATCGTGACT-3′,反义链为5′-ACCTGAGAGTAGACCAGA-3′,产物长度390 bp。β-actin的引物序列中正义链为5′-AGGCACTGGGGCTTCATCTGAC-3′,反义链为 5′-GCCTTCCATCCCTTTGCTTAG-3′, 产物长度为650 bp。PCR反应条件是95 ℃ 10 min、95 ℃ 15 s、60 ℃ 1 min,50个循环后,于4 ℃ 结束反应。将扩增产物进行电泳,通过扫描分析得出miRNA-125a,miRNA-494和β-actin 的光密度,以β-actin为参考物,求出miRNA-125a和miRNA-494的变化值(△CT),以2-△ct得到miRNA-125a和miRNA-494相对表达量。
1.3统计学方法 应用SPSS 21.0统计软件分析数据。等级资料比较采用秩和检验;计量资料比较采用两独立样本的t检验;相关性采用Pearson直线相关分析;应用受试者工作特征(receiver operator characteristic,ROC)曲线评价miRNAs在IDD中的作用。P<0.05为差异有统计学意义。
2 结 果
2.12组椎间盘PM分级和ADC值比较 对照组共检查126个椎间盘,其中分级在Ⅰ级和Ⅱ级(正常)99个椎间盘,占78.6%(99/126), Ⅲ级、Ⅳ级和Ⅴ级27个椎间盘,占21.4%(27/126);退变组共检查135个椎间盘,其中分级在Ⅰ级和Ⅱ级(正常)17个椎间盘,占12.6%(17/135),Ⅲ级、Ⅳ级和Ⅴ级118个椎间盘,占87.4%(118/135)。2组PM分级构成比差异有统计学意义(P<0.05), 退变组ADC值低于对照组,差异有统计学意义(P<0.05),见表2。
2.22组血清miRNA-125a和miRNA-494水平比较 退变组血清miRNA-125a水平较对照组明显降低,血清miRNA-494水平较对照组明显升高,差异均有统计学意义(P<0.05),见表3。
2.3相关性分析 miRNA-125a表达水平与ADC值呈正相关(r=0.853,P<0.01),退变组血清miRNA-494表达水平与ADC值呈负相关(r=-0.897,P<0.01)。
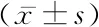

组别例数miRNA-125amiRNA-494对照组420.93±0.190.20±0.08退变组450.25±0.090.97±0.23t值42.20645.293P值0.0000.000
2.4血清miRNA-125a和miRNA-494的ROC曲线分析 血清miRNA-125a和miRNA-494的曲线下区域面积分别为0.893(95%CI=0.815~0.971,P<0.01)、0.852(95%CI=0.762~0.932,P<0.01),敏感度分别为87.9%和93.7%,特异度分别为77.0%和67.7%,准确度分别为80.0%和77.7%,阳性预测值分别为92.3%和92.1%,阴性预测值分别为81.8%和76.9%,见图1,表4。
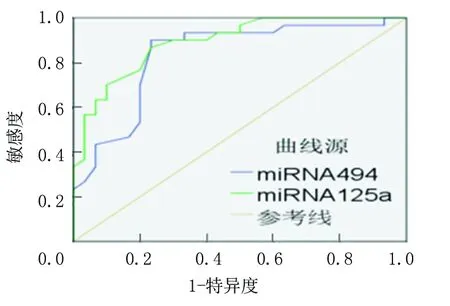
图1 miRNA-494、miRNA-125a在诊断IDD中的ROC曲线
Figure1ROC curve of miRNA-494and miRNA-125a in diagnosing IDD

表4 血清miRNA-125a和miRNA-494的价值分析Table 4 Value analysis of serum microRNA-125a and microRNA-494
3 讨 论
研究认为,退变椎间盘主要表现为椎间隙高度降低、髓核脱水纤维化和突出、纤维环破裂、软骨终板钙化、软骨下骨硬化等[8]。在退变的椎间盘组织中常伴有促炎性细胞因子(如IL-1、TNF-α)和基质蛋白酶表达的增加。炎性因子和基质蛋白酶的过表达最终导致椎间盘髓核细胞数目减少和活性降低,进一步引起细胞外基质成分如Ⅱ型胶原蛋白和蛋白多糖等减少,这些变化破坏了细胞外基质合成及分解代谢的平衡,进而促进了IDD的病理进程[2,9-10]。研究发现,miRNA可能介导了髓核细胞的凋亡和增生、细胞外基质合成、炎症反应以及软骨终板的退变,显示miRNA可能参与IDD的病理过程[1]。Ji等[11]应用RT-PCR技术分析发现退变的椎间盘髓核组织中存在41种差异性表达的miRNAs,其中miRNA-98明显下调,且其表达与IDD程度有负相关性。Li等[12]通过相似的研究方法发现退变的髓核组织中存在23种表达异常的miRNAs,其中miRNA-27b表达下调。Wang等[13]研究显示,miRNA-494表达上调增加了椎间盘髓核细胞的凋亡率,并且发现敲除内源性miRNA-494后的髓核细胞通过上调JunD蛋白表达减少细胞凋亡,认为该过程可能与细胞色素C的凋亡通路有关。王明远等[14]选择10例腰椎退行性疾病患者作为研究对象,其研究显示退变的髓核细胞中存在高表达的miRNA-494和miRNA-513a-5p,并且预测MKK4、JunD蛋白可能分别为以上2种miRNAs的靶基因。提示miRNA-494可能促进IDD的病程进展。本研究对循环miRNA-494表达的研究结果也印证了其在IDD疾病中的作用,结果显示IDD患者血清miRNA-494表达显著高于对照组,提示 miRNA-494在IDD的发病机制中起着重要作用。故推测,纠正miRNA-494的表达失调,可能减少髓核细胞凋亡并延缓或逆转IDD病理过程。
既往的研究显示在一些肿瘤组织中检测到miRNA-125a表达。并认为其与premir-125a rs12976445 T等位基因有关。携带该基因的乳腺癌患者呈现低表达的miRNA-125a水平[15]。Ma等[16]研究认为miRNA-125a的这种多态性变化与NPC的细胞凋亡有关,这也成为临床上治疗IDD疾病的生物标志物。Liu等[17]采用RT-PCR技术对193例腰椎退变的髓核组织进行研究,论证了BAK1是miRNA-125a的靶基因,miRNA-125a的表达随着BAK1升高而降低,其与退变的髓核组织细胞凋亡呈负相关,而与BAK1 mRNA的细胞凋亡呈正相关。本研究采用RT-PCR技术分析IDD患者血清miRNA-125a的表达,结果显示其表达水平较对照组显著下调。提示miRNA-125a可能通过抑制靶基因BAK1的表达调节腰椎退变患者的髓核组织的细胞凋亡。因此,检测miRNA-125a表达可能对IDD的治疗进展有监测作用。
本研究对退变椎间盘的分析结果显示,ADC值随着退变程度增加而降低,印证了髓核水分子弥散功能随着IDD程度的加重而同步下降;进一步分析不同PM级别髓核细胞的ADC值,发现随着PM分级的增高,ADC值则降低,即水分子弥散功能越差,显示IDD越明显。相关性分析结果显示,血清miRNA-494表达与ADC值呈负相关性,而miRNA-125a表达则与ADC值具有正相关性。提示2标志物可能参与IDD 的病理过程,其表达可能与髓核水分子弥散功能有关。利用ROC曲线评价miRNA-494和miRNA-125a的结果显示,2标志物表达在诊断IDD的发生中有临床意义。因此,检测血清miRNA-494和miRNA-125a表达并结合上述IDD发生的因素可用于预测该疾病的发生及评价病程的进展,并为其早期进行干预治疗提供依据。虽然与IDD相关miRNAs的研究仍处于探索阶段,且其在IDD过程中的具体调控机制及信号通路尚不完全明确,但miRNAs在IDD中的研究已显示出广阔的前景,其对IDD的早期诊断及后续治疗具有重大指导意义。深入研究miRNAs的调控机制,可能为IDD的早期诊断和治疗提供更多的选择。

