Bi2MoO6/g-C3N4Z型异质结的合成及其光催化性能的研究
孟亚楚,李育珍,,张艾明,石建惠,李 震,王晓瑾
(1.太原理工大学 环境科学与工程学院,太原 030024;2.中国辐射防护研究院,太原 030006)
近年来,化工企业的发展使水污染问题日益严重。常见的处理废水的方法有吸附法、混凝法、氧化法、电解法以及生物处理法[1],这些方法有明显的缺陷,如费用较高、处理周期长及处理效率差等。研究发现光催化具有成本低、环境友好、应用范围较广等优点,其驱动力来自可持续的绿色太阳能,被认为是解决环境问题最有效的方法之一[2]。
近年来,石墨碳氮化物(g-C3N4)[3]由于其较窄的禁带宽度(2.7 eV)、便宜易得且有良好的热稳定性和化学稳定性引起了众多研究人员的关注。g-C3N4在光催化领域应用范围广,被用于可见光解水制氢气、光催化有机合成反应以及光催化降解有机污染物[4]。
虽然g-C3N4是一种优异的光催化材料,但它量子效率低、可见光光电转换率低、活性位点有限且不易回收。为解决此类的问题,人们研究了许多方法来提高g-C3N4的光催化性能。近年来主要构建以g-C3N4为基础的,有异质结构的纳米复合材料[5]。Bi2MoO6是一种典型的Aurivillius氧化物,具有适当的禁带宽度(2.5~2.8 eV),以及优异的化学稳定性、耐腐蚀性和低成本[6]。本文选用Bi2MoO6改性g-C3N4形成异质结,以提高g-C3N4的光催化活性。以罗丹明B(RhB)作为目标污染物来检测其光催化活性,同时研究了pH对催化效果的影响,最后通过陷阱实验寻找在光催化过程中起主要作用的活性因子,并依据实验结果推测出可能的光催化降解机理。
1 材料与方法
1.1 试剂与仪器
本文中所有试剂均为分析纯。尿素(99%)和RhB购自天津大茂化学试剂厂。三聚氰胺(99%)和Bi(NO3)3·5H2O(99%)购自天津凯通化学试剂有限公司。Na2MoO4·2H2O(99%)购自天津市光复精细化工研究所。甲醇(CH3OH,99.5%)和草酸铵(AO,99.5%)购自天津致远化学试剂有限公司。苯醌(BQ,99%)购自天津清华金鹰科技有限公司。叔丁醇(TBA)购自天津北辰方正试剂厂。在实验过程中使用超纯水。
通过LABXRD-6000 X射线衍射仪(XRD,日本)测定样品的晶体结构,辐射源为Cu Kα,λ=0.154 nm,电压40 kV,电流30 mA,扫描速率为2 (°)/min,扫描范围2θ=10°~80°.使用Hitachi SU-3900分光光度计(DRS,日本)测定光催化剂的光吸收性能,采用BaSO4作衬底,扫描波长范围为200~800 nm.
1.2 材料制备
1.2.1制备g-C3N4
称取10.5 g的尿素和4.5 g的三聚氰胺置于氧化铝坩埚中,在电炉中以5 ℃/min的速率加热到550 ℃并保持4 h,反应结束后冷却至室温,研磨回收得到粉末状样品g-C3N4.
1.2.2制备Bi2MoO6
通过水热法合成Bi2MoO6.称取Bi(NO3)3·5H2O 4.850 7 g和Na2MoO4·2H2O 1.209 8 g,将二者溶解在100 mL超纯水中超声10 min,离心5 min,然后将悬浮物移到高压釜中,加超纯水约至体积的70%.然后在180 ℃下保持12 h.反应结束后冷却至室温。最后分别用超纯水和无水乙醇洗样三次,在80 ℃下干燥7 h研磨制得Bi2MoO6样品。
1.2.3制备Bi2MoO6/g-C3N4
根据湿式浸渍法制备Bi2MoO6/g-C3N4[7]:称取0.3 g g-C3N4于250 mL烧杯中,量取20 mL甲醇后超声30 min.再称取不同质量的Bi2MoO6溶解在g-C3N4溶液中,超声1 h.混合均匀后在室温下磁力搅拌24 h.反应结束后分别用蒸馏水和无水乙醇洗样3次于60 ℃下干燥4 h,经研磨回收制得粉末状样品Bi2MoO6/g-C3N4.调节Bi2MoO6与g-C3N4的质量比分别为20%,25%,30%,35%和40%,依次将二元催化剂记作20BCN、25BCN、30BCN、35BCN和40BCN.
1.3 光催化性能测试实验
本实验选择RhB作为目标污染物来测试Bi2MoO6/g-C3N4的可见光催化性能。反应光源是具有420 nm滤光片的300 W氙灯,工作电压为14 V,工作电流为15 A.染料RhB的浓度为15 mg/L。称取不同掺杂比例的催化剂0.200 0 g溶解在RhB溶液中,超声10 min进行光催化实验。暗反应40 min达到吸附-解吸平衡后进行光催化反应。光照1 h,光照前30 min每隔5 min取一个样,后30 min每隔10 min取等量样品,离心后取上清液在紫外-可见分光光度计上测试吸光度。RhB的最大吸收波长为554 nm.
除探索Bi2MoO6/g-C3N4最佳掺杂比例外,本论文还研究了初始pH对催化剂性能的影响,同时进行自由基捕获实验来探索光催化的机理。
2 结果与讨论
2.1 样品表征
2.1.1XRD分析
图1显示了g-C3N4、Bi2MoO6和30BCN的XRD图。由图可见,g-C3N4样品的衍射图在27.52°和13.02°处显示出两个不同的衍射峰,指向g-C3N4的(002)和(100)衍射面,这两个峰分别对应于芳族体系和层间结构填料的特征晶面间堆积峰,对应于标准卡片(JCPDS 87-1526)[8]。纯Bi2MoO6的28.24°、32.56°、36.02°、47.1°、55.52°、58.42°和68.08°的衍射峰分别归属(131)、(200)、(151)、(260)、(331)、(200)和(262)的晶格面,所有的衍射峰都可以指向Bi2MoO6的单斜晶相,对应于标准卡片(JCPDS 73-1126)[9]。在30BCN的XRD图谱上均发现了Bi2MoO6和g-C3N4的特征峰,说明30BCN样品中存在Bi2MoO6和g-C3N4,另外在图谱上未发现其他晶相的杂峰,证明30BCN具有较高的纯度。
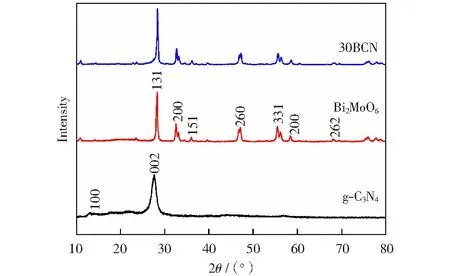
图1 g-C3N4、Bi2MoO6和30BCN的XRD图Fig.1 XRD patterns of g-C3N4, Bi2MoO6 and 30BCN
2.1.2光吸收性能分析
图2为g-C3N4、Bi2MoO6和30BCN的紫外-可见漫反射光谱和带隙图。光的吸收范围在光催化中起重要作用,特别是对于可见光驱动的催化剂。从图2(a)中可以看出,g-C3N4的边缘吸收峰为475 nm,这与g-C3N4的禁带宽度为2.68 eV有一定联系[10],Bi2MoO6的强吸收范围在516 nm,这归因于从O2p轨道(VB)到Mo4d轨道和Bi6p轨道(CB)的电子跃迁引起的固有带隙跃迁[11]。与g-C3N4相比,30BCN的吸收边出现红移(508 nm),表明可见光的波长拓宽,进而得出复合后材料的光催化性能得到提升,使复合催化剂能更有效地利用太阳光。这是由于Bi2MoO6和g-C3N4之间的异质结的相互作用有效地增强了电子-空穴对的分离,促进了光生电子的带隙跃迁,因此增强了可见光区域的吸收。所制备的材料的带隙估值如图2(b)所示。g-C3N4和Bi2MoO6的带隙值分别为2.68 eV和2.33 eV,30BCN的带隙值为2.14 eV,相对于纯g-C3N4变窄了约0.54 eV,降低了内电子转移中要克服的势垒高度,加速了催化剂内部的电子转移,延长了电子-空穴对的寿命,进而增强了催化剂的光催化性能,与之前的测试结果一致。样品的价带(VB)电势可以通过以下公式进行理论计算:
EVB=X-EC+0.5Eg.
(1)
式中:EVB是样品的价带电位,eV;X是样品的电负性,它是组成原子的电负性的几何平均值[12],eV;EC是氢原子上的自由电子的能量,约4.5 eV;Eg是样品的带隙能量,eV.
通过查阅知Bi2MoO6和g-C3N4的X值分别为5.55 eV与4.67eV.经过计算可得Bi2MoO6和g-C3N4的价带(VB)电势分别为2.215 eV与1.51 eV.而Bi2MoO6和g-C3N4的导带(CB)电势可以通过ECB=EVB-Eg计算得到,它们的导带电势分别为-0.115 eV与-1.17 eV.因此可以看出Bi2MoO6的VB电势要比g-C3N4更正,而g-C3N4的CB电势比Bi2MoO6更负,基于这个数据可以推测出光生电子的走向,进而说明光降解机理。

图2 (a) 紫外-可见漫反射光谱;(b) 带隙图:g-C3N4、 Bi2MoO6和30BCNFig.2 (a) Ultraviolet-visible diffuse reflection spectrum and (b) band gap graph of g-C3N4, Bi2MoO6 and 30BCN
2.2 光催化性能影响因素的研究
2.2.1Bi2MoO6的掺杂比例对g-C3N4光催化性能的影响
图3表示了不同Bi2MoO6掺杂比例的Bi2MoO6/g-C3N4二元催化剂降解15 mg/L RhB的光催化降解图。去除率R的公式如下:
(2)
式中:C0是RhB的初始质量浓度,mg/L;Ct是t时刻后RhB的质量浓度,mg/L.
由图3可知,Bi2MoO6在短时间内可以将RhB降解完全,并且与单体高吸附量形成鲜明对比,因此可知二元复合材料对光催化性能有很大的提升。40%掺杂比例的吸附量最低为22.97%,但是在光照前25 min时30%的掺杂比例的速率明显优于其他掺杂比例,可以在较短时间内达到最高降解量。二元催化剂30BCN在30 min内基本可以将15 mg/L RhB完全降解。本研究降解效率高于介孔g-C3N4/Na膨润土复合材料(g-C3N4/Na膨润土可将RhB降解95.7%)[13]。因此综合吸附量与降解量,选择掺杂比例为30%,即30BCN作为最佳催化剂。

图3 纯g-C3N4和不同Bi2MoO6掺杂比例的BCN的光催化 降解图(催化剂投加量=1 g/L,C0=15 mg/L)Fig.3 Photocatalytic degradation curves of g-C3N4 and Bi2MoO6/g-C3N4
2.2.230 BCN/g-C3N4pH对比实验
图4是1.0 g/L 30BCN降解15 mg/L不同pH RhB曲线图。pH为2时降解速率很快,光照5 min骤降,并且在短时间内基本100%完全降解,吸附量为37.63%;pH为3时与pH为2相差不大,在短时间内基本100%完全降解,吸附量为34.13%;pH为5时在光照30 min内完全降解,吸附量为26.97%;pH为7时光照60 min后降解量为99.86%,吸附量为29.02%;pH为9时在光照60 min后降解量为99.86%,吸附量为24.23%;碱性越强降解速率越慢;pH为11时光照60 min后降解量为84.14%,吸附量为21.72%.由此得出结论酸性越强降解速率越快降解量越高,碱性越强降解速率越慢,与单体的pH实验的趋势是一致的。pH与催化剂表面的酸碱性质有关,pH
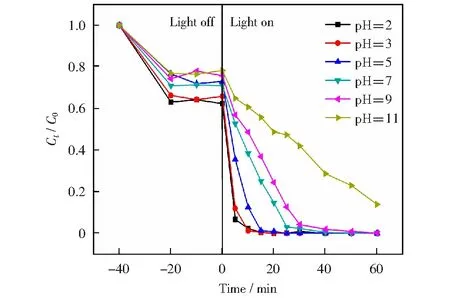
图4 30BCN在不同pH下对RhB的光催化降解曲线图 (30BCN的投加量为1.0 g/L,C0=15 mg/L)Fig.4 Photocatalytic degradation curves of 30BCN for RhB at different pH values
2.2.330 BCN/g-C3N4自由基捕获对比实验
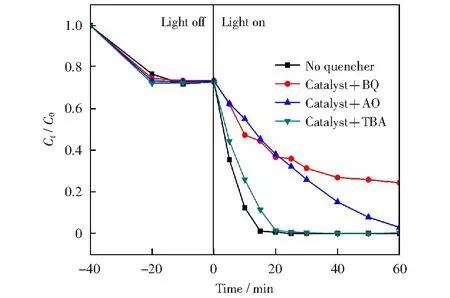
图5 不同捕获剂对30BCN光降解15 mg/L RhB 效果影响对比图Fig.5 Effects of different capture agents on 30BCN photodegradation of 15 mg/L RhB
2.3 光催化机理图
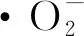

图6 光催化机理图Fig.6 Photocatalytic mechanism diagram
3 结论
通过水热法,成功制备出Bi2MoO6/g-C3N4二元光催化剂,并通过降解15 mg/L RhB检验其光催化性能,结果发现当掺杂比例为30%时,对RhB的降解效果较好。本文不仅探究了单体g-C3N4的制备过程以及g-C3N4的光催化活性,重点研究了二元催化剂Bi2MoO6/g-C3N4催化效率提升的原因与光催化降解机理,同时还在尽量节约催化剂投加量的前提下发现其可以降解不同pH下的RhB,这将更好地应用在处理实际印染工业废水中。最后通过捕获实验得出在光催化过程中起主要作用的活性因子是超氧离子自由基,并据此推测出可能的光催化降解机理。

