BRAFV600E 突变与甲状腺乳头状癌淋巴结转移的关系及对放射性碘治疗后s-Tg 的影响
张小燕 王森 丁颖 李文亮 杨光 陈鸿彪 贾 建敏 杨辉
郑州大学附属肿瘤医院核医学科 450008
甲状腺乳头状癌(papillary thyroid cancer,PTC)起源于滤泡上皮细胞,是最常见的内分泌恶性肿瘤,占甲状腺恶性肿瘤的80%~85%[1]。PTC 是相对惰性的恶性肿瘤,经过规范化的初始治疗如手术、放射性碘(radioactive iodine,RAI)治疗和TSH抑制后,患者的5 年生存期可高达97%[2]。BRAFV600E基因是PTC 中最常见的突变基因,人群中发生率为27.3%~90.2%[3]。有研究发现,BRAFV600E突变与PTC 的临床病理特征如年龄、性别、肿瘤大小及淋巴结转移等有关,并可独立预测肿瘤的复发率和病死率[2,4]。然而,也有相关文献报道BRAFV600E突变与PTC 的临床病理特征没有关联[5]。本研究通过分析BRAFV600E突变与PTC 临床病理特征之间的关系,检测甲状腺全切或近全切术后接受2 次RAI 治疗患者的刺激性甲状腺球蛋白(stimulated thyroglobulin,s-Tg)水平及其变化趋势,以此来评价BRAFV600E突变对RAI 治疗的临床参考价值。
1 资料与方法
1.1 一般资料
选取2013 年1 月至2018 年12 月于郑州大学附属肿瘤医院行甲状腺全切或近全切手术、病理证实为PTC 且行BRAFV600E基因检测的患者2647例,其中男性599 例、女性2048 例,年龄8~84(45.00±11.70)岁。根据PTC 原发灶BRAFV600E基因突变与否,将患者分为突变组(2230 例)和野生组(417 例),回顾性分析2 组患者的年龄、性别、淋巴结转移和肿瘤长径等临床资料。肿瘤按长径分为>1 cm 组和≤1 cm 组。将长径≤1 cm 的肿瘤定义为微小PTC。纳入标准:(1)临床资料完整,包括患者基本信息、术前检查、病理结果、RAI 治疗信息及血清学信息;(2)第1 次行甲状腺切除术;(3)行甲状腺全切或近全切及中央区淋巴结清扫术,侧颈淋巴结术前确诊或可疑转移者,行加侧颈淋巴结清扫术;(4)均行BRAFV600E基因检测;(5)术后病理结果证实为PTC。排除标准:与纳入标准相反。
在所有PTC 患者中,选取接受过2 次RAI 治疗的患者86 例,其中男性28 例、女性58 例,年龄13~77(42.72±15.69)岁,同样分为突变组(57 例)和野生组(29 例)。纳入标准:2 次RAI 治疗前均TSH>30 IU/mL;停服左甲状腺素钠片并严格遵守低碘饮食3~4 周。排除标准:s-Tg 水平超过检测范围者;甲状腺球蛋白抗体(TgAb)水平超过正常范围者。
1.2 BRAFV600E 基因突变和血清s-Tg 水平的检测
从所有PTC 患者术前细针穿刺洗脱液或术后石蜡包埋肿瘤切片中分离出基因组DNA,按照DNA 分离试剂盒(德国Qiagen 公司)步骤进行DNA提取,采用北京雅康博生物科技有限公司生产的人BRAF 基因突变检测试剂盒[国食药监(准)字2014第3401045 号]进行PCR 扩增,然后使用反转录PCR 仪(美国安捷伦公司Stratagene Mx3000P 型)将含有特异性扩增片段的PCR 产物进行基因突变检测。
86 例PTC 患者在给予3.7×109~7.4×109Bq(100~200 mCi)的131I 口服液治疗前1 天均采用微粒子发光免疫分析法(美国贝克曼库尔特有限公司,DIX800)测定s-Tg 和甲状腺球蛋白抗体(TgAb)水平,其正常范围分别为1.15~130.77 ng/mL 和<4 IU/mL;检测范围分别为0~482 ng/mL 和0.9~2500 IU/mL。
1.3 统计学分析
使用SPSS22.0 软件进行统计学分析。计数资料的比较采用χ2检验;符合正态分布的计量资料用±s 表示,方差齐的数据采用两独立样本t 检验;不符合正态分布的资料采用Mann-Whitney U 秩和检验。采用配对t 检验评价s-Tg 水平与BRAFV600E突变之间的关系。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组PTC 患者临床资料的比较
由表1 可知,2647 例PTC 患者BRAFV600E基因突变率为84.2%(2230/2647);BRAFV600E基因突变与患者的年龄、淋巴结转移相关,突变组的平均年龄的比例高于野生组(P=0.022);突变组的淋巴结转移比例高于野生组(48.39%对41.97%,P=0.016)。但是,BRAFV600E突变组与野生组的性别、PTC 病灶长径间的差异均无统计学意义(P>0.05)。
2.2 RAI 治疗后PTC 患者s-Tg 的水平及变化趋势
由表2 可知,在接受2 次RAI 治疗的86 例PTC患者中,第1 次RAI 治疗前,2 组间s-Tg 水平差异无统计学意义;第2 次RAI 治疗前,BRAFV600E突变组的s-Tg 水平明显高于野生组(P=0.003)。与突变组相比,野生组2 次RAI 治疗后s-Tg 水平的差值(Δs-Tg)明显下降(P=0.006)。
3 讨论
BRAFV600E突变最常见的是发生在外显子15 上第1799 位核苷酸(T1799A)胸腺嘧啶和腺嘌呤的转换,导致位于第600 位氨基酸上缬氨酸与谷氨酸发生置换。BRAFV600E突变主要发生在PTC 和PTC衍生的未分化甲状腺癌中,不发生在甲状腺的正常组织及其他类型病理组织中,BRAFV600E基因可升高丝氨酸/苏氨酸蛋白激酶的活性,激活PTC 中丝裂原活化蛋白激酶信号(mitogen-activated protein kinase signaling,MAPK)通路,从而刺激肿瘤的发生[3]。有研究结果表明,发生BRAFV600E突变的PTC患者复发率较高,可预测有较差的临床预后[4,6]。2015 年BRAFV600E突变第1 次被纳入美国甲状腺协会(ATA)指南,用于评估患者风险分层和初始治疗后的复发风险[7]。本研究的BRAFV600E突变率达84.2%,高于国外一些研究结果[5-6],与国内王维娜等[8]报道的84.54%的突变率基本一致,差异可能与高碘饮食、地域及种族有关[9-10]。本研究结果显示,BRAFV600E突变组PTC 患者的年龄高于野生组,Huang 等[1]的相关研究同样证实了BRAFV600E突变更容易发生在老年患者中,Trovisco 等[5]的研究结果表明,突变组患者的平均年龄高于野生组,证实较年长的患者更容易发生BRAFV600E突变,从而刺激甲状腺恶性肿瘤的发生或是BRAFV600E突变本身进展较慢。
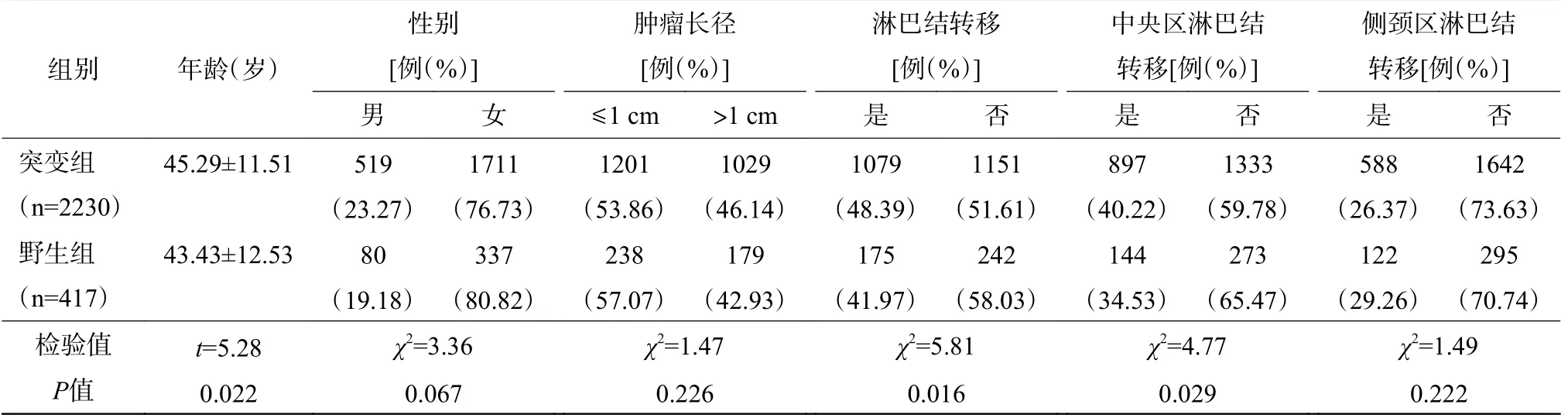
表1 2 组甲状腺乳头状癌患者临床资料的比较Table 1 Comparison of papillary thyroid cancer patients' clinical data between two groups

表2 2 组PTC 患者在首次RAI 治疗后s-Tg 水平及变化趋势的比较Table 2 Comparison of s-Tg level and change trend of papillary thyroid cancer patients after first radioactive iodine therapy between two groups
PTC 病灶残留和复发的主要原因是淋巴结转移[11]。本研究结果显示,BRAFV600E突变组的淋巴结转移率高于野生组,这表明BRAFV600E突变的PTC 患者更容易发生淋巴结转移。因此,我们重点分析BRAFV600E突变与淋巴结转移的关系。MAPK(RET/PTC→Ras→Raf→MEK→ERK)通路在PTC细胞的生长、增殖和血管生成等方面起关键作用,MAPK 通路的生理激活是由大量激素及细胞因子通过细胞上的受体触发的,而BRAFV600E突变可改变细胞的生物活性,最终刺激肿瘤发生[4]。核转录因子κB(nuclear factor-κB ,NF-κB)是可调节细胞凋亡及影响PTC 细胞的抗凋亡、侵袭特性的转录因子,因此NF-κB 通路的激活可促进肿瘤的侵袭和转移。研究结果发现,BRAFV600E激活NF-κB通路可能是直接发出信号的,具体可能的机制是BRAFV600E突变不仅能激活MAPK 通路还可激活NF-κB 信号通路,激活的NF-κB 可诱导PTC 中的抑癌基因金属蛋白酶(metalloproteinase,TIMP)在甲状腺细胞中的甲基化,破坏基底膜来促进肿瘤的侵袭和转移[12-14]。近年来有文献报道,BRAFV600E突变与miRNAs 的过表达相关[4],且在发生BRAFV600E突变的颈部淋巴结转移的PTC 患者中发现miR-221过表达[15],miR-221 可通过抑制TIMP 的表达促进肿瘤的侵袭及转移[16]。NF-κB 通路中的一种重要蛋白组成P65 亚单位,通过与miR-221 基因的远端增强子区域结合,可促进miR-221 的过表达[17]。因此,我们考虑BRAFV600E突变可能通过激活NF-κB通路中的P65 入核使miRNA 的表达失调,从而抑制TIMP 的表达、破坏基底膜,促进PTC 的临近侵袭,进而出现淋巴结转移。
碘化物通过甲状腺细胞膜上的钠/碘协同转运体(sodium/iodide symporter,NIS)转运到甲状腺滤泡中,在滤泡中,碘被甲状腺过氧化物酶氧化,并与甲状腺球蛋白(thyroglobulin, Tg)中的酪氨酸残基结合形成甲状腺激素。术后Tg 是一个可预测疾病持续发展或复发的独立因素,Tg 水平升高,疾病的复发风险随之增加[18]。在本研究中,我们从总样本中又筛选出接受2 次RAI 治疗的86 例PTC患者,分析其s-Tg 水平及变化趋势。结果表明第2 次RAI 治疗前,BRAFV600E突变组的s-Tg 水平(61.61 ng/mL)明显高于野生组(18.56 ng/mL),且与突变组相比,野生组的Δs-Tg 水平明显下降。这与杨珂等[19]报道的结果基本一致:在多次RAI 治疗后,突变组大多数患者(7/9)Tg 水平保持稳定,但远处转移灶不摄碘;而野生组多数患者(66.7%)转移灶摄碘且Tg 水平下降,显示BRAFV600E突变的患者在RAI 治疗后Tg 水平改善较差,且预后不良。RAI 治疗的有效性主要依赖于位于甲状腺细胞膜上的NIS,而在碘代谢过程中,BRAF 基因可以通过MAPK 通路阻断Tg 和NIS 的表达,并影响NIS 转录后膜的定位,且突变组中的Tg、甲状腺过氧化物酶、NIS 的mRNA 表达水平明显要低,导致其摄碘能力下降[20-21],RAI 治疗的效果下降。近年来相关文献报道,miR-146 在BRAFV600E突变的PTC 中表达水平明显增高,miR-146a-3p 可直接与NIS 结合并抑制NIS 的表达,进而抑制RAI 的吸收,且miR-146 的表达与Tg 水平和疾病发展、预后不良呈正相关,且在长期随访过程中miR-146表达水平高的患者总体生存率较低,对PTC 患者的预后有预测价值[22-24],BRAFV600E基因可能通过调控miRNA的过表达,破坏NIS 的摄碘能力,降低RAI 治疗的效果。这表明BRAFV600E突变的PTC患者摄碘能力较差,对RAI 治疗不敏感,临床预后较差,更容易复发和转移。在临床工作中可以在进行RAI 治疗前,对发生突变的患者进行评估,可以加大第1 次的治疗剂量或在随访过程中密切观察。
我们在分析BRAFV600E突变与PTC 患者淋巴结转移的关系中,纳入了大量的样本,因此数据具有较高的参考价值。但是,本研究中存在一些局限和不足:(1)有文献报道BRAFV600E突变除与淋巴结转移相关,还可能与腺外侵犯、多灶、肿瘤分期等侵袭性临床病理特征有关[4],然而本研究未将这些病理特征纳入;(2)Tg 水平变化还可受到手术方式、术后残余甲状腺体积、远处转移等因素的影响,本研究因条件限制未能进一步分析,未来有待丰富数据后做进一步研究;(3)有相关文献表明,BRAFV600E突变与淋巴结远处转移、RAI 疗效及长期患者预后有关[1,2,4,19],待将来扩充样本量和延长随访时间进一步观察。
综上,本研究结果显示BRAFV600E突变易在老年患者中发生,与PTC 淋巴结转移密切相关,且在初始治疗中有较差的临床预后。BRAFV600E突变为评估PTC 患者的疾病风险分层和预测RAI 的疗效提供了分子水平的参考依据,在未来,其与miRNAs结合可在PTC 患者的早期诊疗、预后及随访中发挥重要作用。

