一株野生抗铜大型真菌对铜离子的吸附作用
郑爱芳, 吴甘霖, 李伟娟, 张贵凤
(1. 安庆师范大学 生命科学学院,安庆 246133; 2. 安庆师范大学 水生生物保护与水生态修复安徽省高校工程技术研究中心, 安庆 246133)
重金属污染严重影响了人们的生活。铜离子是动物或植物生长的必需元素。人体铜元素缺乏会引发贫血,导致毛发、骨骼等发生异常,甚至引起脑障碍;但如过剩,会引起肝硬化、腹泻、呕吐、运动和知觉神经障碍[1]。土壤中铜的浓度过高时,植物会出现缺铁失绿症状[2],水体中铜浓度过高会导致蝌蚪死亡[3]。近年来,由于工业采矿、城市污水的排放和含铜杀菌剂的长期大量使用[4],周围水体含铜量迅速增加,远远超出了环境标准,铜污染逐渐引起了人们的重视。金属冶炼加工和电镀工厂所排废水含铜量最高,每升废水含铜几十到几百毫克,这些废水会导致周围土壤的污染,造成其中生长的植物重金属超标,如我国中药材中重金属铜的污染率高达16.09%[5]。水体中铜含量超过3 mg/L就会有异味,超过15 mg/L就不能作为饮用水[6]。
物理、化学法去除重金属离子成本比较高[7-8]容易造成二次污染[9],而生物法处理相对成本低,无二次污染[10],因而成为一种有前景的污水处理方式。生物法可以利用细菌的吸附,还原矿化等作用对水体和土壤中的重金属进行处理,用于吸附铜离子的细菌有Pseudomonasveronii[11]、Eichhorniaspp.[12]、Pseudomonassp.[13]、硫酸盐还原菌 (Sulfate-Reducing Bacteria,SRB)[14]、Providenciaalcalifaciens[15]等种属的细菌。
大型真菌对重金属离子的处理效果也较为明显,Sutherland[16]研究了FomesFasciatus对铜离子的去除效果。莫瑜[17]等研究了毛木耳和白木耳子实体对重金属离子的吸附,Akar等[18]研究了Ganodermacarnosum对铅离子的去除,Das 等[19]研究了Pleurotusplatypus对银离子的吸附,Mittal等[20]利用Fomitopsiscarnea阳离子染料导致的污染,目前利用大型真菌对Cu2+吸附作用研究的较少,本文旨在分离大型抗铜真菌来用以处理铜离子引起的水污染。
1 材料和方法
1.1 材料
菌株:2015年从安庆郊区朽木上采集的一株野生大型真菌,命名为LGBS菌株。主要仪器:PinAAcle 900T美国PE原子吸收光谱仪,显微镜;培养基(g/L):PDA培养基;重金属母液:浓度为2000 mg/L、20 000 mg/L的硫酸铜母液。
1.2 方法
1.2.1 野生大型真菌的分离
分离方法[21]:用75 %乙醇浸泡的酒精棉球对菌体表面消毒,然后将菌体用酒精灯灼烧表面,再用解剖刀切取黄豆大小的子实体,将其放置在PDA平板上,28 ℃恒温培养箱中避光培养1 ~3 d,用接种钩钩取无菌菌丝PDA斜面中培养,长满斜面后置于4 ℃冰箱保存。
1.2.2 菌株抗铜能力试验[22]
用无菌硫酸铜母液和无菌PDA培养基制备含有硫酸铜浓度分别为0、20、40、60、80、100、200、300、400、500和600 mg/L的固体平板。用打孔器在平板菌种的菌丝前端打取直径为6 mm的菌丝块,将有菌丝的一面朝下,置于上述含有不同铜离子浓度的PDA平板的中央,每个浓度做3个平行,将接菌的平板放在28 ℃避光的恒温培养箱中培养,待其中一个平板长满菌丝后停止培养,垂直方向测定菌落的直径,取两者的均值。
1.2.3 LGBS菌株在不同Cu2+平板生长后菌丝的显微观察
分别用解剖针挑取空白对照及生命明显受铜离子抑制后的菌丝用显微镜观察其菌丝形态,并拍照。
1.2.4 菌丝球的制备[23]
用打孔器在长满菌丝体的PDA平板上打取直径为6 mm的菌饼,接种至装有100 mL无菌马铃薯葡萄糖水液体培养基的250 mL三角瓶中,每个三角瓶中装有15个玻璃珠,每瓶接种10个菌饼,置于温度为28 ℃,转速为150 r/min的摇床上培养5 d,过滤收集菌丝球,并用去离子水冲洗3次,洗去有机培养液,用滤纸吸附明水,制成湿菌丝球,经试验湿菌丝球相当于干质量的二十分之一。
1.2.5 不同因素对菌丝铜离子吸附的影响
所有反应的溶液体积都为20 mL,每个实验做3个平行。分别吸附后用原子吸收光谱仪(美国AAS-900T)测定溶液的吸光度,计算金属离子吸附量和吸附率。为防止金属离子被吸附到器皿壁上,所有器皿均用20%的硝酸浸泡12 h左右。
金属离子吸附量和吸附率计算[24]:
q=V(c0-ce)/mr(%)=(c0-ce)/c0×100%
式中:q为吸附容量(单位:mg/g);r为吸附率;V为溶液体积(L);c0为对照浓度(mg/L);ce为剩余浓度(mg/L);m为投加吸附剂质量(g)。
1)菌丝球投加量对Cu2+吸附的影响(g)。菌丝球投加量为0.2、0.4、0.6、0.8和1.0,溶液pH 5,温度为25 ℃,振荡时间60 min,转速为150 r/min,初始铜离子浓度为20 mg/L。2)pH对Cu2+吸附的影响。调整溶液pH 为 3、4、5、6,振荡时间60 min,温度28 ℃,转速为150 r/min,初始铜离子浓度为20 mg/L,菌丝球投加量为0.5 g。3)温度对Cu2+吸附的影响(℃)。温度为15、20、28、30和35,溶液pH 5,振荡60 min,转速为150 r/min,初始铜离子浓度为20 mg/L,菌丝球投加量为0.5 g。4)时间对Cu2+吸附的影响(min)。时间为30、60、90、120,溶液pH 5,温度25 ℃,转速为150 r/min,菌丝球投加量为0.5 g,初始铜离子浓度为20 mg/L。5)转速对Cu2+吸附的影响(r/min)。转速为50、100、150、200和250,溶液pH 5,温度25 ℃,振荡60 min,菌丝球投加量为0.5 g,初始铜离子浓度为20 mg/L。6)初始Cu2+浓度对菌丝球吸附的影响(mg/L)。Cu2+浓度为20、40、60和80,溶液pH 5,温度25 ℃,振荡60 min,菌丝球投加量为0.5 g,转速为150 r/min。
1.2.6 具抗铜能力真菌基因组DNA的提取及鉴定
将低温保藏真菌菌种转接到PDA平板上, 28 ℃培养。长满平板后,由上海凌恩生物科技有限公司提取DNA并测序。测得的序列在 NCBI 网站上核酸数据库进行基因序列比对,以确定其种属。
2 结果与分析
2.1 抗铜菌株的筛选及其铜抗性分析
真菌LGBS在含Cu2+的PDA平板中生长情况如图1所示。从图1中可以看出,菌株LGBS随着Cu2+浓度的增加菌落大小呈递减趋势,具体菌落直径大小见表1。当Cu2+浓度为300 mg/L时,菌落开始显著变小;浓度为500 mg/L时,菌饼周围仅有约2 mm菌丝长出;而浓度为600 mg/L时,LGBS菌株完全被抑制。Cu2+浓度为0 mg/L时,平板上菌落背面颜色为白色,Cu2+浓度不断增加菌落背面颜色发黄,并且浓度越高菌落颜色相对也越深,在Cu2+浓度为400和500 mg/L的平板上能看到菌落周围有明显的透明圈,是Cu2+被吸附后形成的,说明该菌株具有吸附Cu2+的能力。
2.2 LGBS菌株在不同Cu2+平板生长后菌丝的显微观察
分别用解剖针挑取Cu2+浓度为0和300 mg/L PDA平板上的菌丝显微观察,菌丝在Cu2+浓度为0 mg/L时菌丝平滑,顺直,内含物也不多;而菌丝在Cu2+浓度为300 mg/L时,菌丝变粗,菌丝也发生扭曲变形,内含物增多,内部颜色发蓝,结合平板菌落的颜色,可能是在菌丝内部富集了Cu2+。

表1 LGBS菌株在含不同Cu2+浓度PDA平板上菌落直径(接种菌丝块为0.6 cm)
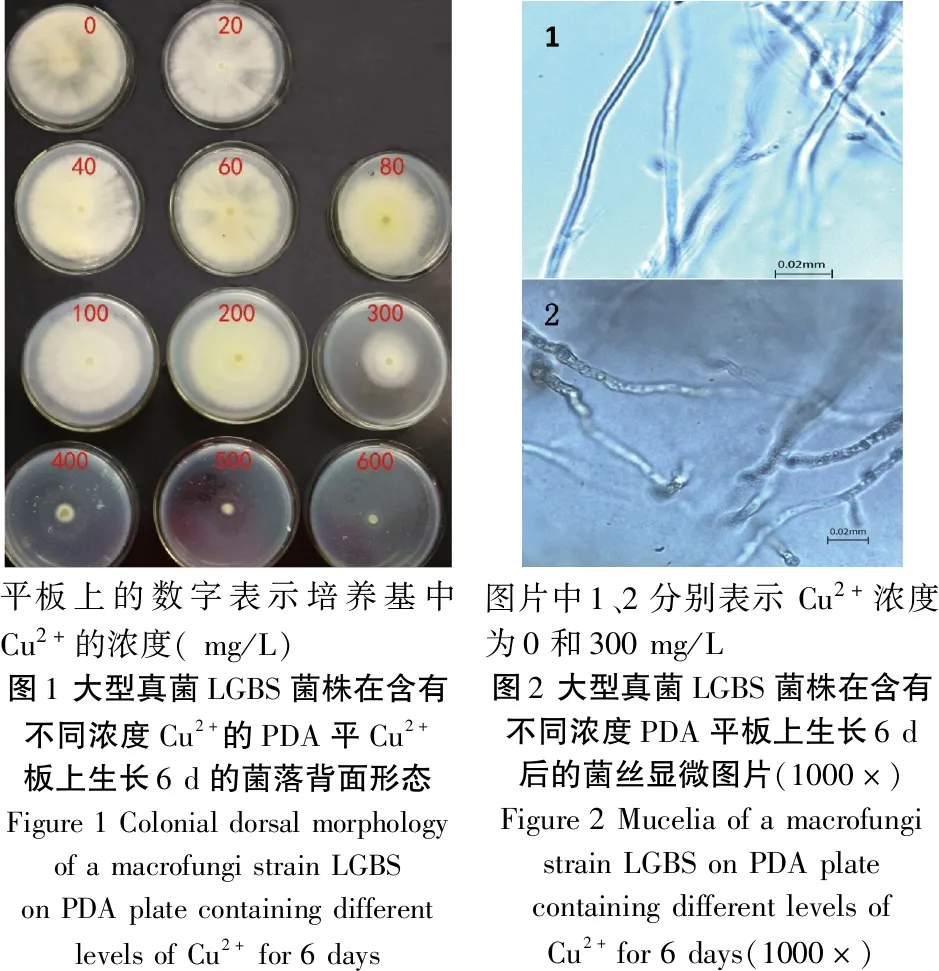
平板上的数字表示培养基中Cu2+的浓度(mg/L)图1大型真菌LGBS菌株在含有不同浓度Cu2+的PDA平Cu2+板上生长6d的菌落背面形态Figure1ColonialdorsalmorphologyofamacrofungistrainLGBSonPDAplatecontainingdifferentlevelsofCu2+for6days图片中1、2分别表示Cu2+浓度为0和300mg/L图2大型真菌LGBS菌株在含有不同浓度PDA平板上生长6d后的菌丝显微图片(1000×)Figure2MuceliaofamacrofungistrainLGBSonPDAplatecontainingdifferentlevelsofCu2+for6days(1000×)
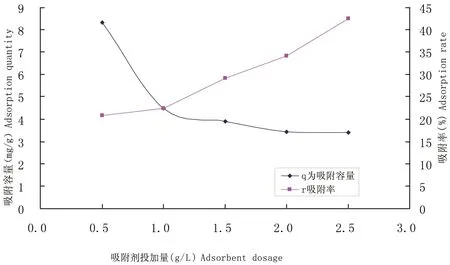
图3菌丝球投加量对Cu2+吸附的影响
Figure 3 Effects of different dosages of mycelial pellet on the adsorption rate and quantity of Cu2+
2.3 不同因素对菌丝铜离子吸附的影响
2.3.1 菌丝球投加量对Cu2+吸附的影响 在初始Cu2+浓度为20 mg/L时,当吸附剂从0.5达到2.5 g/L时,吸附率由20.8%上升到42.5%多。然而吸附容量却正好相反,呈递减的趋势,吸附容量由8.33 mg/g降至3.40 mg/g。导致这种现象的原因可能是当溶液中Cu2+浓度一定时,吸附剂越多,能够提供的吸附位点就越多,溶液中的Cu2+被大量吸附后,溶液中的Cu2+浓度自然降低,表现为吸附率提高。由于微生物细胞间有静电学效应,会影响吸附剂对离子的吸附[25],菌丝细胞间距离增大时,静电效应减弱,可以增加对离子的吸附量。当吸附剂大量增加后会竞争性吸附金属离子,导致吸附容量的降低,因此在溶液中的Cu2+与生物体比率提高时,生物体的吸收能力会相对增强。
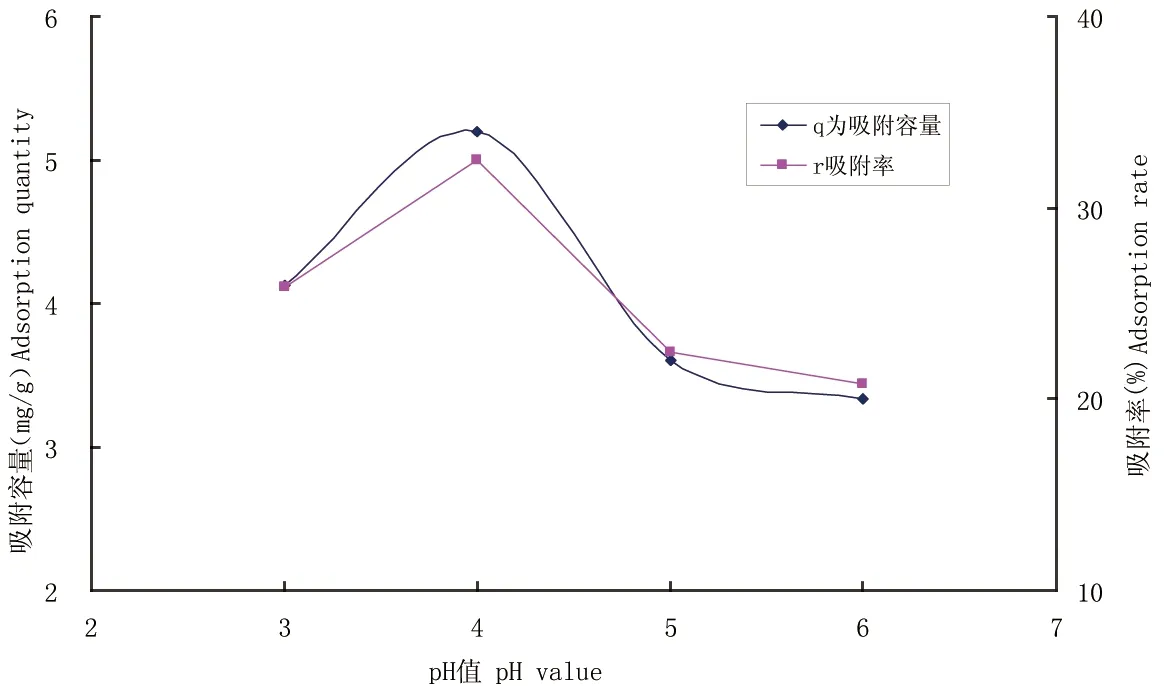
图4 不同pH值对Cu2+吸附的影响
2.3.2 pH值对Cu2+吸附的影响 很多实验结果表明,pH值是影响重金属吸附的一个重要因素[26]。重金属离子在不同的pH值溶液中的存在状态会发生变化,金属阳离子在酸性条件下容易呈离子状态,在碱性条件下易形成沉淀。本实验中Cu2+在pH 7时有絮状沉淀产生,为保证其离子状态,实验的最高pH 6。从图4中可以看出,pH值在3~6范围内,菌丝球对Cu2+的吸附容量及吸附率都呈现抛物线状,两个曲线基本平行,这是因为所有实验样品菌丝投加量都一致,所以吸附率和吸附容量呈正相关。pH 3 时,吸附容量为4.13 mg/g;pH 4时,吸附容量为最大,达到5.20 mg/g;pH 5时为3.61 mg/g,pH值越高吸附容量越低。这可能是因为pH 值不仅影响了Cu2+的存在状态,也会影响具有活性的菌丝细胞的表面电荷,而细胞表面的负电荷决定了对重金属阳离子的吸附能力[27],从而影响了菌丝的吸附效果。从多位学者报道的实验结果来看,金属阳离子在酸性条件下pH 3~5时易于被生物体吸附[28],如刘理等[29]研究一株微杆亚铁氧化菌Microbacteriumsp.W5对水中铜离子的吸附行为时发现:在pH值为5.0时,吸附剂对Cu2+离子的吸附量最大。本实验结果也得到同样的结论。
2.3.3 温度对Cu2+吸附的影响 从图5中可以看到,该菌在15 ℃条件下吸附效果较好,吸附容量为5.47 mg/g,当温度提高到20 ℃时吸附效果开始降低至2.23 mg/g左右,温度继续升高时,吸附率及容量变化不明显,差异不显著。
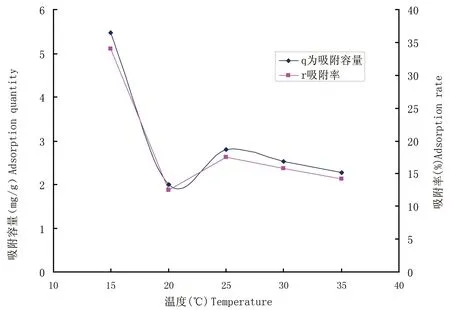
图5 温度对Cu2+ 吸附的影响
2.3.4 时间对Cu2+吸附的影响 图6 的结果显示,吸附时间开始30 min到60 min吸附容量由2.27 mg/g上升到 3.3 mg/g,随着时间的延长略有降低,降低不明显。开始短时间内,吸附剂没有达到最大吸附量,随着时间的增加,吸附不断达到饱和,趋于稳定。
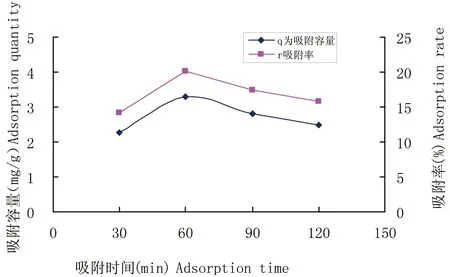
图6 吸附时间对Cu2+吸附的影响(min)
2.3.5 转速对Cu2+吸附的影响 当溶液处于静止状态时,菌丝的吸附容量较低(图7),为2.26 mg/g,转速为50 r/min时最高,为5.73 mg/g,随着转速的进一步提高,吸附容量略有降低,趋于稳定。这是因为金属离子被生物体的吸附时,溶液的界面与菌丝球表面间的滞流层存在传质阻力[30]。当溶液处于静止状态时阻力大,金属离子不易与菌丝球的吸附位点有效结合,不能被牢固的吸附。随着转速增加吸附速率将随之提高,并趋于不变,但转速过高时,会增加成本另外效果并不理想,同时造成液体飞溅,影响吸附的效果。
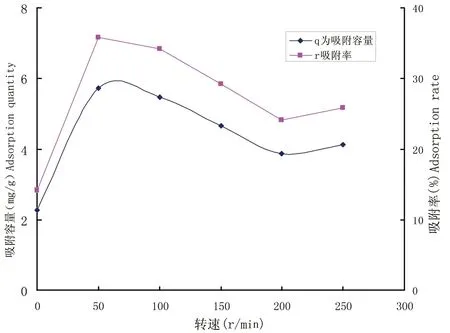
图7 转速对Cu2+吸附的影响(r/min)
2.3.6 初始Cu2+浓度对菌丝球吸附Cu2+的影响 图8显示随着初始Cu2+浓度的增加,菌体对Cu2+的吸附容量不断提高,当Cu2+为20 mg/L时,吸附容量为3.87 mg /L,当Cu2+浓度提高到80 mg/L时,吸附容量增至17.21 mg/L。Cu2+为40 mg/L时吸附率最大为27%,Cu2+浓度增加后吸附率降低至18.54%,因为吸附剂相同时,结合位点没有达到饱和时,离子浓度越大吸附的离子越多,自然吸附容量越高。在吸附剂投加量相同的情况下,初始离子浓度越高,吸附剂的吸附量越高[29];当位点趋于饱和时,吸附容量将达到稳定状态,溶液中离子浓度越高,吸附后剩余的金属离子浓度就越大,因而吸附率会逐渐降低。

图8 不同初始Cu2+浓度对吸附的影响
2.4 具抗铜能力真菌的鉴定 用真菌通用引物ITS1F 和ITS4R引物对大型真菌LGBS菌株进行PCR 扩增后,琼脂糖凝胶电泳后发现该菌株的PCR产物条带位于600~700 bp之间(图9)。经过上海凌恩生物科技有限公司测序后知道该ITS 序列为679 bp,将该序列提交到GenBank (Accession No:KY889146)。Blast 比对结果显示,菌株LGBS与GenBank 中Irpexlacteus( KX588111.1, KX588108.1, JX311924.1, FJ462768.1, EU301643.1, KX588107.1) 等40余个菌株的ITS 序列覆盖度在100%, 相似性达到99%,根据此分子生物学特性,将其初步鉴定为Irpexlacteus,即白耙齿菌。
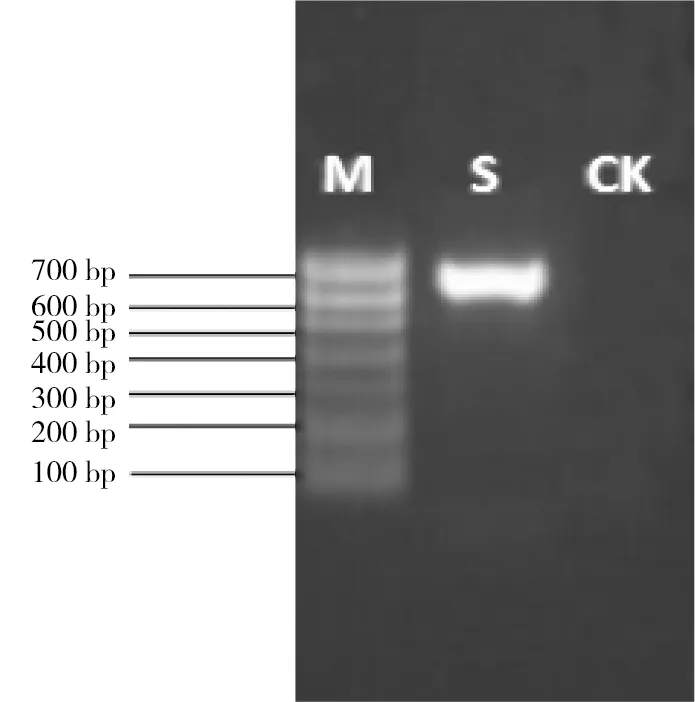
M:marker;S:菌株LGBS;CK:阴性对照
图9真菌ITSrDNAPCR产物鉴定结果
Figure 9 PCR products of Fungus ITS rDNA PCR
3 讨论
目前研究人员在利用细菌处理铜离子污染方面取得了较好地处理效果。Vullo等[11]利用Pseudomonasveronii2E去除铜离子,去除率达到40%,Andreazza等[13]研究发现Pseudomonassp. NA通过生物吸附和还原作用在初始浓度为300 mg/L时,能处理掉110 mg/L的铜离子。王国倩[14]研究了一株硫酸盐还原菌(Sulfate-Reducing Bacteria,SRB)电路板废水中铜的吸附作用。李兰松等[15]研究发现Providenciaalcalifaciens对Cu2+最高吸附率达85.84%,李哲等[31]利用株碳酸盐矿化菌Achromobacterxylosoxidans菌体通过细胞吸附、生物矿化和化学沉淀对溶液中 Cu2+的去除率为93%。
在利用真菌处理铜离子引起的水体污染方面的研究较少。Sutherland和Venkobachar[16]研究了FomesFasciatus对铜的去除率达到17.5%;莫瑜[17]等实验结果显示毛木耳和白木耳子实体对铜离子的吸附量分别为18.69和20.15 mg/g;张丹等[24]利用毛木耳冻干菌丝体对铜离子进行吸附研究,吸附值在2 mg/g左右。本研究中利用的野生白耙齿菌对铜离子的吸附容量最高可以达到17.21 mg/g,吸附力相对较强,另外白耙齿菌在脱色方面也有重要的应用[32],说明该菌不仅在处理金属方面,在其他水体环境污染中也有重要的研究前景。在后续实验中,将进一步优化该菌株处理Cu2+的条件,研究对其他重金属如镉、铬以及染料等环境污染物的处理效果,以期能够应用到实际污水处理中。
4 结论
1)在铜离子浓度为200 mg/L时,菌株LGBS受到抑制,当超过铜离子浓度≥300 mg/L时,菌株生长受到明显抑制,菌落直径相对对照组减小了约50%;超过600 mg/L时生长基本停止,菌株的最高耐铜浓度为500 mg/L 。2)菌丝球的投加量增加对铜离子的吸附容量呈递减趋势,当吸附剂从0.5达到2.5 g/L时,吸附容量由8.33 mg/g降至3.40 mg/g,吸附率由20.8%上升到42.5%多,吸附率不断增加;在初始Cu2+浓度为20 mg/L时,吸附剂为0.5 g/L时吸附容量为8.33 mg/g;在pH 4时,菌体的吸附容量最高;温度为15℃ 时吸附效果最好,温度增加,吸附率略有下降,继续升高温度,对吸附的效果影响不大;转速为50 r/min时,吸附效果较好,静置或增加转速之后不能提高吸附效果。初始本实验中Cu2+浓度80 mg/L时,吸附容量可达17.21 mg/g;吸附时间为60 min较好,增加时间不能增强吸附效率。3)本研究筛选的野生大型真菌初步鉴定为白耙齿菌。

