自体骨软骨移植联合富血小板血浆对兔膝关节骨软骨缺损的修复作用及机制*
熊隆江 李思云 黄晓蓬 刘华江
江西省中西医结合医院骨科,江西省南昌市 330003
关节软骨缺损是临床常见就诊病症,可引起患者疼痛不适和关节功能障碍,最终导致退行性骨关节炎[1]。由于软骨组织缺乏血管、软骨细胞再生能力差,较大的软骨缺损几乎不可能自我愈合,因此手术干预成为治疗关节软骨缺损的重要手段。目前临床上常用的手术有软骨成形术、软骨下钻孔术、微骨折术和骨软骨移植术,而对于全层软骨缺损或小面积胫骨间室软骨缺损,自体骨软骨移植可以短期内缓解疼痛、恢复关节功能,故成为临床上首选的治疗手段,但自体骨软骨移植存在软骨来源有限、供区继发病变等缺点[2]。近年来,生物学疗法治疗关节软骨缺损的价值引起了广泛关注。富血小板血浆(Platelet-rich plasma,PRP)作为多种活性因子的载体,可以促进关节骨软骨缺损的修复,促进周围正常软骨整合,延迟骨关节炎的发生[3]。研究显示[4-5],氧化应激所产生的自由基可导致软骨细胞凋亡和细胞外基质降解,与关节软骨损伤关系密切。PRP促进关节软骨修复是否与氧化应激有关,既往鲜有报道。本研究旨在探讨自体骨软骨移植联合PRP对兔膝关节骨软骨缺损的修复作用及对氧化应激的影响。
1 材料与方法
1.1 实验动物 40只SPF级新西兰大白兔由南昌大学实验动物中心提供,3~5月龄,雌雄各半,体重1.8~2.2kg。
1.2 方法
1.2.1 兔自体PRP制备:从兔耳耳根方向进针,刺入兔耳中心静脉,抽取5ml动脉血置于EDTA管中,做好标记。采用二次离心法制备PRP。第1次离心转速2 000转/min,离心10min,离心后将下层红细胞吸除,剩余部分再次离心,转速2 000转/min,离心10min,将血清层上方3/4部分吸除,剩余部分即为PRP。
1.2.2 动物模型制作:随机将兔分为对照组、模型组、移植组、PRP组和联合组,每组8只。用25%乌拉坦(4ml/kg)进行麻醉,固定后用2%利多卡因进行膝关节局部麻醉。分离后腿膝关节皮下组织,从髌骨内侧入路切开关节囊,在膝关节伸直位时将髌骨推至脱位,将膝关节屈曲,暴露股骨内侧髁。于股骨内侧髁建立全层软骨缺损模型,用骨科电钻钻出直径4mm、深度3mm的孔洞。清理缺损部位的组织碎屑和血块后,在股骨髁非负重区取相应直径及深度的骨软骨块用于移植。对照组为健康兔,不做任何干预;模型组单纯建立骨软骨缺损模型;移植组将自体骨软骨植入缺损处;PRP组用生理盐水冲洗关节腔,将单纯富血小板血浆植入软骨缺损处;联合组将PRP与自体骨软骨复合体植入缺损处。兔干预后给予庆大霉素4万U/d,连续3d,预防感染。
1.3 观察指标
1.3.1 组织病理学观察[6]:干预8周后,用空气栓塞法处死所有兔子,解剖出完整的膝关节,用4%甲醛固定24h,随后用EDTA进行脱钙处理,5周后对标本进行脱水、包埋、切片。检测时常规脱蜡,用PBS清洗切片,进行苏木精/伊红(HE)染色,随后用中性树脂封片,MODEL CX41RF显微镜下观察。根据国际软骨修复学会(ICRS)组织学分级评分法评定并量化修复效果。
1.3.2 氧化应激指标检测:干预8周后,从髌骨内缘做纵行切口,分离关节囊,在关节液最集中部位用手术刀划开关节囊,注入1.5ml生理盐水,反复抽吸后抽出关节液。4℃15 000转/min离心15min,取上清液。采用酶联免疫吸附试验(ELISA)法检测上清液中谷胱甘肽(GSH)、丙二醛(MDA)、超氧化物歧化酶(SOD)和8-羟基脱氧鸟苷(8-OHdG)含量。

2 结果
2.1 组织病理学观察 HE染色结果显示,模型组的修复组织由一层非软骨组织组成,缺损凹凸不平、关节面变形。移植组和PRP组均发现新形成的软骨组织,新生的组织与周围软骨之间有明显间隙。移植组缺损区中可见修复组织,表现为透明/纤维软骨特征,另外可见许多活细胞呈簇状分布。PRP组可见更多的纤维软骨,细胞分布紊乱。联合组可见相对平滑的透明样软骨,软骨细胞柱状排列,骨软骨缺陷中填充的再生组织与正常透明软骨和软骨下骨整合,见图1。
2.2 病理学评分 ICRS组织学分级评分如表1显示,可见移植组、PRP组和联合组的骨表面、软骨矿化、基质和细胞分布评分均高于模型组(P<0.05),而细胞群和软骨下骨的评分差异无统计学意义(P>0.05),且联合组软骨矿化、基质和细胞分布分级评分均高于移植组和PRP组(P<0.05)。
2.3 各组氧化应激指标比较 与对照组比,模型组关节液中GSH和SOD水平明显降低,而MDA和8-OHdG明显升高(P<0.05)。移植8周后,移植组上述指标均未见明显改善(P>0.05),而PRP组和联合组各指标均明显改善(P<0.05)。PRP组关节液中GSH和SOD水平明显高于移植组,而MDA和8-OHdG水平低于移植组(P<0.05)。联合组MDA水平明显低于PRP组(P<0.05),见表2。
3 讨论
骨软骨移植术是治疗软骨缺损的重要方法,但是该手术只能修复小范围的软骨损伤[7]。组织再生及修复时需要多种细胞因子参与,因此植入软骨的同时若能加入生长因子,势必会促进骨愈合。但是目前市面上现有生长因子的种类均比较单一且价格昂贵,修复组织的效果也不甚理想[8]。PRP是经过自体血获取的血小板浓聚物,其含有的血小板数量是全血的3倍以上,血小板激活后可释放多种生长因子,促进细胞有丝分裂和组织损伤愈合[9]。本课题组前期研究发现,PRP可促进移植的自体软骨新生,并促进其与周围骨质的紧密结合,进而提高自体骨软骨移植的疗效[10]。本研究同样显示,联合组修复软骨缺损的效果优于单独自体骨软骨移植。
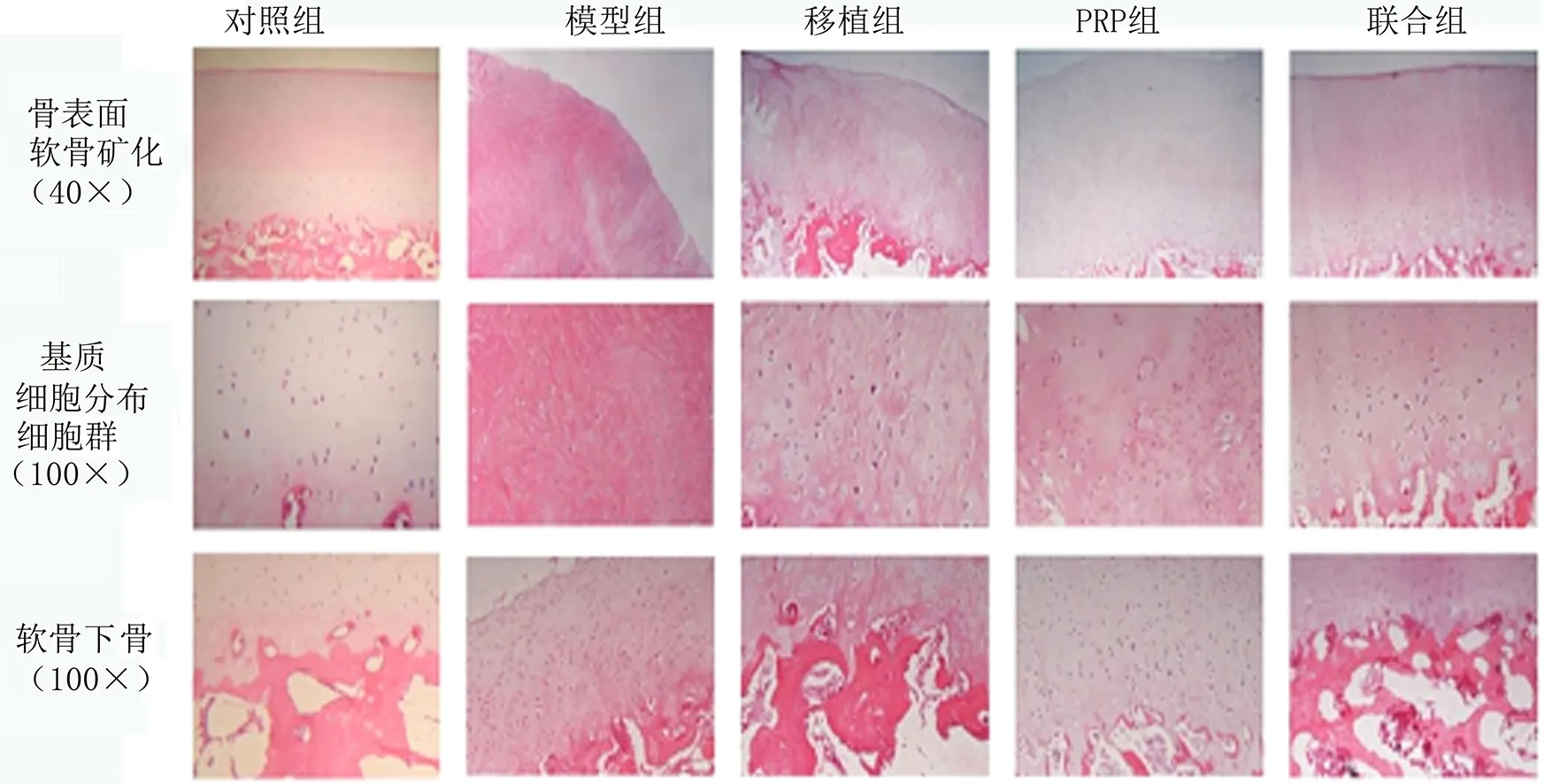
图1 移植后8周用HE染色法观察再生软骨的组织学表现

表1 四组ICRS组织学分级评分比较
注:与模型组比,①P<0.05;与移植组比,②P<0.05;与PRP组比,③P<0.05。

表2 不同组关节液中氧化应激指标比较
注:与对照组比,①P<0.05;与模型组比,②P<0.05;与移植组比,③P<0.05;与PRP组比,④P<0.05。
PRP促进骨缺损修复的机制主要包含以下3个方面:(1)血小板活化后分泌血小板活化因子,进而促进白细胞介素-1、白细胞介素-6和肿瘤坏死因子-α等炎症因子的释放,这些细胞因子在启动骨修复、刺激血管生成方面有重要作用[11]。(2)在凝血酶和钙离子诱导下,或者创伤环境中,PRP中的血小板可以释放α-颗粒,内含血小板衍化生长因子、转化生长因子-β、上皮细胞生长因子和胰岛素样生长因子等物质,引起一系列细胞内信号转导,促进软骨细胞增殖、分化和骨基质形成[3]。(3)PRP中富含血管生长因子,利于局部血管生长,特别是在无细胞的人工骨移植的血管生成中。另外血管生长因子还有助于成骨细胞聚集和骨化[12]。
氧化应激是指机体遭受有害刺激时,体内高活性分子产生过多,氧化程度超过氧化物清除能力,机体氧化系统和抗氧化系统失衡,进而造成组织损伤[10]。关节软骨损伤与氧化应激密切相关,而PRP与氧化应激损伤的关系少有报道。有研究发现,血小板释放的生长因子可以促进细胞增殖,并激活抗氧化反应元件[12]。本研究发现,PRP组和联合组干预8周后,GSH和SOD水平明显升高,而MDA和8-OHdG水平明显下降,移植组干预前后氧化应激指标水平未见明显变化,说明PRP可能通过改善氧化应激而促进软骨修复,进而提高自体骨软骨移植的疗效。
综上所述,PRP能够明显改善关节氧化应激损伤,可有效促进关节软骨修复,有助于提高自体骨软骨移植的疗效。本研究的局限性为:(1)仅检测了关节液中氧化应激指标的变化,未检测血液中相关指标的变化。(2)未从分子信号通路方面对氧化应激损伤进行评价,未来需要进一步深入研究。

