春、夏季秦皇岛海域超微型浮游植物
赵相伟,魏玉秋,孙军,张桂成,赵亮,贾岱
( 1. 山东大学 海洋研究院,山东 青岛 266237;2. 天津科技大学 天津市海洋资源与化学重点实验室,天津 300457;3. 天津科技大学 印度洋生态系统研究中心,天津 300457)
1 引言
自发现聚球藻(Synechococcus)[1]、原绿球藻(Prochlorococcus)[2]和超微型真核藻类(picoeukaryotes)以来,海洋超微型浮游植物(<3 μm)一直是海洋科学研究的一个热点领域。在热带和亚热带寡营养海域,较大的浮游植物由于受到营养盐的限制不适合生长,而聚球藻和原绿球藻的生物量和生产力却很高,它们对浮游植物总生物量贡献可达60%~80%[3–4]。聚球藻与原绿球藻广泛分布在热带和亚热带的寡营养盐水域,而原绿球藻在外海的丰度通常是聚球藻的10 倍甚至更多[5]。特别是聚球藻与超微型真核藻,它们可以在不同的环境中生存,从热带、亚热带、温带甚至到寒冷的极地海域均能发现它们的存在[6]。超微型真核藻虽然丰度相对较低,但在超微型浮游植物初级生产中占很大一部分比重[7]。根据相对应的碳转换系数,超微型真核藻产生的碳生物量比聚球藻和原绿球藻更多[8–9]。秦皇岛地处北渤海的温带海域,平均水深25 m 左右,是辽东湾与渤海中部及渤海湾进行物质和能量交换的重要通道。秦皇岛沿岸有石河、戴河、新河和新开河等河流入海口,这些陆源水都携带了大量的人为污染物,导致入海河口富营养化严重,因此,该海域的生态环境所承受的污染压力也日益增加。从2009 年起,秦皇岛海域每年从6 月份开始均会发生由超微型藻类导致的“褐潮”[10–12]。褐潮暴发期间,水体中细胞密度极高,对附近海域的养殖业和滨海旅游业造成了极大的影响[13]。目前,对秦皇岛褐潮期间浮游植物群落的研究大都针对微型浮游植物(>3 μm),但对超微型浮游植物方面的研究却很少[14]。我国对超微型浮游植物的研究最早始于聚球藻,宁修仁和沃洛D[15]利用荧光显微镜和流式细胞术两种方法对长江口及冲淡水域的聚球藻细胞密度分布、细胞特征及其与环境要素的关系进行了相关研究,结果表明夏季聚球藻细胞密度要比冬季高1~2 个数量级。光照和营养盐是控制聚球藻细胞生长和分布的主要环境因子;杨燕辉和焦念志[16]利用流式细胞仪对胶州湾超微型浮游植物的群落分布和动态变化进行了研究,结果发现胶州湾的超微型浮游植物主要由聚球藻和超微型真核藻组成,其叶绿素生物量占胶州湾海域总叶绿素生物量的20%以上,在该海域生态系统中占有重要地位。魏玉秋等[17]采用流式细胞仪对受珠江口影响的南海北部超微型浮游植物进行了调查研究,结果表明3 类超微型浮游植物(聚球藻、原绿球藻、超微型真核藻)的细胞丰度均呈现近海低而外海高的分布趋势。
本研究通过流式细胞分析技术,对秦皇岛海域褐潮高发期的超微型浮游植物进行现场观测研究,并对其细胞丰度、碳生物量以及分布特点进行了对比研究,揭示了秦皇岛海域褐潮高发期超微型浮游植物分布及相关环境因子影响,以期更好地了解该时期浮游植物群落的变化,为认识褐潮对秦皇岛海域生态系统的影响提供基础资料,并为当地生态经济的可持续发展提供理论依据。
2 材料与方法
2.1 研究海域与采样站位
于2017 年6 月和8 月在秦皇岛海域(39.4°~39.8°N,119°~121°E)进行了2 个航次的现场采样及样品处理。航次共设1 条调查断面,该断面设6 个采样站位(图1)。水样由CTD 的Niskinc 采水器采集,各个站位根据水深的不同设置2~5 个采水层。每层采取水样2 mL,暗适应静置10~15 min,现场应用便携式流式细胞仪(BD AccuII C6)直接进行测定。温度、盐度、深度等理化参数同时用CTD 测量。
营养盐样品采集之后,立即用0.45 um 的醋酸纤维素膜过滤,然后放到−20℃温度条件下进行保存,用于硝酸盐、亚硝酸盐、硅酸盐和磷酸盐的测定。营养盐的分析采用德国Bran+Luebbe 公司生产的AA3 自动分析仪。硝酸盐的测定采用铜镉柱还原法,亚硝酸盐的分析采用萘乙二胺分光光度法,硅酸盐和磷酸盐的测定分别采用硅钼蓝分光光度法与磷钼蓝分光光度法[18–19]。
2.2 海洋超微型浮游植物类群分析
根据浮游植物的自发荧光特性,流式细胞仪可以有效地对超微型浮游植物进行检测和分类[20]。在BD Accuri C6 波长488 nm 的绿色激发光激发下,聚球藻中含有的藻红素和叶绿素可在560~590 nm 和 685nm处分别激发出橙色荧光(FL2)与 红色荧光(FL3)。原绿球藻和超微型真核藻类中仅含叶绿素,只能发出红色荧光, 从而区分出可以发射橙色荧光的聚球藻[21]。同时利用前向散射光(FSC)表征细胞大小的特性区分出原绿球藻与超微型真核藻类群[22],细胞颗粒较小、叶绿素信号较弱的是原绿球藻,细胞颗粒大、叶绿素含量信号相对较强的是超微型真核藻[23]。本次研究发现秦皇岛海域超微型浮游植物主要由聚球藻和超微型真核藻组成,由于受到温度的限制,并没有发现原绿球藻[24]。另外,我们根据FSC 和FL2 将聚球藻又分为聚球藻Ⅰ和聚球藻Ⅱ两个亚群(图2),其中聚球藻Ⅰ由FSC 表征的细胞相对较大,而聚球藻Ⅱ细胞相对较小。
图 1 采样区域和站位Fig. 1 Sampling area and stations
2.3 超微型浮游植物碳含量估算
目前超微型浮游植物的生物量通常按照各类群的碳转换系数来估算。但是对于不同海域,不同的超微型浮游植物类群碳转换系数会存在很大差异。本研究采用国际上常用的超微型浮游植物碳转换系数,聚球藻为250 fg /个(以碳计),超微型真核藻为2 100 fg /个(以碳计)。
3 结果
3.1 调查海区水文特征
3.1.1 温度、盐度参数
在6 月份,调查海域水温介于14.81~24.74℃之间,平均值为(18.66±0.31)℃。在8 月份调查该海域水温介于20.57~28.43℃之间,温度平均值为(24.7±0.28)℃。由于8 月份太阳辐射增强,温度升高,调查海域水温总体高于6 月份。调查海域水体的温度在A2、A3 站位垂直分布上较为均匀,分别高于20℃和26℃,A4、A5 的水温则从表层到底层呈现出明显的下降趋势,6 月份从22.3℃下降到14.8℃,8 月份从27.4℃下降到20.5℃。在6 月份和8 月份,调查海域水体表层温度高,没有明显的层化现象。
在6 月份,调查海域盐度介于31.73~32.52 之间,平均值为(3 2.0 9±0.0 1)。在8 月份,盐度介于30.56~32.34 之间,平均值为(31.56±0.03)。受河口冲淡水影响,距离河口较近的站位,盐度比较低。但是在7 m 以下的水层,盐度垂直方向上的变化不大。在6 月份,该海域可能受降水、蒸发等过程的影响,水体表层盐度变化规律性较差。
3.1.2 营养盐参数
调查海域6 月份硝酸盐的浓度介于1.14~1.68 μmol/L之间,平均浓度为(1.41±0.04) μmol/L。硝酸盐的浓度呈现由河口到近岸明显增加的趋势。在8 月份,硝酸盐的浓度介于1.91~4.87 μmol/L 之间,平均浓度为(2.69±0.19) μmol/L,硝酸盐主要分布在底层,A3 站位的底层出现一个浓度高值区。
调查海域6 月份亚硝酸盐浓度介于0.04~0.16 μmol/L之间,平均浓度为(0.08±0.01) μmol/L。除河口A1 站位外,亚硝酸主要分布在水体底层,浓度高值区出现在A6 站位底层。在8 月份,亚硝酸盐浓度介于0.04~1.72 μmol/L 之间,平均浓度为(0.28±0.09) μmol/L,亚硝酸盐的浓度在表层较低,在A3 和A6 站位的底层亚硝酸盐浓度相对较高。
调查海域6 月份硅酸盐浓度介于1.44~11.37 μmol/L之间,平均浓度为(6.09±0.61) μmol/L。除河口A1 和A2站位外,硅酸盐主要分布在水体底层,A6 站位底层出现明显的浓度高值区。在8 月份,硅酸盐浓度介于2.92~38.41 μmol/L 之间,平均浓度为(18.66±2.45) μmol/L。硅酸盐浓度的高值区出现在A1 站位。除A1 站位外,硅酸盐浓度在底层相对较高且分布均匀。
调查海域6 月份磷酸盐浓度介于0.01~0.19 μmol/L之间,平均浓度为(0.07±0.01) μmol/L。磷酸盐的浓度在表层较低,高值区主要分布在A2 和A6 站位的水体底层。在8 月份,磷酸盐浓度介于0.01~0.44 μmol/L之间,平均浓度为(0.16±0.04) μmol/L。磷酸盐的浓度在表层较低,主要分布在底层且分布均匀,而且具有明显的层化现象。
调查海域6 月份铵盐浓度介于0.16~1.52 μmol/L之间,平均浓度为(0.70±0.07) μmol/L。铵盐在河口A1 至A3 站位浓度较低,浓度高值区出现在A6 站位的底层(趋势+高值区)。在8 月份,铵盐浓度介于0.05~1.18 μmol/L 之间,平均浓度为(0.23±0.05) μmol/L。铵盐浓度在表层较低,但是在A2 站位的底层明显高于邻近水域。
两个月份对比可得,8 月份硝酸盐、亚硝酸盐以及硅酸盐的浓度相对于6 月份均有所提高。其中硅酸盐和亚硝酸盐浓度最为明显,其浓度在8 月份是6 月份的3 倍以上。虽然磷酸盐和铵盐浓度在8 月份也有升高,但变化幅度不明显。
3.2 超微型浮游植物分布特征
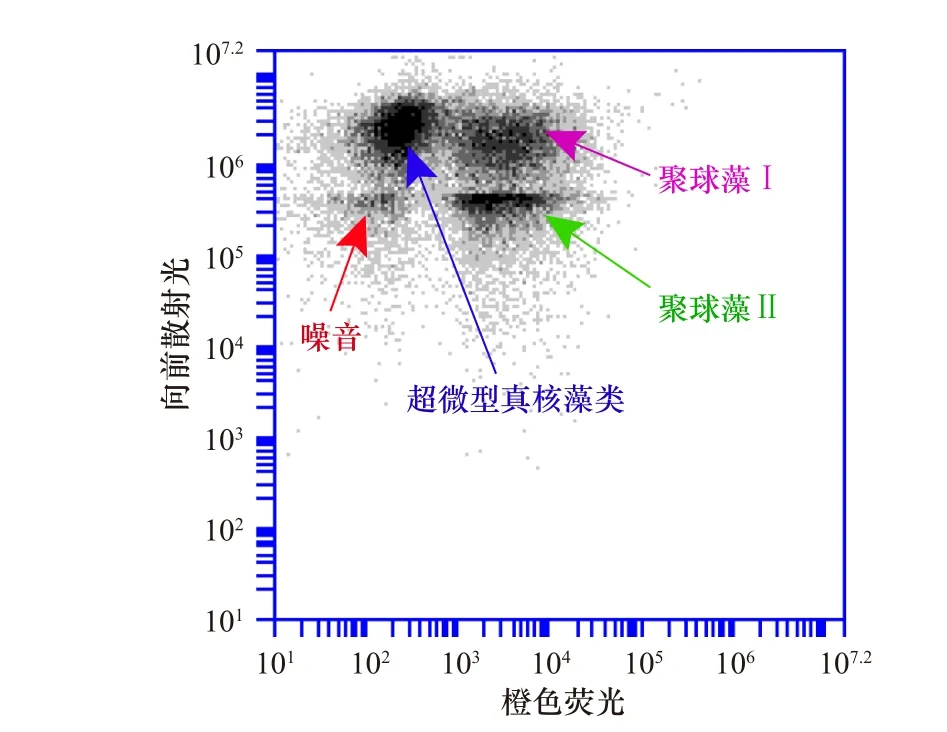
图 2 调查区域水样流式细胞仪分析图Fig. 2 FCM analysis of water samples collected from the survey area
调查海域6 月份超微型真核藻细胞丰度介于3.03×103~5.33×104个/mL 之间,平均细胞丰度为(1.14±0.23)×104个/mL,水柱积分细胞丰度变化范围在5.92×103~3.22×104个/mL 之间,平均值为(1.30±0.38)×104个/mL,碳生物量均值则为(23.88±1.29) μg/L。在6 月份,调查海域超微型真核藻细胞丰度与碳生物量及其百分比呈现出明显的由河口向近岸逐渐降低的分布趋势。在8 月份,超微型真核藻细胞丰度介于2.38×102~1.32×104个/mL 之间,平均细胞丰度为(3.27±0.58)×103个/mL。水柱积分细胞丰度变化范围在1.69×103~4.28×103个/mL,平均值为(3.03±0.35)×103个/mL,碳生物量均值则为(6.35±0.73) μg/L。调查海域8 月份超微型真核藻细胞丰度与碳生物量及其百分比由河口到近岸变化不大,细胞丰度的数量级基本在1×103个/mL(图3,表1)。
调查海域6 月份聚球藻Ⅰ细胞丰度介于2.72×103~1.12×105个/mL 之间,平均细胞丰度为(4.02±0.13)×104个/mL,水柱积分细胞丰度变化范围在8.70×103~7.48×104个/mL 之间,平均值为(3.40±0.82)×104个/mL,碳生物量平均值为(8.49±1.34) μg/L。在6 月份,调查海域聚球藻Ⅰ细胞丰度与碳生物量及其百分比呈现由河口向近岸逐渐增加的分布趋势。在8 月份,聚球藻Ⅰ细胞丰度介于4.01×103~2.45×105个/mL 之间,平均细胞丰度为(5.79±0.88)×104个/mL。水柱积分细胞丰度变化范围在2.22×104~7.79×104个/mL 之间,平均值为(5.36±0.73)×104个/mL,碳生物量平均值为(13.41±1.21) μg/L。在8 月份,聚球藻Ⅰ细胞丰度整体较高,而A6 站位丰度相对较低,聚球藻Ⅰ整体的碳生物量百分比变化不大(图3,表1)。
调查海域6 月份聚球藻Ⅱ细胞丰度介于3.95×102~2.80×104个/mL 之间,平均细胞丰度为(1.04±0.12)×104个/mL,水柱积分细胞丰度变化在1.41×103~2.12×104个/mL 之间,平均值为(9.07±0.91)×103个/mL,碳生物量平均值为(2.27±0.60) μg/L。在6 月份,聚球藻Ⅱ细胞丰度与碳生物量百分比整体分布较低,呈现出由河口向近岸逐渐增加的趋势,近岸细胞丰度比河口高了一个数量级。在8 月份,聚球藻Ⅱ细胞丰度介于1.38×103~7.55×104个/mL 之间,平均细胞丰度为(2.58±0.37)×104个/mL,水柱积分细胞丰度变化在1.46×104~3.46×104个/mL 之间,平均值为(2.33±0.28)×104个/mL,碳生物量平均值为(5.83±0.71) μg/L。在8 月份,各站位聚球藻Ⅱ细胞丰度与碳生物量及其百分比变化不大(图3,表1)。
对比可得,6 月份的超微型真核藻细胞丰度明显高于8 月份,大约相差一个数量级。在8 月份,聚球藻Ⅰ和聚球藻Ⅱ细胞丰度相对于6 月份明显提升。总之,在6 月份,超微型真核藻、聚球藻Ⅰ和聚球藻Ⅱ的细胞丰度和碳生物量及其百分比具有明显的分布趋势。但是在8 月份,超微型真核藻和聚球藻Ⅱ细胞丰度和碳生物量及其百分比分布趋势不明显且分布比较均匀,聚球藻Ⅰ细胞丰度与碳生物量在A4 和A5 站位较高,但其碳生物量百分比变化不明显。

表 1 超微型浮游植物各站位细胞丰度(个/mL)Table 1 The cell abundances (cells/mL) of picophytoplankton in each station
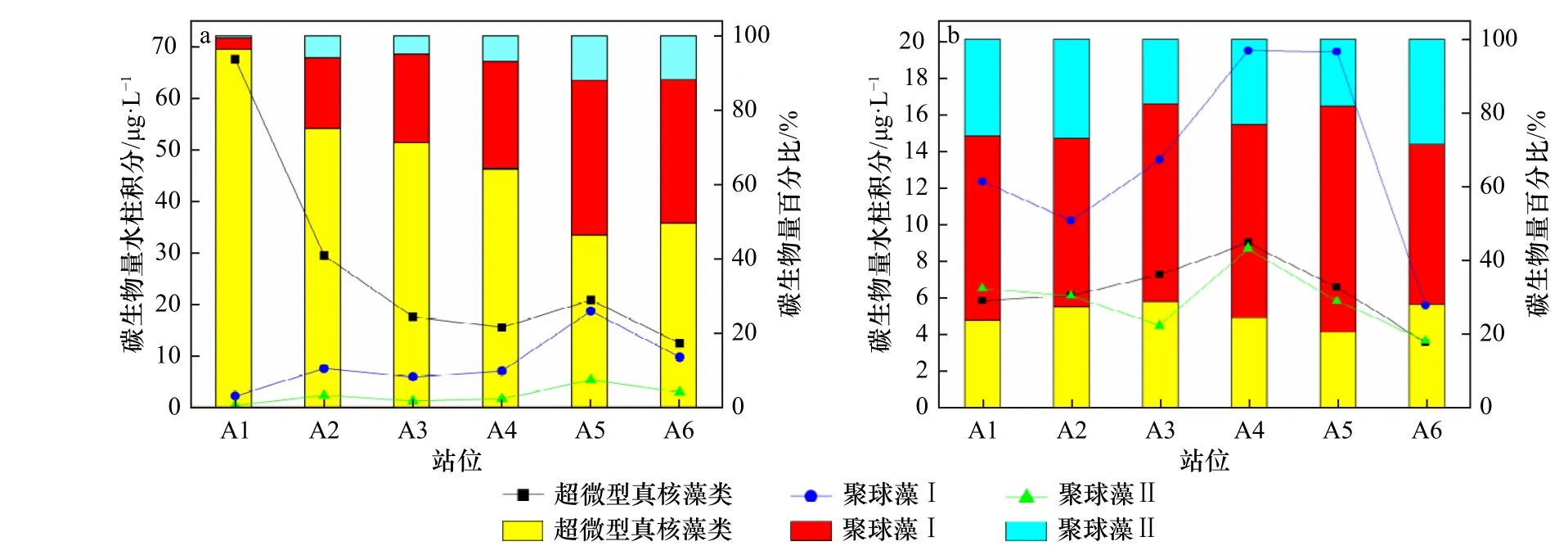
图 3 6 月(a)和8 月(b)超微型浮游植物碳生物量(折线图)及其百分比(柱状图)分布Fig. 3 Picophytoplankton carbon biomass (line chart) and their percentage (histogram) during June(a)and August(b)
为了更便于观察两个褐潮高发期月份的超微型浮游植物细胞丰度随深度的变化,断面分布如图4 所示。6 月份超微型真核藻细胞主要分布在河口A1、A2 站位的表层水体,近岸水域细胞丰度相对较低,且分布较为均匀。聚球藻Ⅰ在河口细胞丰度较低而近岸丰度较高,高值区主要出现在A4 站位的底层。聚球藻Ⅱ细胞丰度分布不均匀,高值区出现在A2 站位的表层和A5 站位的全水层。8 月份,超微型真核藻细胞在河口A2 和A3 站位表层水体丰度较高,近岸A4、A5 站位中层水体附近出现明显的高值区。聚球藻Ⅰ细胞分布和超微型真核藻的细胞分布趋势极为相似。聚球藻Ⅱ细胞则主要分布在表层而且较为均匀。
与6 月份相比,8 月份超微型真核藻细胞丰度在近岸分布不均匀,两个时期A2 站位表层超微型真核藻细胞丰度都相对较高。在8 月份,在河口A2、A3 站位的表层,聚球藻Ⅰ的细胞丰度明显高于6 月份,但是在近岸水体的底层出现下降趋势。聚球藻Ⅱ的分布趋势由6 月份的河口低而近岸高转变为8 月份的表层高而底层底。
3.3 超微型浮游植物细胞丰度和环境因子的关系
调查海域超微型真核藻、聚球藻Ⅰ和聚球藻Ⅱ的细胞丰度与环境因子进行典范对应分析(CCA)如图5所示。CCA 又称多元直接梯度分析,它将对应分析和多元回归分析相结合,每一步计算均与环境因子进行回归,从而详细直接地表明物种与环境因子的关系[25–26]。本次研究的环境因子主要包括:温度、盐度、深度、光照以及营养盐(硝酸盐、亚硝酸盐、硅酸盐、磷酸盐和铵盐)浓度。由图5 可知,6 月份超微型真核藻细胞丰度与硅酸盐具有显著的正相关关系,说明硅酸盐与超微型真核藻细胞的生长具有很强的相关性,聚球藻Ⅰ细胞丰度与硝酸盐、铵盐存在正相关关系,说明硝酸盐和铵盐是聚球藻Ⅰ细胞生长的主要控制因子。在8 月份,超微型真核藻细胞丰度与硅酸盐、硝酸盐和亚硝酸盐都存在正相关关系,说明超微型真核藻的生长受到多种营养盐的共同作用。聚球藻Ⅱ细胞丰度与光照呈正相关,这表明光照是影响聚球藻Ⅱ分布的关键因素。

图 4 调查海域超微型浮游植物丰度的断面分布Fig. 4 Sectional distributions of picophytoplankton abundance in the study area

图 5 调查海域超微型浮游植物与相关环境因子的CCA 二维排序图Fig. 5 Canonical correspondence analysis of related environmental factors with the abundance for picophytoplankton in the study area
4 讨论
4.1 褐潮高发期超微型浮游植物细胞丰度及分布的变化
之前,人们通过色素分析和分子生物学鉴定等技术研究发现,秦皇岛海域褐潮藻的优势种主要是抑食金球藻(Aureococcus anophagefferens)[27–30]。但是研究发现,可以引发秦皇岛海域褐潮的超微型藻类并非这一种。于杰等[31]发现渤海海域的褐潮可能是由抑食金球藻和多形微眼藻(Minutocellus polymorphus)这两种藻类共同形成的。宋伦等[32]首次发现渤海海域褐潮致灾种为微拟球藻(Nannochloris sp.)和金牛微球藻(Ostreococcus tauri),它们在整个超微型浮游植物群落中占绝对优势,抑食金球藻虽然也是褐潮原因种,但是其优势度较低。Zhang 等[33]基于从褐潮暴发期采集的自然种群,采用流式细胞分选技术,后继分离纯化,经过透射和扫描电镜观测及复合的分子鉴定技术,确认其为颗粒微拟球藻(Nannochloropsis granulata)。秦皇岛海域属于渤海海域,所以该海域在褐潮高发期超微型真核藻的优势种可能为抑食金球藻、颗粒拟微球藻等其他超微型真核藻类。本次研究的超微型真核藻类中可能会存在这些褐潮种类群,并且其细胞丰度在6 月份明显高于8 月份,这与其他研究结果也较一致[30,34]。褐潮种在营养盐充足的条件下,具有繁殖周期短、生长速度快等特点。秦皇岛海域水体富营养化严重,能够为褐潮种提供充足的氮、磷等主要的营养元素,因此,该海域非常适合其生长。另一方面浮游动物对褐潮藻的摄食压力相对于微型浮游植物较小,这也是促进褐潮发生的一个重要的因素[35–36]。总之,褐潮的暴发和持续与水体中有机营养物的种类和浓度、生物群落结构的改变以及水体流通速率等因素及其相互之间复杂的相互作用密切相关[37–39]
在6 月份,河口冲淡水会带来植物生长所必需的充足的营养盐和微量元素,这使得河口附近的环境更加适合超微型真核藻类的生长,所以其细胞丰度也呈现河口高而近岸低的分布特点(图4)。随着超微型真核藻细胞丰度从河口到近岸的降低,聚球藻Ⅰ和聚球藻Ⅱ细胞丰度逐渐升高,尤其是在河口A1 站位,超微型真核藻细胞丰度最高,而聚球藻Ⅰ和聚球藻Ⅱ细胞丰度最低。这表明在6 月份,褐潮藻会对聚球藻Ⅰ和聚球藻Ⅱ细胞的生长产生抑制作用,并且从聚球藻Ⅰ和聚球藻Ⅱ在褐潮高发期的细胞丰度的变化来看,褐潮藻对聚球藻Ⅱ细胞生长的抑制作用更强。在6 月份,超微型真核藻类对聚球藻Ⅰ和聚球藻Ⅱ细胞生长的抑制作用主要体现在两方面,一方面是因为褐潮藻的生长占据了聚球藻Ⅰ和与聚球藻Ⅱ的生存空间;另一方面是因为褐潮藻大量繁殖生长后会造成低光的恶劣的水体环境,而光照则是控制聚球藻细胞丰度分布的关键因子[17]。随着超微型真核藻的细胞丰度由河口到近岸站位的逐渐降低,这种抑制作用也会逐渐削弱,聚球藻Ⅰ与聚球藻Ⅱ的细胞丰度也有所提升。在8 月份,随着褐潮藻丰度的逐渐降低,调查海区生物分布逐渐恢复正常。超微型真核藻细胞丰度与6 月份相比明显降低,聚球藻Ⅰ与聚球藻Ⅱ的细胞丰度明显升高,其中聚球藻Ⅰ的细胞丰度与细胞碳生物量占据明显的优势,聚球藻Ⅱ细胞丰度虽然比超微型真核藻细胞丰度高,但是由于超微型真核藻碳转换系数高,所以二者总的碳生物量相差不大。
4.2 相关环境因子对超微型浮游植物细胞丰度及其分布的影响
营养盐是超微型浮游植物生长繁殖的必须条件[40]。与8 月份相比,6 月份水体中硝酸盐、亚硝酸盐与硅酸盐的浓度明显较小。这是因为褐潮经常发生在自养型浮游植物(如硅藻)的大量繁殖之后,这些浮游植物和褐潮藻的生长,会消耗水体中大量的无机营养盐,从而导致6 月份水体中的无机营养盐浓度较低。在6 月份,硅酸盐浓度在河口站位较高,而超微型真核藻也主要分布在河口附近,通过相关性分析得到了超微型真核藻细胞丰度与硅酸盐浓度具有正相关关系,这可能是因为在6 月份,褐潮藻的过度生长繁殖抑制了硅藻等消耗硅酸盐藻类的正常生长[41],从而导致6 月份超微型真核藻细胞丰度与硅酸盐呈正相关关系。由于褐潮藻的生长受硝酸盐、亚硝酸盐与磷酸盐的影响不大,因此在6 月份超微型真核藻细胞丰度与这些营养盐并没有明显的相关性。通过对6 月份聚球藻Ⅰ细胞丰度与硝酸盐和铵盐的相关性分析发现,其细胞丰度与硝酸盐和铵盐具有正相关关系,这是由于聚球藻Ⅰ的氮源主要是铵盐和硝酸盐,当硝酸盐浓度在A4、A5 站位较高时,其细胞丰度在该水域也相对较高。在6 月份,由于聚球藻Ⅰ与聚球藻Ⅱ的细胞丰度与分布主要受到褐潮优势种的影响,因此其他环境因子对二者的影响相对较小,在6 月份它们与其他环境因子并没有明显的相关性。在8 月份,褐潮优势种对超微型浮游植物的影响逐渐消失,调查海区生物分布逐渐恢复正常,其丰度与分布主要受营养盐、温度和光照等因素的影响。目前发现的超微型真核藻具有40 多个属,属于13 个纲[42],由于超微型真核藻的细胞种类丰富,导致其生长对营养盐的依赖性比较大,并且对多种营养盐均有吸收,所以超微型真核藻细胞丰度与硝酸盐、亚硝酸、磷酸盐与硅酸盐都具有正相关关系。该海区河口冲淡水为超微型浮游植物的细胞的生长提供了大量的营养盐,因此超微型真核藻、聚球藻Ⅰ与聚球藻Ⅱ在河口A2 和A3 站位表层水体细胞丰度都相对较高。超微型浮游植物的生长繁殖消耗吸收了大量的营养盐,导致河口A2、A3 站位表层水体各种无机营养盐的浓度都相对较低。调查海域,超微型真核藻的分布还受到温度和光照的影响,超微型真核藻主要分布在10 m 以上浅水层。在8 月份,硝酸盐作为聚球藻Ⅰ的氮源,与其呈正相关关系,当硝酸盐浓度在A5 底层浓度较高时,聚球藻Ⅰ的细胞丰度也较高。聚球藻Ⅱ的分布从河口到近岸都呈现表层高,底层低的分布特点,这表明温度与光照是影响其分布的关键因素,聚球藻Ⅱ能够适应较高的温度,随着水深的增加,温度与光照强度降低,聚球藻Ⅱ的丰度也逐渐下降。
5 结论
通过对秦皇岛海域现场调查和流式细胞仪检测分析超微型浮游植物,主要发现了聚球藻和超微型真核藻两大类群,其中聚球藻又分为聚球藻Ⅰ和聚球藻Ⅱ两个亚群。通过对比褐潮高发期两个月份水体中超微型浮游植物的丰度、碳生物量及分布变化以及相关性分析可得:(1)在6 月份,调查海域的营养盐环境促进了褐潮藻的生长,高密度的褐潮藻抑制了聚球藻Ⅰ和聚球藻Ⅱ细胞的生长,因此超微型真核藻的细胞丰度呈现河口高、近岸低的分布趋势而聚球藻Ⅰ和聚球藻Ⅱ的细胞丰度现河口低、近岸高的分布趋势;(2)在8 月份,调查海区生物分布逐渐恢复正常,超微型浮游植的分布受温度,光照以及河口冲淡水引起的营养盐变化的共同影响。

