饮用水中三氯甲烷与其他氯消毒副产物在活性炭上的吸附竞争研究
张平,杨岳平,赵丹,武云霞,陈莎莎
(浙江大学 环境与资源学院,浙江 杭州310058)
氯消毒作为饮用水处理中的常用消毒工艺虽然保障了饮用水的安全,但是消毒剂可与水体中的天然有机物如腐殖酸(HA)等反应生成三卤甲烷(THMs)、卤乙酸(HAAs)等消毒副产物。三卤甲烷具有致畸性、致癌性、致突变性,可引起肝、肾和肠道肿瘤以及神经、生殖系统疾病[1-2],且致癌风险会随着年龄与接触时间的增加而升高[3]。卤乙酸是继三卤甲烷之后水体中第二大类消毒副产物,该物质难挥发、难降解且具有亲水性,致癌,毒性表现也较复杂,多表现在对人体生殖系统的毒害和对胚胎发育的影响,导致胎体畸形和生长缓慢[4]。控制饮用水中三卤甲烷的方法主要有活性炭吸附、高级氧化、膜分离、紫外光解以及曝气吹脱等技术,控制卤乙酸的方法主要有活性炭吸附、高级氧化、还原脱卤以及微生物降解等技术[5-6]。相比之下,活性炭吸附技术由于处理过程简易、经济性良好以及可重复利用等原因,被美国环保局(USEPA)列为最实用的技术[7]。
由于各地水体自然条件和当地自来水厂处理效果不一,水体中检出的消毒副产物含量存在差异。郭庆龄[8]对全国不同域的40 多个城市的自来水样品进行检测后得到:我国自来水水体中消毒副产物以三氯甲烷为主,其次是二氯一溴甲烷和一氯二溴甲烷,三溴甲烷最低。此外,对我国华北、西北、华中、华东地区的5个城市的自来水样品进行卤乙酸浓度抽样检测后得:自来水水体中,4个城市的二氯乙酸(Cl2CHCOOH)与三氯乙酸(Cl3CCOOH)浓度小于10 μg·L-1,1个城市的二氯乙酸、三氯乙酸浓度分别为13.518,6.622 μg·L-1。但是,5个样品中有3个城市的自来水中二氯乙酸浓度高于三氯乙酸,此结果与区良益等[9]的检测结果一致,即自来水水体中二氯乙酸是主要的卤乙酸。目前,国内外使用活性炭对三卤甲烷和卤乙酸单独的吸附研究较多,而针对低浓度混合体系下活性炭对三卤甲烷和卤乙酸的吸附研究及吸附效果研究较少。因此,结合现行《生活饮用水卫生标准》(GB5749—2006)以及实际水体中消毒副产物的存在情况,本文将探究低浓度情况下(国标限值)三氯甲烷与二氯一溴甲烷和二氯乙酸在活性炭上的吸附竞争关系以及浓度变化对彼此去除效果的影响。
1 实验材料与方法
1.1 实验材料
1.1.1 活性炭
选自唐山联合炭业科技有限公司,椰壳活性炭。该活性炭物理性质见表1。

表1 活性炭物理性质Table1 Physical properties of activated carbon
活性炭样品在使用前用去离子水清洗多次直到没有浮尘,置于105℃烘箱中烘干至净重无变化,储存备用。
1.1.2 试剂与仪器
实验试剂:三氯甲烷、二氯乙酸、无水硫酸、碳酸氢钠,AR;二氯一溴甲烷,98%;硫酸、甲醇,GR;甲基叔丁基醚,色谱纯;1,2-二溴丙烷(IS),99%;三氯甲烷标准品,1 000 μg·mL-1;二氯一溴甲烷标准品,455 μg·mL-1;二氯乙酸标准品,1 000 μg·mL-1。
实验仪器:Agilent7820 气相色谱仪(ECD 检测器);HP-5 毛细管柱,30 m×0.320 mm´0.25 μm。
1.2 实验方法
1.2.1 CHCl3、CHBrCl2、Cl2CHCOOH单组分吸附实验(一元吸附体系)
吸附等温线测定:配制初始浓度为2 mg·L-1的单组分溶液,取50 mL溶液置于盛有不同质量活性炭(0.02,0.04,0.06,0.08,0.10,0.12,0.15 g)的250 mL 具塞锥形瓶中,至吸附平衡后测定上清液中物质的浓度。
1.2.2 CHCl3-CHCl2Br、CHCl3-Cl2CHCOOH混合体系吸附实验(二元吸附体系)
(1)吸附等温线测定:配制初始浓度为2 mg·L-1、浓度比为1:1的CHCl3-CHCl2Br混合溶液,取50 mL溶液置于盛有不同质量活性炭(0.02,0.04,0.06,0.08,0.10,0.12,0.15g)的250 mL 具塞锥形瓶中,至吸附平衡后测定上清液中物质的浓度。CHCl3-Cl2CHCOOH 混合体系配制过程同上。
(2)相互影响实验:按《生活饮用水卫生标准》(GB5749—2006)三氯甲烷标准限值控制二元体系中CHCl3浓度不变(60 μ g·L-1),配制不同CHBrCl2浓度的CHCl3-CHBrCl2混合溶液,取50 mL溶液置于盛有0.05 g 活性炭的具塞锥形瓶中,震荡2 h后测定上清液中CHCl3的浓度;同样配制CHBrCl2浓度不变的CHBrCl2-CHCl3、CHCl3浓度不 变的CHCl3-Cl2CHCOOH与Cl2CHCOOH 浓度不 变的Cl2CHCOOH-CHCl3混合体系,实验操作同上。
1.2.3 CHCl3-CHBrCl2-Cl2CHCOOH 混合体系吸附实验(三元吸附体系)
(1)吸附等温线测定:配制初始浓度为2 mg·L-1、浓度比为1:1:1的CHCl3-CHBrCl2-Cl2CHCOOH 混合溶液,取50 mL溶液置于盛有不同质量(0.02,0.04,0.06,0.08,0.10,0.12,0.15 g)活性炭的具塞锥形瓶中,至吸附平衡,测定上清液中物质的浓度。
(2)相互影响实验:控制混合体系中CHCl3与CHBrCl2浓度不变(浓度为60 ug·L-1、浓度比为1:1),配制不同Cl2CHCOOH浓度的CHCl3-CHCl2Br-Cl2CHCOOH 混合体系,取50 mL溶液置于盛有0.05 g 活性炭的具塞锥形瓶中,震荡2 h后,测定上清液中CHCl3与CHCl2Br的浓度;同样配制CHCl3与Cl2CHCOOH浓度不变的CHCl3-CL2CHCOOHCHBrCl2混合体系以及CL2CHCOOH与CHBrCl2浓度不变的Cl2CHCOOH -CHBrCl2-CHCl3混合体系,实验操作同前。
以上实验中水体的pH值为7.0~7.5,水浴恒温振荡器震荡条件为25℃、160 r·min-1。
1.2.4 不同体系对活性炭吸附消毒副产物吸附容量的影响实验
针对不同体系可能对活性炭吸附消毒副产物的吸附容量造成的影响进行实验分析。该实验中,各组分消毒副产物初始浓度均为60 μg·L-1,吸附时间为2 h,活性炭投加量为0.01 g。其中二元吸附体系中CHCl3与Cl2CHCOOH、CHBrCl2各自按1:1 配制,浓度为60 μg·L-1;三元吸附体系中CHCl3与Cl2CHCOOH、CHBrCl2按1:1:1 配置,浓度为60 μg·L-1。
1.3 测定方法
1.3.1 三氯甲烷与二氯一溴甲烷
三氯甲烷与二氯一溴甲烷采用毛细管柱气相色谱法:取5 mL 水样经水系滤头过滤后置于20 mL 螺纹顶空瓶中,盖紧瓶盖后放到40℃恒温水浴锅中水浴1 h,用50 μg 气密性微量注射器吸取顶空瓶上部气体50 μg 注入气相色谱仪进行测定;该样品需要在12 h内完成检测。
气相色谱仪检测条件:Agilent 7820 气相色谱仪,附有ECD 检测器,毛细管柱,HP-5,30 mP-5,30 mm-5,30 μm;进样口温度为200℃;检测口温度为280℃;柱温45℃保持3 min,再以2℃·min-1的速度升温至70℃,保持1 min;载气流量1 mL·min-1,采用分流进样,分流比2:1。
标准曲线绘制:将三氯甲烷标准品与二氯一溴甲烷标准品用甲醇稀释为1 000 μg·L-1的混合中间液,再用去离子水将中间液配制成浓度梯度为10,20,50,100,200 μg·L-1的标准使用液。之后将各浓度的标准使用液经上述操作依次进行测定,根据峰面积用外标法绘制三氯甲烷与二氯一溴甲烷的标准曲线并保存。
1.3.2 二氯乙酸
二氯乙酸采用美国EPA 液液萃取衍生酯化气相色谱法:取20 mL 水样于60 mL 梨型分液漏斗,加入2 mL 浓H2SO4,迅速加入8 g(±0.005)无水Na2SO4,盖紧瓶塞摇晃直到容器中固体完全溶解;准确量取4 mL 含有内标物质1,2-二溴丙烷(300 μg·L-1)的MTBE 置于分液漏斗中,盖紧瓶盖,剧烈摇晃萃取5 min,摇晃过程中注意放气;摇晃结束后静置5 min,待有机相分层后弃去水相,吸取2 mL有机相放于20 mL 螺纹顶空瓶中,然后向其中加入1 mL 新配制的1:9 酸化甲醇,盖紧瓶盖放到50℃恒温水浴锅中1 h;1 h后取出样品迅速放入冰箱冷藏室冷藏5 min,随后逐次向瓶中加入1 mL 饱和NaHCO3,盖好瓶盖剧烈摇晃30 s,共添加4 mL 饱和NaHCO3静置分层,每次摇晃结束后放气;吸取上清液经无水硫酸钠脱水后置于2 mL 血浆瓶中,等待手动进样。注意,由于HAAs 样品预处理步骤复杂,实验过程中的移液、手动进样需要精确操作。处理好的样品可在-4℃条件下保存1周。
气相色谱仪检测条件:Agilent 7820 气相色谱仪,附有ECD 检测器,毛细管柱,HP-5,30 mP-5,30 mm-5,30 μm;进样口温度为210℃,分流进样,分流比10:1;检测口温度为300℃;柱温40℃保持2 min,再以2.5℃·min-1程序升温到65℃保持1 min;载气流量为2 mL·min-1,采用分流进样,分流比10:1。
标准曲线绘制:将二氯乙酸标准品用甲醇配成1 000 μg·L-1的中间液,再用去离子水将中间液配制成浓度梯度为10,20,50,100,200 μg·L-1的标准使用液(用甲醇做溶剂的原因是提高水溶性,避免用MTBE 做溶剂配置的使用液出现分层现象)。此外,需要配置含有300 μg·L-1内标物质的MTBE溶液作为萃取剂。之后将各浓度的标准使用液经上述操作依次进行测定,根据待测物质与内标物质的峰面积及相对校准因子用内标法绘制二氯乙酸的标准曲线并保存。
2 结果与讨论
2.1 不同混合体系中3种污染物质的吸附等温线及拟合结果
图1~图3分别为三氯甲烷、二氯一溴甲烷、二氯乙酸3种消毒副产物在不同吸附体系下拟合出的吸附等温曲线,发现各个消毒副产物在多元体系下的吸附能力都小于单独吸附时,且随着吸附体系中物质的逐渐增多,吸附效果逐渐下降。
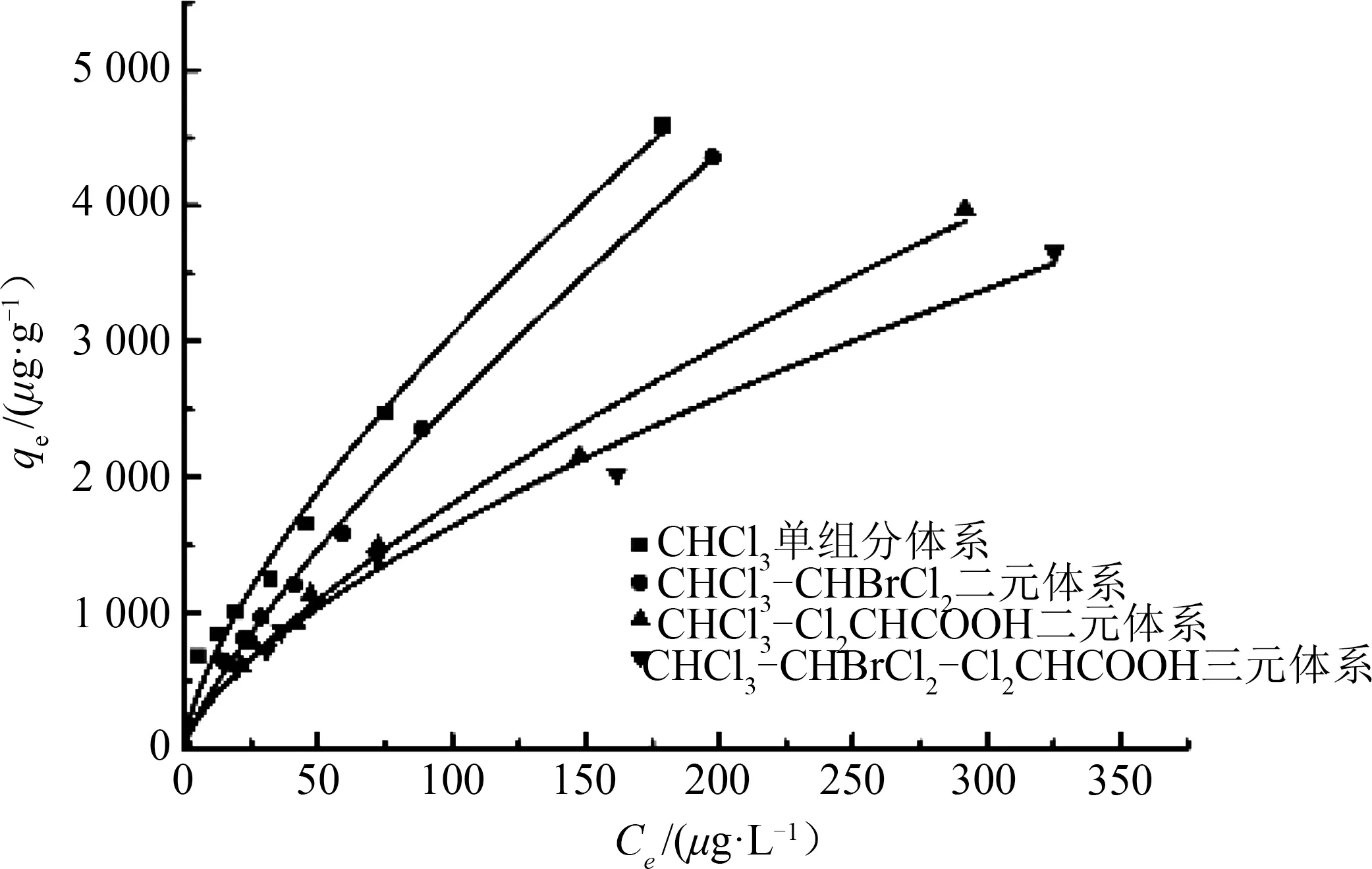
图1 单组分体系与多元混合体系中三氯甲烷吸附等温线Fig.1 CHCl3 adsorption isotherm in a one-componentsystem and a multi-component system
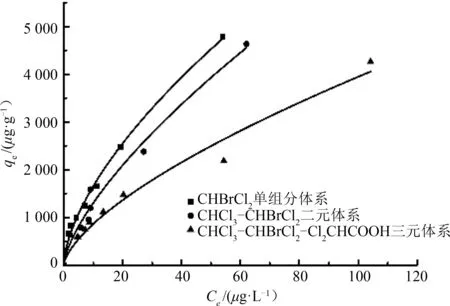
图2 单组分体系与多元混合体系中二氯一溴甲烷吸附等温线Fig.2 CHBrCl2 adsorption isotherm in a one-component system and a multi-component system
由图1~图3可知:相同实验条件下,三氯甲烷在单组分吸附体系中的平衡吸附容量比CHCl3-CHBrCl2、CHCl3-Cl2CHCOOH、CHCl3-CHBrCl2-Cl2CHCOOH 混合体系高,且在2 mg·L-1的浓度条件下,去除率分别高出0.5%~1.3%,0.9%~6.8%,0.9%~9.6%;同样,二氯一溴甲烷在2 mg·L-1的浓度条件下,单组分吸附体系的去除率较二元体系和三元体系分别高出0.03%~0.5%和0.2%~2.8%;此外,相比二氯一溴甲烷,二氯乙酸对活性炭吸附三氯甲烷的影响更大,且同时影响活性炭对二氯一溴甲烷的吸附效果,而前两者的加入对二氯乙酸虽有影响,但影响并不显著。因此,为了更好地描述3种消毒副产物之间的竞争吸附关系,分别对其用Langmuir模型和Freundlich模型进行数据拟合。
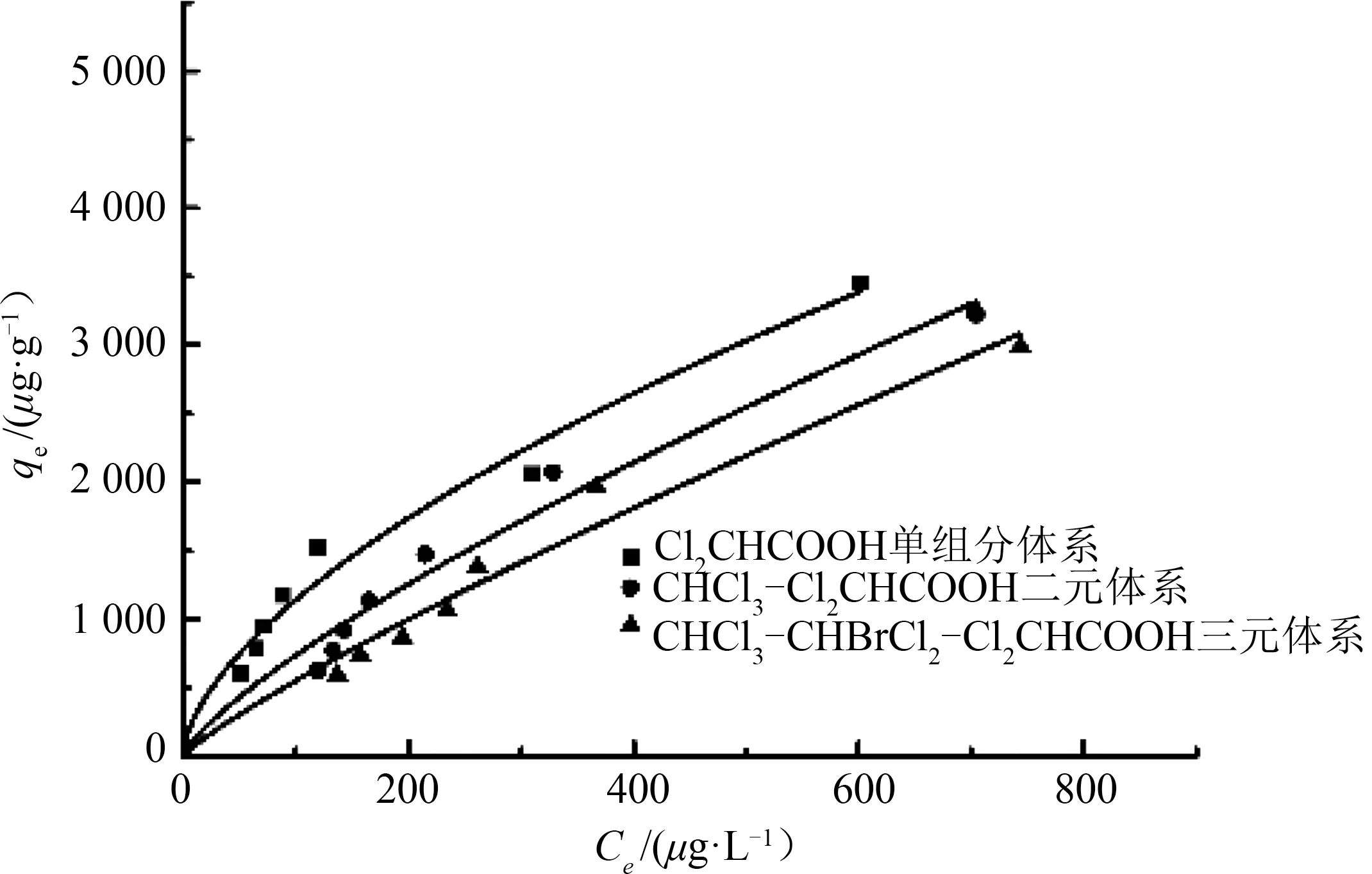
图3 单组分体系与多元混合体系中二氯乙酸吸附等温线Fig.3 Cl2CHCOOH adsorption isotherm in a onecomponent system and a multi-component system
液相吸附一般多采用Langmuir模型和Freundlich模型进行分析,本实验也分别用这两种经验模型进行拟合并做比较,拟合结果见表2。
Langmuir吸附模型:
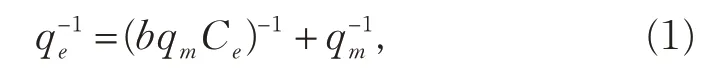
式中,Ce是吸附达到平衡时的浓度(μg·L-1);qe是平衡吸附量(μg·g-1);b是Langmuir常数(L·μg-1);qm是吸附质的极限吸附量(μg·g-1)。qm与b的值可以通过拟合直线Ce/qe-Ce的斜率与截距计算。
Freundlich吸附模型:
式中,qe,Ce同 上,n为浓度指数,K为Freundlich常数。n和K的值也可以通过直线lnqe-lnCe的斜率和截距计算得到。
由图1~图3及表2可知:(1)三氯甲烷、二氯一溴甲烷的Freundlich模型拟合度较高,而活性炭对二氯乙酸的吸附更符合Langmuir模型;(2)由Freundlich 经验常数n可知(n越大越好,一般认为n>2时吸附效果优秀,n<0.5表示难吸附),不管在单组分还是多组分吸附体系中,活性炭对二氯一溴甲烷的吸附效果比三氯甲烷好,同时活性炭对其两者的吸附效果均优于二氯乙酸,表明活性炭在吸附同一类物质时,分子量越大吸附效果越好,且对烷烃类有机物的吸附效果要好于酸类有机物;(3)在不同体系下,3种物质的Freundlich 拟合模型的经验常数n均在1~10,活性炭对3种物质的吸附效果良好;(4)由于混合体系中三氯甲烷、二氯一溴甲烷以及二氯乙酸3种物质的存在,彼此的吸附容量较单组分吸附体系明显下降,且随着物质种类的增加下降趋势越显著,证明了3种物质之间存在着吸附竞争现象。
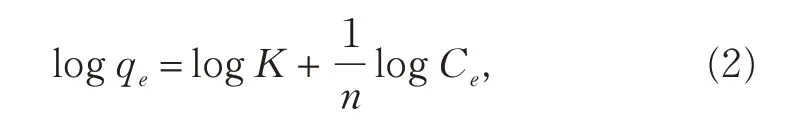
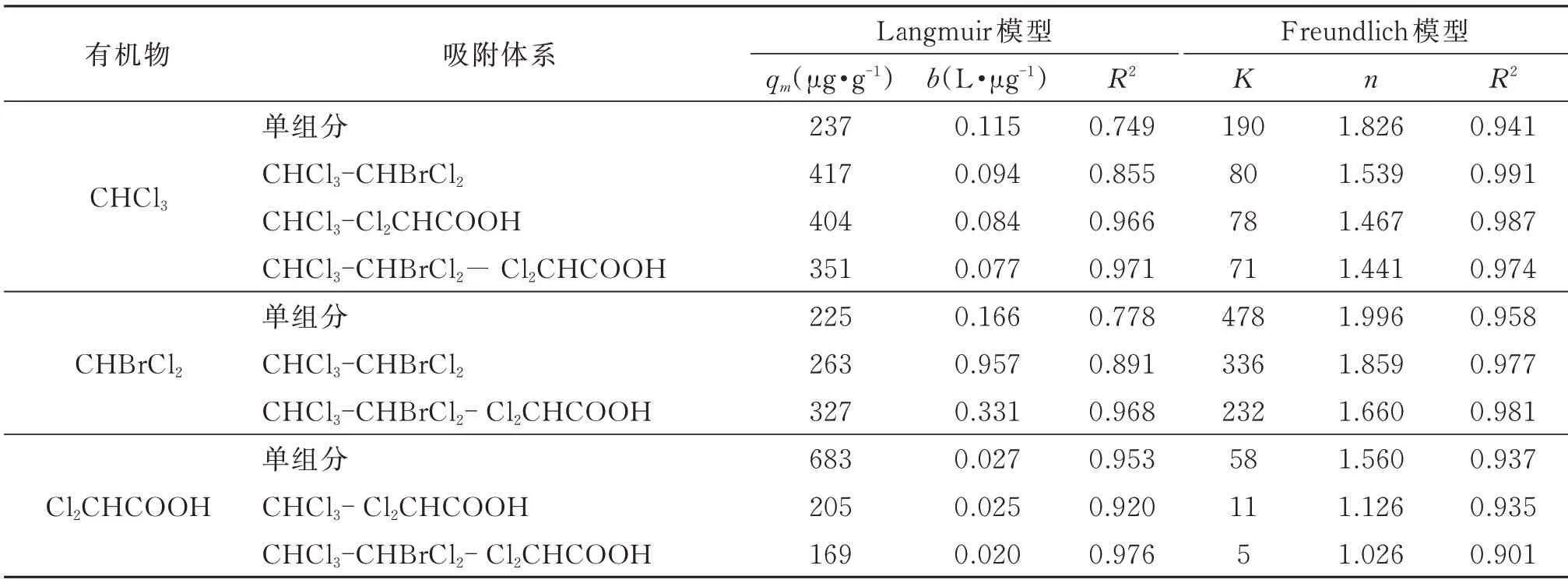
表2 Langmuir、Freundlich模型对3种物质的吸附拟和结果Table2 Adsorption results of three substances by Langmuir and Freundlich models
二氯一溴甲烷与二氯乙酸的投加使得三氯甲烷吸附效果下降明显,直观表现为二元吸附体系Freundlich模型中n和K值的下降,其中CHCl3-CHBrCl2体系中三氯甲烷的n值较单组分吸附体系下降了15.7%,CHCl3-Cl2CHCOOH 体系较单组分体系下降了19.7%,三元体系中三氯甲烷的n值较单组分体系下降了21.1%;CHCl3-CHBrCl2体系中二氯一溴甲烷较单组分体系的n值下降了6.9%,三元体系较单组分体系下降了16.8%;二氯乙酸单组分吸附体系的n值较CHCl3-Cl2CHCOOH 体系中二氯乙酸的n值下降了27.8%,三元体系较单组分体系下降了34.2%。在CHCl3-CHBrCl2体系中,三氯甲烷K值的下降幅度约为二氯一溴甲烷下降幅度的2倍,在CHCl3- Cl2CHCOOH体系中,二氯乙酸K值下降幅度约为三氯甲烷下降幅度的1.3倍,而在CHCl3-CHBrCl2- Cl2CHCOOH 三元体系中,二氯乙酸的下降幅度约为三氯甲烷和二氯一溴甲烷下降幅度的1.5倍和1.8倍。可见,在CHCl3-CHBrCl2体系中,二氯一溴甲烷处于吸附优势位,CHCl3-Cl2CHCOOH 体系中,三氯甲烷处于吸附优势位,因此,该活性炭对3种物质的吸附能力依次为二氯一溴甲烷、三氯甲烷、二氯乙酸。
2.2 各物质对其他两种物质去除率的影响
针对混合体系中存在的三氯甲烷、二氯一溴甲烷和二氯乙酸之间存在的竞争吸附关系(体系各组分浓度为2 mg·L-1),而实际饮用水体中各物质的浓度级别远低于吸附竞争实验设置的浓度,为此,设计了低浓度多元体系中其他消毒副产物对三氯甲烷的吸附效果影响实验,吸附效果见图4~图6。
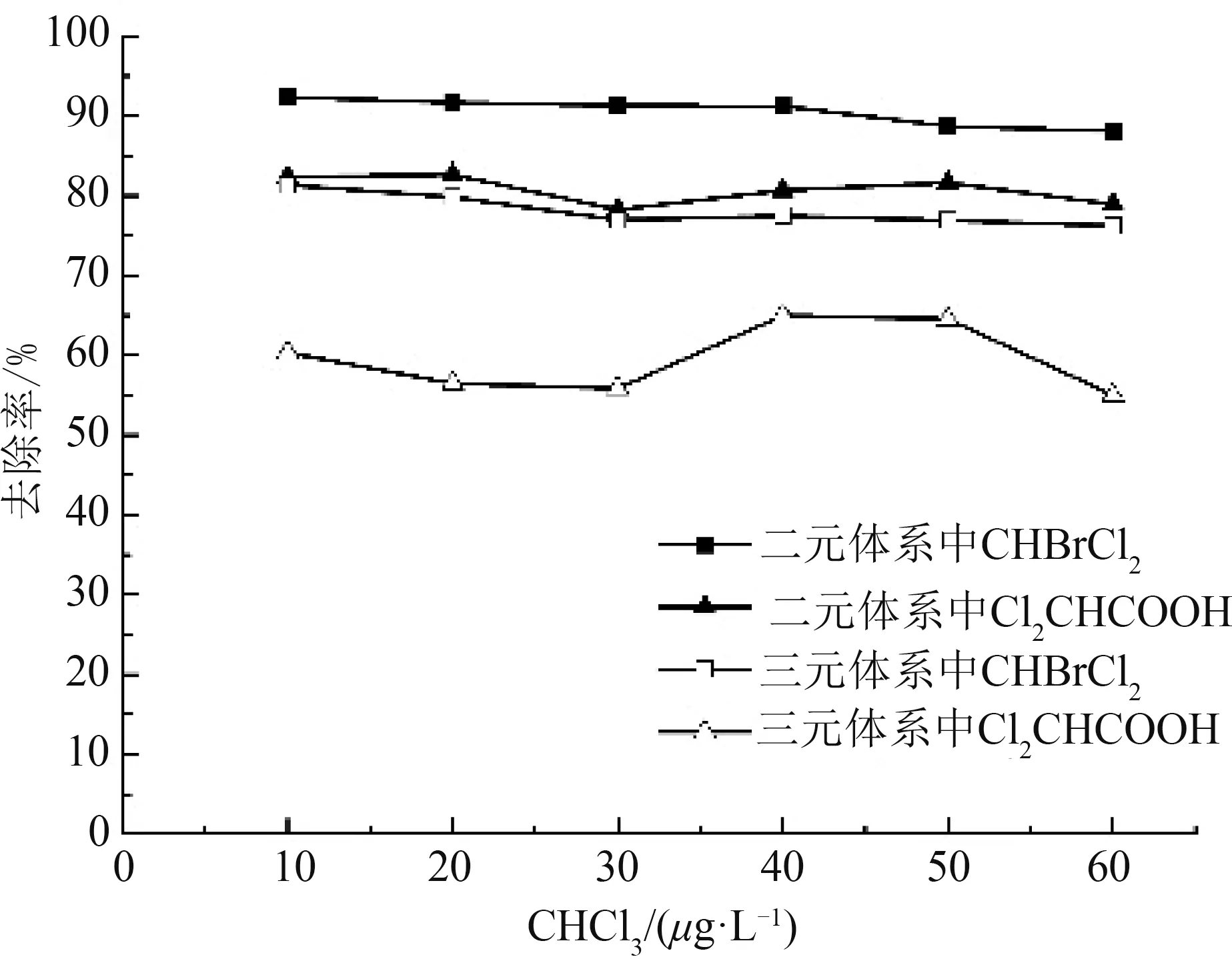
图4 三氯甲烷浓度对活性炭吸附消毒副产物的影响Fig.4 Effect of CHCl3 concentration on adsorption of disinfection by-products by activated carbon
如图4所示,在低浓度条件下,无论在二元体系还是三元体系中,随着CHCl3浓度的升高,活性炭对CHBrCl2与Cl2CHCOOH的吸附效果略有下降,但影响不明显;随着体系中物质种类的增加,活性炭对CHBrCl2与Cl2CHCOOH的吸附效果下降明显:CHBrCl2在三元体系的去除率较二元体系下降了9.2%~12.4%,Cl2CHCOOH 在三元体系的去除率较二元体系下降了16.1%~22.9%。

图5 二氯一溴甲烷浓度对活性炭吸附消毒副产物的影响Fig.5 Effect of CHBrCl2 concentration on adsorption of disinfection by-products by activated carbon
如图5所示,在低浓度条件下,活性炭对CHCl3的吸附效果随着体系中CHBrCl2浓度的升高逐渐降低。二元体系中,随着CHBrCl2浓度从10 μg·L-1升至60 μg·L-1,CHCl3的去除率降低了8.9%,三元体系中,随着CHBrCl2浓度的升高,CHCl3的去除率降低了7.4%;无论是二元体系还是三元体系,CHBrCl2浓度的变化对活性炭吸附Cl2CHCOOH的效果影响不明显;随着体系中物质种类的增多,活性炭对CHCl3与Cl2CHCOOH的吸附效果均有所下降:CHCl3在三元体系的去除率较二元体系下降5.0%~7.4%,Cl2CHCOOH 在三元体系的去除率较二元体系下降5.5%~16.4%。
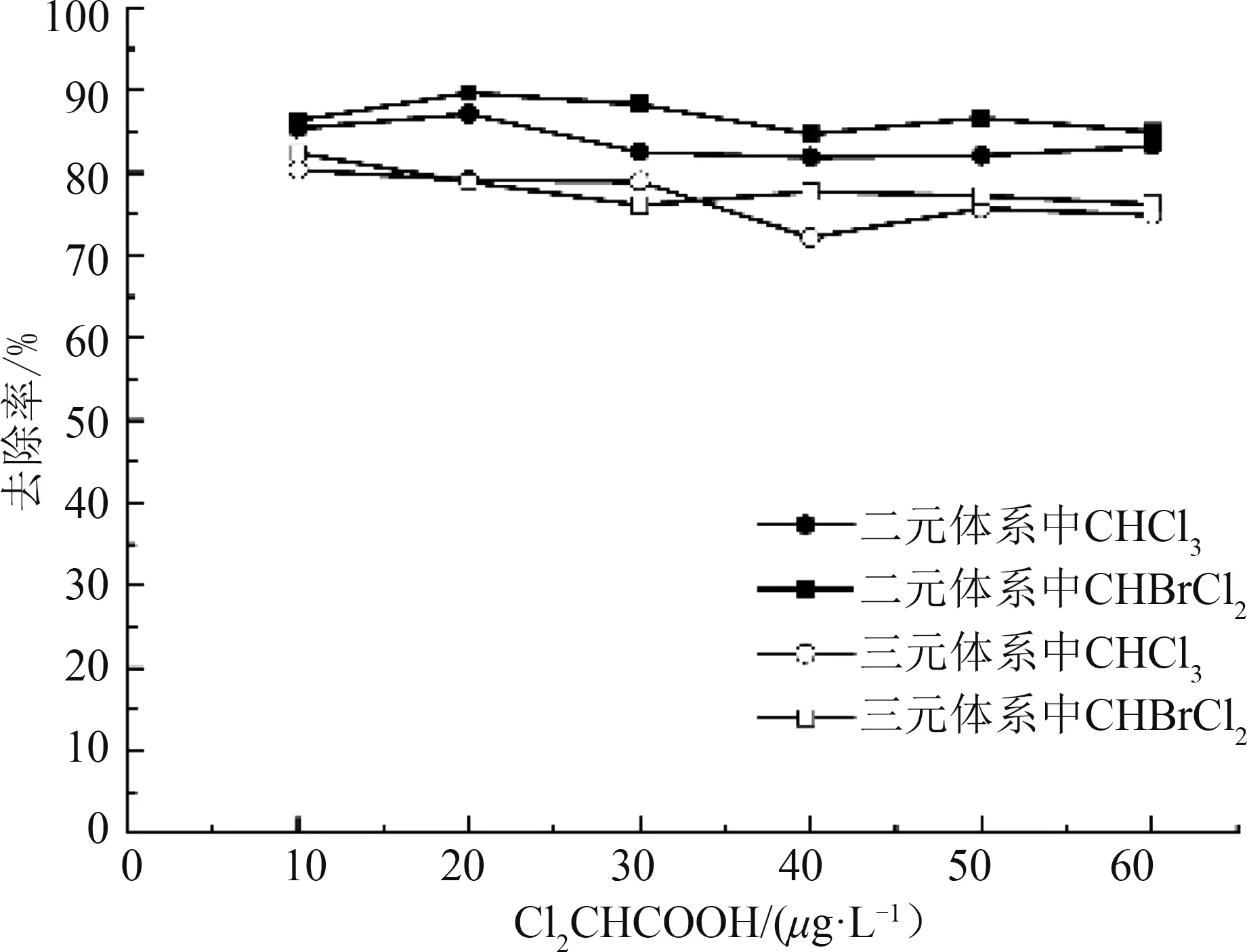
图6 二氯乙酸浓度对活性炭吸附消毒副产物的影响Fig.6 Effect of Cl2CHCOOH concentration on adsorption of disinfection by-products by activated carbon
如图6所示,Cl2CHCOOH浓度的变化对活性炭吸附CHCl3与CHBrCl2影响不明显。随着Cl2CHCOOH浓度的升高,二元体系中,活性炭对CHCl3与CHBrCl2的去除率分别下降了3.9%和5.0%,三元体系中,CHCl3与CHBrCl2的去除率分别下降了5.8%和5.7%;同样,随着体系中物质种类的增多,活性炭对CHCl3与CHBrCl2的吸附效果均有所下降。CHCl3在三元体系的去除率较二元体系下降5.5%~8.4%,CHBrCl2在三元体系的去除率较二元体系下降8.8%~12.2%。
通过比较3种消毒副产物浓度变化对活性炭去除效果的影响可知:(1)随着体系中物质种类的增多,活性炭对3种物质的去除效果均有所下降,下降幅度不同,其中CHCl3与CHBrCl2下降幅度较Cl2CHCOOH 小。这主要由于活性炭对于三氯甲烷、二氯一溴甲烷以及二氯乙酸等小分子有机物(分子量分别为119.38,163.82,128.94)的去除主要依靠活性炭微孔与中孔共同作用,尤其是微孔的发达程度直接决定活性炭吸附小分子有机物的能力。而根据吸附竞争关系知,当体系中同时存在这3种物质时,优先吸附二氯一溴甲烷和三氯甲烷,其占据了主要吸附点位。因此,当二氯乙酸与二氯一溴甲烷或三氯甲烷构成二元吸附体系时,活性炭对二氯乙酸的去除效果相对较差,且体系从二元变成三元,去除效果降幅明显,但受二氯一溴甲烷和三氯甲烷浓度变化的影响较小;(2)比较三氯甲烷和二氯一溴甲烷相互影响可知,二氯一溴甲烷去除率受三氯甲烷浓度变化的影响较小,而三氯甲烷去除率会随二氯一溴甲烷浓度的升高而降低。表明低浓度水体中,二氯一溴甲烷较三氯甲烷具于吸附优势。综合可知,在低浓度水体条件下,活性炭对3种物质的吸附能力依次为二氯一溴甲烷、三氯甲烷、二氯乙酸。除竞争吸附效果外,也有文献表明,活性炭表面含氧官能团的数量对消毒副产物的吸附效果也有影响,不排除活性炭表面官能团对本实验结果的影响[10]。
2.3 不同体系对活性炭吸附消毒副产物吸附容量的影响
由去除率试验可知,活性炭对目标污染物的吸附效果受吸附体系的影响。因此,针对不同吸附体系进行了活性炭对消毒副产物吸附容量的分析,实验结果如图7所示。
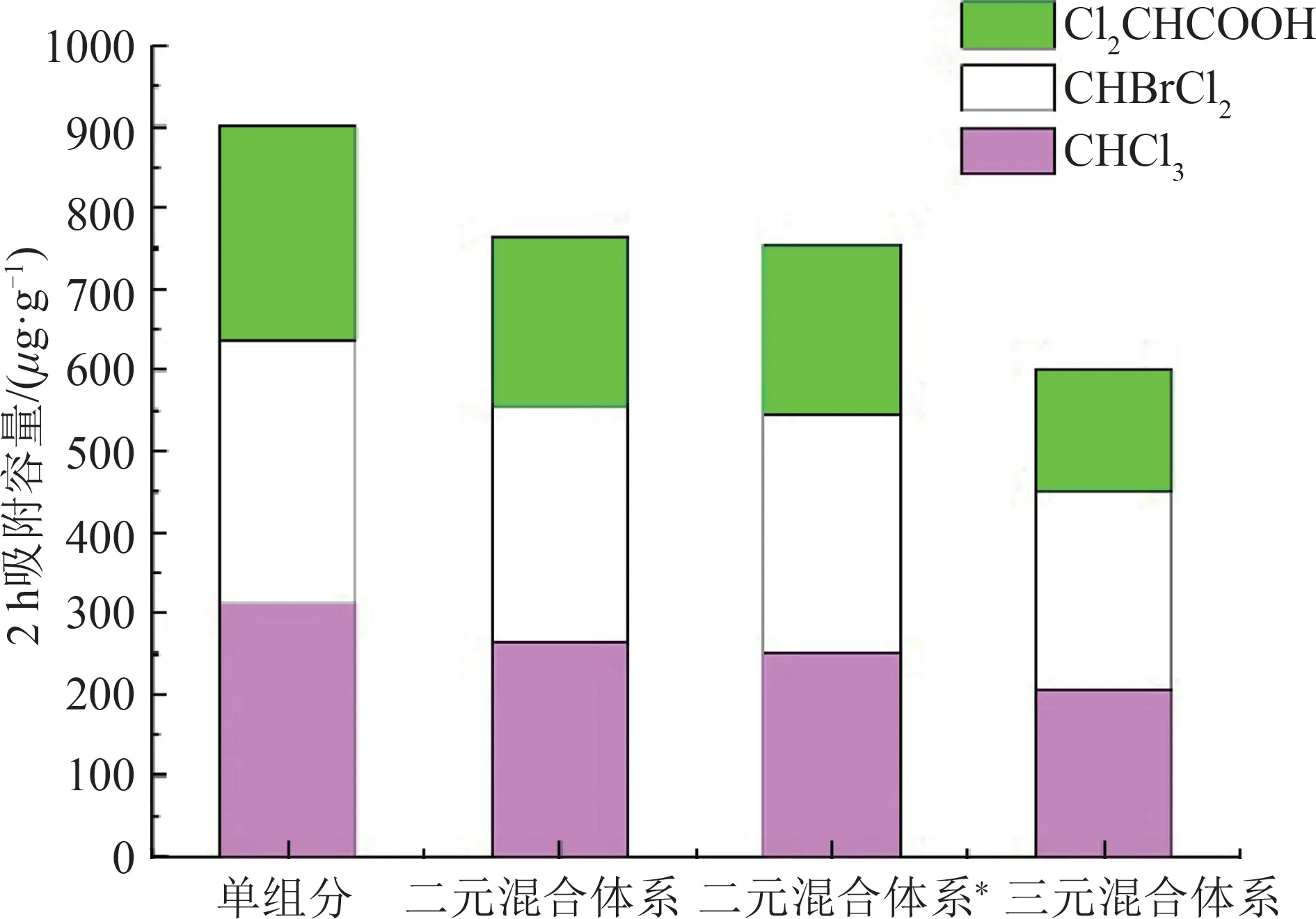
图7 不同吸附体系对活性炭吸附容量的影响Fig.7 Effect of different adsorption systems on adsorption capacity of activated carbon
由图7知,活性炭在多元吸附体系中的吸附总容量高于单组分吸附体系,活性炭在二元吸附体系中的吸附总容量高于三元吸附体系。活性炭在2 h内吸附单组分消毒副产物的吸附总容量在265.37~325.381 μg·g-1;三元吸附体系的吸附总容量为637.12 μg·g-1;而二元吸附体系的吸附总容量在714.82~755.96 μg·g-1,比单组分吸附体系的吸附总容量高出119.7%~184.9%,比三元吸附体系高出12.2%~18.7%。但是对特定的消毒副产物来说,活性炭对它的吸附量随着吸附体系中污染物种类的增加而降低。CHCl3在三元吸附体系中的吸附量为240.665 μg·g-1,比二元体系低18.5%~22%、比单组分体系低34.1%;CHBrCl2在三元体系中的吸附量为245.805 μg·g-1,比二元体系低16.2%、比单组分体系低24.5%;Cl2CHCOOH 在三元体系中的吸附量为165.655 μg·g-1,比二元体系低出20.6%、比单组分体系低37.6%。
分析表明,单组分吸附体系活性炭的吸附总量不如混合体系的原因主要是由于单组分吸附体系在初始浓度为60 μg·L-1的条件下,活性炭在2 h内未达到吸附饱和状态,单组分体系中活性炭的利用率较多元吸附体系低,而混合吸附体系中,由于吸附污染物种类的增加,活性炭吸附利用率也随之升高。活性炭在2 h内的吸附总容量随吸附体系中物质种类的增加而降低,主要是由于活性炭对消毒副产物的吸附速率随体系中污染物种类的增加而降低,具体表现为单位时间内的去除率降低[7]。因此,三元吸附体系达到吸附饱和状态的时间较单组分吸附体系和二元吸附体系长,2 h内活性炭吸附的消毒副产物总量更少。此外,由于活性炭对消毒副产物的竞争吸附,吸附点位与活性炭微孔通道被CHBrCl2优先占据,导致活性炭对CHCl3与Cl2CHCOOH的吸附总量减少。最后,还需要进一步考虑活性炭表面官能团可能对吸附容量造成的影响,如进行相关活性炭表面官能团表征实验等。
3 结 论
3.1 活性炭对三氯甲烷和二氯一溴甲烷的吸附符合Freundlich模型,对二氯乙酸的吸附符合Langmuir模型。
3.2 对比三氯甲烷单组分体系,二元体系和三元体系中活性炭吸附三氯甲烷的能力均有下降,说明二氯一溴甲烷和二氯乙酸对三氯甲烷构成竞争吸附关系。同时由于3种物质均为小分子有机物,因此,3种物质主要就活性炭表面的微孔通道的吸附点位进行竞争。值得一提的是,活性炭表面的微孔很容易被水体中的大分子有机物(如NOM 等)堵塞,造成对目标污染物去除效果的下降。
3.3 根据Freundlich 拟合模型中的浓度指数n和常数K知,该活性炭对3种消毒副产物的吸附均为优先吸附且吸附能力由大到小依次为二氯一溴甲烷、三氯甲烷和二氯乙酸。
3.4 水体在低浓度条件下,活性炭对三氯甲烷、二氯一溴甲烷和二氯乙酸的竞争吸附效果依然存在。活性炭对三氯甲烷和二氯一溴甲烷的吸附优先于二氯乙酸,即当体系中二氯乙酸与三氯甲烷或二氯一溴甲烷同时存在时,活性炭优先吸附三氯甲烷或二氯一溴甲烷;同样,低浓度水体中,活性炭对二氯一溴甲烷的吸附优先于三氯甲烷,因此,活性炭吸附水体中三氯甲烷的效果受二氯一溴甲烷浓度的影响较大。总体表现为当水体中同时存在三氯甲烷、二氯一溴甲烷和二氯乙酸时,活性炭优先吸附二氯一溴甲烷和三氯甲烷,最后吸附二氯乙酸。
3.5 活性炭在多元吸附体系中的2 h 吸附总容量高于单组分吸附体系,其中二元吸附体系的2 h 吸附总容量大于三元吸附体系;然而对于不同体系中同一消毒副产物,活性炭对其的2 h 吸附容量呈现单组分体系、二元吸附体系、三元吸附体系依次降低的趋势。

